应用CT评价急性肺栓塞对家兔心功能的影响*
2013-11-07阮丽波李树清金会艳
阮丽波,李树清,金会艳
右心功能障碍是急性肺栓塞(acute pulmonary embolism,APE)分类的基础,是APE预后不良的重要因素之一[1]。目前核磁共振成像(magnetic resonance imaging,MRI)被认为是右室功能评价的参考标准,但行MRI检测有一定的禁忌症,MRI完成1次心功能检查需要较长时间(15~20 min),且需要反复屏气,这会导致部分患者不能耐受或者不同呼吸间的图像错层等,从而影响测量的准确性[2]。CT无创、便捷,已成为APE诊断重要手段。多层螺旋CT(multislice CT,MSCT)在APE诊断中的应用已经比较成熟,但大多使用常规(即非心电门控)CT肺动脉造影(CT pulmonary angiography,CTPA)进行APE的诊断,应用心电门控CTPA评价APE引起的心功能改变国内文献不多。Guo等[3]的研究指出64排多层CT(64-section multi-detector row CT,64-MDCT)对右心功能的评价具有较高的准确性及可重复性。国外研究[4-5]证实心电门控CT可用于肺栓塞后左右心室容积、射血分数、心室内径的检测。在国内应用64-MDCT评价肺栓塞右心功能的研究不多。APE的发生具有不可预知性,在人体无法对APE前后心功能进行比较来阐明APE对心功能的影响,尤其是早期的影响,而APE死亡患者中约有一半的患者死于肺栓塞后1 h内,因此明确APE后早期心功能的变化对于明确APE早期死亡的原因具有重要的意义。本研究通过复制家兔APE模型,应用心电门控CTPA,明确APE前后左右心功能及心室内径的变化,旨在揭示APE对心脏功能与结构的影响及其可能机制。
材料和方法
1 材料
1.1 动物 健康日本大耳白兔7只,雌雄不限,体重2.2~2.6 kg,由昆明医科大学动物室提供,生产许可证号为SCXK(滇)-20050008;动物使用许可证号为SYXK(滇)-20050004。
1.2 主要器材 SIEMENS 64排双源CT,型号 SOMOTOM Definition,德国原装进口,由云南省第一人民医院提供;syngo CT 2008 Volume和View软件,由云南省第一人民医院双源CT提供;RM6240系列多导生理信号采集处理系统,成都仪器厂生产。
2 方法
2.1 血栓的制备 耳缘静脉抽血2 mL,注入无菌离心管内,37℃恒温箱内静置30 min,待其自凝后,放入70℃水浴箱中水浴10 min加固,取出血栓,制成直径1.5~2.0 mm、长15~18 mm的栓子,称重在52.5~70.7 mg之间。
2.2 手术 用3%戊巴比妥钠1 mL/kg经耳缘静脉缓慢注射麻醉后将其仰卧固定于手术操作台上,行气管插管,钝性分离右颈总静脉及右颈总动脉,将自制的右心室导管(用5号输液头皮针剪去针头,末端3 cm左右通过高温处理弯成45°,用浓度125 kU/L肝素生理盐水排空导管内的空气)一端与多导生理信号采集系统连接,另一端插入右心室,可见波幅较大的右心室波。将颈动脉导管(用5号输液头皮针剪去针头,末端剪坡面,用浓度125 kU/L肝素生理盐水排空导管内的空气)一端与多导生理信号采集系统连接,另一端插入右颈总动脉,可见动脉血压波形。
2.3 行64排双源心电门控CT扫描 将右心室导管退回右颈总静脉,家兔仰卧位固定于木板上,左右肋骨下方各用眼科剪剪去直径约2 cm兔毛,用脱毛液脱去绒毛,贴上3M心电图电极板,连接心电图,诱导出心电图,采用80 kV电压,80 mA的电流,以64×0.6 mm的层厚进行心电门控CT扫描,碘帕醇(iopamidol)以1∶1稀释,按每公斤体重2 mL,以1 mL/s注射速率由右颈总静脉注入。
2.4 注入血栓 行CT后将右心导管插入右心室,可见波幅较大的右心室波,注入4个血栓,每个血栓相隔10 min,为防止血栓停留于右心室导管内,每个血栓注入后注入生理盐水2 mL,监测注入血栓前后的右心室内压、血压。
2.5 观察1 h后,结扎右颈总动脉,右心导管退回至右颈总静脉。分别于注血栓后2 h、4 h和8 h再次行64排双源心电门控CT扫描。
2.6 CT扫描后,肝素化(每公斤体重1 mL的肝素盐水)后放血处死动物,解剖肺组织,家兔的肺动脉分为:主肺动脉(main pulmonary artery,MPA)、左右下肺动脉干(pulmonary artery trunk in lower lobe,LPAT)、左右尖叶动脉(pointed lobe artery,PLA)、右肺心叶动脉(heart lobe artery,HA)、右肺中间叶动脉(middle lobe artery,MA)和左右膈叶动脉(diaphragmatic lobe artery,DA),寻找血栓,确定血栓的位置,与CT结果进行对比。
2.7 根据心电周期,每个时点的图像采用层厚0.4 mm、间隔0.4 mm分别重建出10% ~100%(间隔10%)10个期的图像,应用Volume软件先勾勒出左右心室的界限,然后计算出各期的左右心室的容积,采用最大值为舒张末期的容积,最小值为收缩末期的容积,舒张末容积减去收缩末容积为每搏输出量,应用View软件测量出收缩末期及舒张末期的左右心室短轴位的心室内径。
3 统计学处理
数据用均数±标准差(mean±SD)表示,采用SPSS 11.5统计软件处理,APE前后各时点比较采用重复测量资料方差分析,组内以LSD法行两两比较,以P<0.05为差异有统计学意义。
结 果
1 APE后右室内压及动脉血压的变化
APE时右心室收缩压(right ventricular systolic pressure,RVSP)明显升高,以APE即刻最明显(P<0.01),随后逐渐下降;右心室舒张压(right ventricular diastolic pressure,RVDP)APE前后无明显变化(P>0.05)。APE时动脉收缩压(systolic blood pressure,SBP)及舒张压(diastolic blood pressure,DBP)明显降低,直至APE后1 h仍低于栓塞前水平(P<0.01),见图 1。

Figure 1.Changes of right ventricular pressure and blood pressure after APE.Mean±SD.n=7.**P<0.01 vs before APE.图1 APE后右心室压及血压的改变
2 APE后肺动脉CT成像的改变
64排CT肺动脉成像的表现:较大的动脉如左右MPA、左右LPAT、右肺HA和左右DA显示为血管中心或偏心充盈缺损,其周围或者一侧可见造影剂通过;较小的动脉如左右PLA和右肺MA的血栓显示为肺动脉无造影剂或肺动脉分支缺损;与解剖观察相比较,64排CT肺动脉成像对于发现较大动脉血栓的准确率较高,可达100%,见图2、表1。
3 APE后心室舒张及收缩末容积的变化
与APE前比较,栓塞后2 h、4 h及8 h各时点左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)明显降低(P<0.01),左心室收缩末期容积(left ventricular end-systolic volume,LVESV)无明显改变(P>0.05)。与APE前比较,栓塞后各时点右心室舒张末容积(right ventricular end-diastolic volume,RVEDV)及收缩末容积(right ventricular end-systolic volume,RVESV)均明显增加(P<0.01),见图3、4;各时点左、右心室每搏输出量(left ventricular stroke volume,LVSV;right ventricular stroke volume,RVSV)降低(P <0.05),见图5。

Figure 2.CT imaging of pulmonary embolism.A:filling defect of lower lobe pulmonary artery in transverse section;B:filling defect of lower lobe pulmonary artery in multiplanar reformation(MPR);C:filling defect of lower lobe pulmonary artery in MPR;D:pulmonary artery in CT imaging of volume rendering.图2 肺动脉栓塞的CT成像
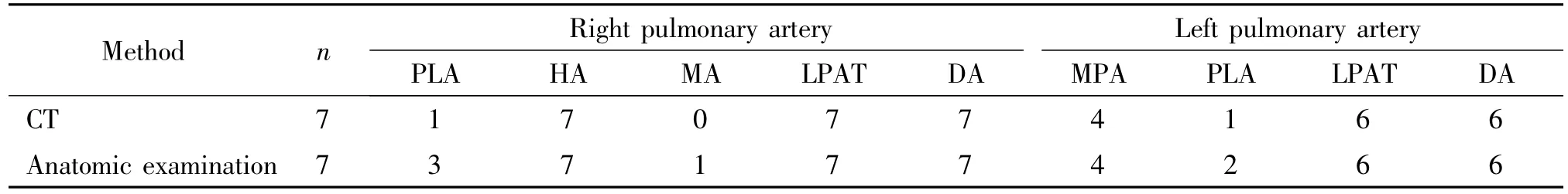
表1 APE后CT成像发现肺动脉血栓与解剖结果的比较Table 1.Comparison of CT imaging and anatomic result for detecting pulmonary lung artery thrombus after APE

Figure 3.Changes of ventricular volume and diameter after APE.A:end-diastolic volume of left ventricle was larger than that of right ventricle before APE;B:end-diastolic volume of right ventricle was larger than that of left ventricle after APE;C:end-systolic diameter of left ventricle was larger than that of right ventricle before APE;D:end systolic diameter of right ventricle was larger than that of left ventricle after APE.图3 APE后左右心室的容积及内径的变化
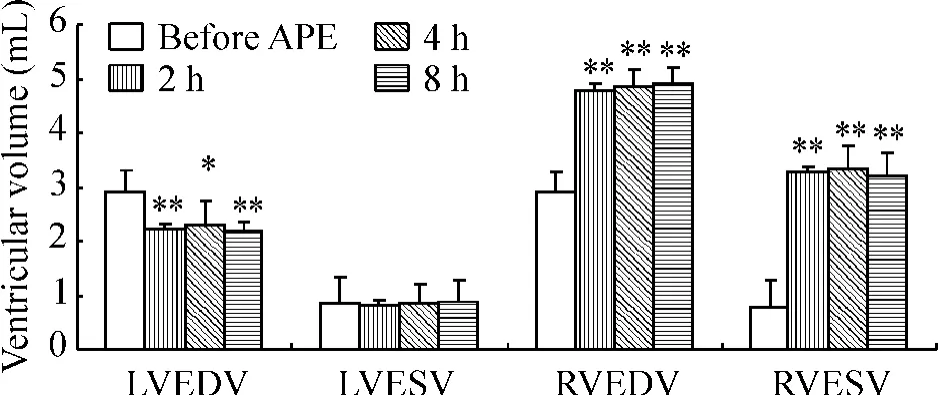
Figure 4.Changes of ventricular volume after APE.Mean±SD.n=7.*P <0.05,**P <0.01 vs before APE.图4 APE后心室容积的变化
4 APE后心室收缩末及舒张末内径变化

Figure 5.Changes of stoke volume after APE.Mean±SD.n=7.*P <0.05,**P <0.01 vs before APE.图5 APE后心搏出量的变化
与APE前比较,栓塞后2 h、4 h及8 h各时点左心室舒张末期的内径(left ventricular end-diastolic diameter,LVEDD)缩小(P<0.05),但左室收缩末期内径(left ventricular end-systolic diameter,LVESD)无显著差异(P>0.05)。APE后各时点右心室收缩末期内 径 (rightventricularend-systolic diameter,RVESD)及舒张末期内径(right ventricular end-diastolic diameter,RVEDD)明显增加(P <0.01),见图 3、6。

Figure 6.Changes of ventricular diameter after APE.Mean±SD.n=7.*P <0.05,**P <0.01 vs before APE.图6 APE后心室内径的变化
讨 论
肺动脉栓塞(pulmonary embolism,PE)是一种常见的心血管疾病,是许多疾病的严重并发症,严重危害着人类的健康,具有较高的发病率及死亡率,致死性PE死亡患者中大约33%死于发病后1 h内,80%患者死于发病后2 h[6],明确高危肺栓塞的早期病理生理改变,分析高危肺栓塞早期死亡的可能原因,是降低高危肺栓塞早期死亡率的关键所在。
临床上通常将肺灌注显像显示50%以上的肺无灌注或栓塞≥2个肺叶动脉者,称为大面积 PE。2008年欧洲心脏病协会(European Society of Cardiology,ESC)肺栓塞的新指南将合并休克或低血压的肺栓塞分为高危PE,本研究中于APE即刻开始RVSP明显升高、血压明显下降,至APE后1 h RVSP仍明显高于APE前,收缩压仍持续低于90 mmHg,解剖及肺CT均证实为大面积的肺栓塞(栓塞≥2个肺叶动脉),因此可以很好地模拟大面积(高危)肺栓塞的病理生理改变。
APE时当肺动脉被阻塞到一定程度后,可导致肺动脉压力及肺血管阻力增加,随肺循环阻力的增加,可出现右心功能不全,急性心功能不全是APE早期死亡的重要原因之一,APE对左心功能的影响一直未引起人们足够重视,其实早在40年代就有学者根据心电图及组织病理学资料提出APE可引起左心室收缩及舒张功能的下降,但目前未见对APE前后左右心功能早期变化进行系统研究的相关报道。
国内应用心电门控CTPA评价APE引起的心功能改变文献不多,Guo等[3]的研究指出64-MDCT对右心功能的评价具有较高的准确性及可重复性,我们通过心电门控CTPA来评估APE前后左右心室容积、内径及每搏输出量变化,发现APE后右心室收缩末及舒张末的容积及右心室内径明显大于APE前,左右心室SV明显减少,说明APE后出现了心功能不全及右心室明显扩大,但2 h后维持相对的稳定状态,这可能是APE 2 h内死亡率高的原因之一。
APE导致心功能不全的原因考虑与下列因素有关:(1)血栓阻塞肺动脉导致的“截留”效应是PE肺动脉高压及肺循环阻力增加的始动因数,是APE导致右心功能不全的主要原因之一。(2)心肌缺血、缺氧:随着右心输出量下降,右室前负荷明显增加,右心室扩张,室壁张力增大,心肌做功及氧耗增加,右侧冠脉灌注压差下降,心肌灌注减少,右室心肌急性缺血缺氧损害进一步使右室功能失代偿。谭焱等[7]证实右冠状动脉血流量随栓塞面积增大而下降更为明显。栓子的机械性堵塞减少了有效肺毛细血管床面积、肺间质和肺泡内渗出及炎性细胞的侵润导致弥散功能的损伤,通气/血流比例失调等因素导致低氧血症,APE后低氧血症进一步加重心肌缺血、缺氧。(3)心室运动的不协调:Sugiura等[8]的研究发现急性肺栓塞后右心室超负荷可导致右心室心肌收缩运动的不协调,从而导致右心室收缩功能受损,随右心室超负荷的好转,右心室运动的不协调可以好转。Takamura等[9]的研究发现:急性肺栓塞导致急性右心室超负荷(acute right ventricular pressure overload,RVPO),可引起左心室收缩的运动不协调,从而导致左心功能受损及左心室的几何形态的改变。(4)左心充盈减少:Marcus等[10]的研究指出:肺动脉高压导致右心室的收缩期间延长,从而导致右心室比左心室收缩时间延迟,左心室充盈减少,左心室舒张末的容积及心搏量减少,延迟的时间与左心室舒张末的容积及心搏量减少成反比。肺栓塞右心室压力和容积负荷增加可导致室间隔左移、左室顺应性减低,可减少左室充盈量和每搏输出量[11],进而减少心输出量,并可能导致体循环低血压。这些又将通过减少冠脉血流,使心功能进一步受损。本研究发现肺栓塞后右心室输出量减少,左心室的舒张末容积明显减少,左心室输出量减少及低血压,右心室明显扩大,左心室舒张末的内径减小,考虑可能与左心室顺应性减低及室间隔左移有关,与文献报道基本相符。
右心功能不全或右心衰竭反映了急性肺栓塞血流动力学变化程度,是整个病理生理改变过程的枢纽,与肺栓塞的严重程度相关[12],是评估急性肺栓塞危险程度和预后的重要指标,右心功能不全是急性肺动脉栓塞预后不良的重要因素之一,Henzler等[5]应用CTA测量右左室短轴内径比值、心脏四腔显示面右左室内径及右左室的容积比,结果显示这3项指标均与栓塞部位(中央型、周围型及无栓塞)明显相关,受试者工作特征(receiver operating characteris-tic,ROC)分析指出右左室的容积比对于区分中央型、周围型及无栓塞有更高的价值,右左室的容积比对于肺栓塞的危险分层更有意义。RVEDD/LVEDD>1与住院死亡率相关,是短期不良预后的有效预测指标[13],本研究发现注血栓前 RVEDD/LVEDD <1,而注血栓后明显>1,为RVEDD/LVEDD>1是短期不良预后的有效预测指标提供了实验依据。
[1] Torbicki A,Perrier A,Konstantinides S,et al.Guidelines on the diagnosis and management of acute pulmonary embolism:the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology(ESC)[J].Eur Heart J,2008,29(18):2276-2315.
[2] Pujadas S,Reddy GP,Weber O,et al.MR imaging assessment of cardiac function[J].J Magn Reson Imaging,2004,19(6):789-799.
[3] Guo YK,Gao HL,Zhang XC,et al.Accuracy and reproducibility of assessing right ventricular function with 64-section multi-detector row CT:comparison with magnetic resonance imaging[J].Int J Cardiol,2010,139(3):254-262.
[4] van der Bijl N,Klok FA,Huisman MV.Measurement of right and left ventricular function by ECG-synchronized CT scanning in patients with acute pulmonary embolism:usefulness for predicting short-term outcome[J].Chest,2011,140(4):1008-1015.
[5] Henzler T,Krissak R,Reichert M,et al.Volumetric analysis of pulmonary CTA for the assessment of right ventricular dysfunction in patients with acute pulmonary embolism[J].Acad Radiol,2010,17(3):309-315.
[6] 张 欣,于文成.肺栓塞的诊治进展:肺栓塞流行病学及临床特征[J].山东医药,2010,50(3):106-107.
[7] 谭 焱,殷桂林,胡建才,等.急性肺栓塞时心肌血流灌注的变化[J].中华实验外科杂志,2006,23(3):316-318.
[8] Sugiura E,Dohi K,Onishi K,et al.Reversible right ventricular regional non-uniformity quantified by speckletracking strain imaging in patients with acute pulmonary thromboembolism[J].J Am Soc Echocardiogr,2009,22(12):1353-1359.
[9] Takamura T,Dohi K,Onishi K,et al.Reversible left ventricular regional non-uniformity quantified by speckletracking displacement and strain imaging in patients with acute pulmonary embolism[J].J Am Soc Echocardiogr,2011,24(7):792-802.
[10] Marcus JT,Gan CT,Zwanenburg JJ,et al.Interventricular mechanical asynchrony in pulmonary arterial hypertension:left-to-right delay in peak shortening is related to right overload and left ventricular underfilling[J].J Am Coll Cardiol,2008,51(7):750-757.
[11]郝恩魁,葛志明,苏国海,等.急性肺栓塞时左右心室压力容量关系变化的实验研究[J].中国病理生理杂志,2007,23(6):1102-1106.
[12]谭 焱,殷桂林,胡建才,等.不同栓塞范围的急性肺栓塞动物模型建立[J].中国病理生理杂志,2006,22(11):2287-2288.
[13] Frémont B,Pacouret G,Jacobi D,et al.Prognostic value of echocardiographic right/left ventricular end-diastolic diameter ratio in patients with acute pulmonary embolism:results from a monocenter registry of 1,416 patients[J].Chest,2008,133(2):358-362.
