高频起搏犬房颤模型心房重塑及窦房结和房室结功能的变化*
2013-11-07刘丽娟姚凤娟彭龙云李嘉翔卢贵华劳妙婵陈宣兰吴素华高修仁
刘丽娟,姚凤娟,彭龙云,李嘉翔,卢贵华,劳妙婵,陈宣兰,吴素华△,高修仁△
心房纤颤(atrial fibrillation,AF;简称房颤)的发生率随着年龄的增长而增大,50岁人群患病率0.5%,80岁的人群患病率接近10%[1]。目前我国正处人口老龄化的时期,AF将成为危害人类健康与生命安全的重要疾病之一。Wijffels等[2]发现AF一旦发生便可促进自身维持,心房纤维化等结构重塑可导致AF维持,这在转基因TX鼠(MHC-TGFcys33ser transgenic mice)已经得到证实[3]。窦房结(sinoatrial node,SAN)和房室结 (atrioventricular node,AVN)对于心率以及房颤时心室率的控制至关重要。AF不仅伴随着显著的心房电生理和结构的重塑[4],且经常并发病态窦房结综合征[5-6]。临床上窦房结疾病也较易伴随AF发生,即所谓的“慢-快综合征”。长期的AF患者心室率有逐渐减慢的趋势[7],动物实验也证实阵发性AF早期阶段心室率往往偏快,当AF持续后心室率趋于减慢[8]。双侧的颈迷走刺激可导致窦房结和房室结功能异常[9]。来自人类的数据显示[5,10-11],AF 成功射频消融后窦房结功能显著改善[6],部分快-慢综合征射频消融治疗后可免于人工心脏起搏器安装。房颤以及持续、快速心房频率对窦房结及房室结功能的影响程度如何值得探讨。然而目前尚缺乏高频起搏诱发房颤发生并影响窦房结和房室结功能的相关电生理研究。
材料和方法
1 动物
健康比格犬15只,分成起搏组(P组,n=9)和对照组(N组,n=6),月龄10~15个月,体重12~16 kg。2组雌雄比例、体重等均无显著差异。犬只购于高要市康达动物科技有限公司,饲养于中山大学医学部动物实验中心,所有动物均按照美国国立卫生研究院制定的实验动物护理及使用指南给予人性化管理,所有研究过程均通过中山大学医学部动物实验管理委员会准入批准。
2 动物模型制备
采用戊巴比妥钠(30 mg/kg)腹腔麻醉后,耳缘静脉滴入青霉素1.6×106U。以后根据动物的反应(呼吸、睑膜反射等)每15~40 min静脉追加戊巴比妥钠60~90 mg。气管插管接呼吸机,通气量4.2 L/min,潮气量 0.3 L/min,频率 16 min-1。四肢连接心电图机,手术过程心电监测。实验犬取右侧卧位,胸部、颈部皮肤备皮消毒。选择左胸第5肋间,作长约5 cm横向切口,逐层分离皮肤、皮下组织、肌肉、肋间外肌、肋间内肌、胸膜壁层、胸膜脏层、打开心包,制作心包吊床暴露左心耳,将起搏导线缝合于左心耳根部心外膜处,用调搏仪调定到能满意起搏后,固定心外膜起搏导线。检查心包、胸腔没有出血,逐层关闭到胸壁,胸腔抽气后再缝合皮下组织、皮肤。在颈部做一4 cm×3 cm囊袋,将实验用埋藏式高频率心脏起搏器(中科院提供,起搏方式 AOO,起搏频率400 min-1)植入囊袋。将心脏起搏电极尾端经皮下隧道与埋藏式高频心脏起搏器相连。假手术对照组采用相同方法缝合起搏电极,而电极不与脉冲发生器相连。术后给予庆大霉素3 d,尔后予以连续起搏4周,起搏模式AOO(固定频率心房起搏),脉冲频率400 min-1。心电图检测实验犬为2∶1下传,心室率200 min-1。
3 体表心电图
术前及术后第1、7、14、21、28 d 分别描记 1 次心电图,心电图胸前导联可置于家兔背部,远离起搏器并尽量与脉冲发生方向垂直,以避免起搏信号的干扰。心电图记录对照组和房颤组起搏前后的起搏状态,并用磁铁控制起搏器脉冲的发放,观察有无自发性房颤的形成。测量Ⅱ导联的3个心动周期P波时限,取均值作为反映房内传导时间的指标。
4 电生理检查
所有比格犬均在植入起搏器前及起搏4周后行电生理检查,使用DF-5A型心脏电生理程控刺激仪(苏州东方电子仪器厂)测量房室结不应期(atrioventricular node effective refractory period,AVERP)、心房有效不应期(atrial effective refractory period,AERP)、窦房结恢复时间(sinus node recovery time,SNRT)和校正的窦房结恢复时间(corrected SNRT,cSNRT)。AERP分别以3个基本周期(S1=350、300和250 ms)在窦性心律下进行测量,S2从200 ms开始以10 ms递减反向扫描刺激法,8个S1刺激后引入1个S2刺激,刺激延迟1 s。AERP被定义为不能引起心房激动的最长S1S2间期。AVERP被定义为不能引起心室激动的最长S1S2间期。电刺激输出设为舒张期阈值的2倍。重复相同的S1S2刺激各3次。若起搏犬发生阵发性AF,则待其恢复窦性心律时测量。测定过程发生AF则终止AF后再测定。AF终止利用心脏电生理刺激仪给予早搏刺激或超速起搏抑制方法复律,也可用钳夹心房等方法予以复律。
SAN功能测定[9]:通过左心房电极给予快速递增的起搏周期(200、250、300和350 ms)刺激心房测量SNRT和cSNRT来评估。SNRT测定采用程序刺激的 S1S1,基本周期(S1=350、300、250 和200 ms),输出脉宽2 ms,刺激强度为2倍舒张期阈值。起搏刺激持续2 min然后短暂停顿并与下一次起搏间隔2 min。SNRT定义为最后的心房起搏波到自发的窦性搏动的时间。cSNRT测定定义为SNRT减去平均窦性周期长度。AVN功能通过测量以下参数评估:(1)出现文氏房室传导阻滞的起搏周期长度(以10 ms步长递增的起搏);(2)S1S2刺激后不能引起心室激动的最长S1S2间期。
5 心房颤动的诱发和持续时间
以停止起搏器输出后自发出现AF超过5 s,定义为自发性AF。若未出现自发性AF,给予程序刺激(S1S2)或Burst刺激诱发AF。Burst刺激使用基础刺激周长为100 ms,刺激强度为2倍舒张期阈值的猝发刺激,连续刺激30 s,重复3次。程序刺激诱发大于15 min的不规则心房重复反应定义为持续性AF,AF持续时间<15 min并且能够自行终止者为非持续性或阵发性AF[12]。通过程序刺激或Burst刺激成功诱发持续性AF的犬数量与该实验组完成的实验犬程序刺激或Burst刺激次数的比值定义为持续性AF的诱发率。
6 心脏超声检查
起搏前、起搏2周和起搏4周,超声评价左右心房直径和左心室收缩功能。实验犬予30 mg/kg戊巴比妥钠腹腔麻醉后,用Vivid 7 Dimension彩色多普勒超声诊断仪(美国通用电气公司)7S探头测量以下指标:主动脉内径(aorta dimension,AO)、左房前后径(left atrial anteroposterior diameter,LAap)、左房上下径(left atrium superoinferior diameter,LAsi)、左房左右径(left atrial left-right diameter,LAlr)、右房上下径(right atrium superoinferior diameter,RAsi)、右房左右径(right atrial left-right diameter,RAlr)、左室舒张末内径(left ventricular end-diastolic diameter,LVEDD)、右室舒张末内径(right ventricular end-diastolic diameter,RVEDD)、肺动脉内径(pulmonary artery diameter,PAD)和射血分数(ejection fraction,EF)。
7 统计学处理
采用SPSS 19.0统计软件进行分析。数据以均数±标准差(mean±SD)表示,两组间的均数比较用t检验,实验组内前后比较采用配对t检验。率的比较采用卡方检验。以P<0.05为差异有统计学意义。
结 果
1 起搏后心电生理的改变
1.1 对心房传导的影响 P组和N组在起搏4周后P波时限分别为(42.00±4.24)ms和(38.50±3.21)ms,PA间期分别为(116.66±20.00)ms和(101.66±16.02)ms,组间比较均无显著差异(P>0.05),见表1。

表1 P波时限和PA间期的改变Table 1.The changes of P-wave duration and PA interval(ms.Mean±SD)
1.2 起搏刺激对AERP的影响 起搏4周后在基本起搏周期(250 ms、300 ms和350 ms)时的AERP分别为(134.46±21.30)ms(P<0.05 vs group N)、(126.66±10.00)ms(P<0.01 vs group N)和(132.44±21.54)ms(P<0.05 vs group N)。P组在起搏4周后AERP在不同起搏周期较N组均有缩短,见图1。
1.3 起搏刺激对SNRT和cSNRT的影响 P组4周后在 S1S1 250 min-1、300 min-1和 350 min-1时SNRT均有延长,分别是(495.56±103.33)ms、(476.66±60.00)ms和(451.11±41.37)ms;在S1S1 350 min-1时SNRT延长更明显,与对照组比较有显著差异(P<0.05),与起搏前比较有显著差异(P <0.01)。4周后 CSNRT在 S1S1 200 min-1、250 min-1、300 min-1和 350 min-1均有延长,分别是(116.67 ±12.24)ms、(117.78 ±12.28)ms、(114.33±9.63)ms和(115.44±8.24)ms,但是 S1S1 350 min-1时更明显,与对照组以及起搏前比较均有显著差异(P<0.01),见图2。
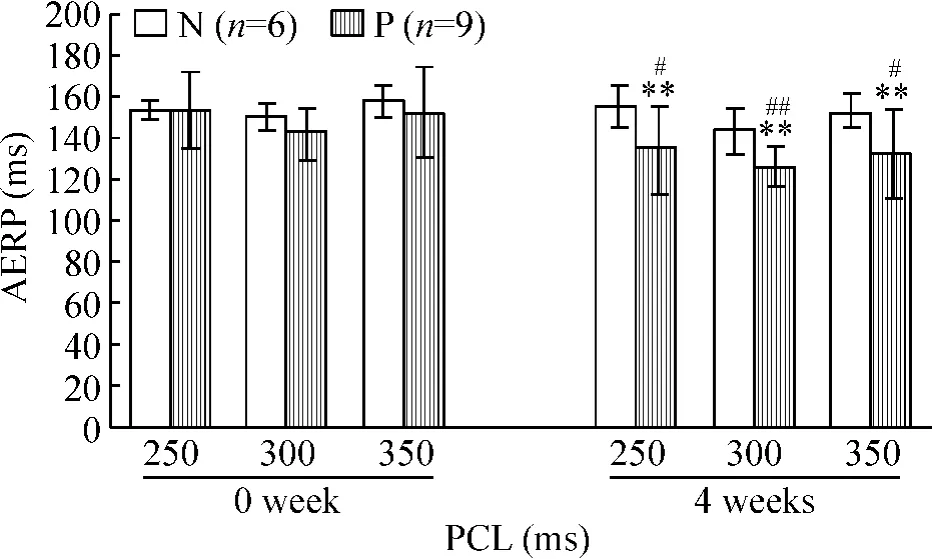
Figure 1.The changes of atrial effective refractory period(AERP)at different pacing cycle lengths(PCL).Mean± SD.**P < 0.01 vs before pacing(0 week);#P <0.05,##P<0.01 vs group N.图1 不同起搏周期下心房有效不应期的改变
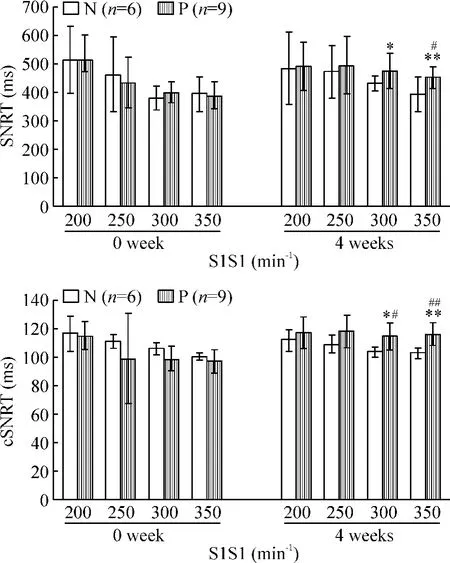
Figure 2.The changes of sinoatrial node recovery time(SNRT)and corrected sinus node recovery time(cSNRT).*P <0.05,**P <0.01 vs before pacing(0 week);#P<0.05,##P<0.01 vs group N.图2 不同起搏周期下窦房结恢复时间和校正恢复时间的改变
1.4 起搏对房室结文氏点和AVERP的影响 与对照组比较,P组4周后房室结文氏点延长[由(328.33 ±24.01)min-1至(294.44 ±26.03)min-1,P<0.01);4周后在起博周期250 ms、300 ms和350 ms时对照组 AVERP分别为(166.66±5.16)ms、(156.66±8.16)ms和(160.00±0.00)ms,起搏组分别为(181.11±6.01)ms、(171.11±7.82)ms和(167.78±4.41)ms,与对照组比较均表现为延长,有显著差异(P<0.01),见表2和图3。

表2 房室结文氏点的改变Table 2.The changes of atrioventricular nodal Wenckebach point(min-1.Mean ± SD)
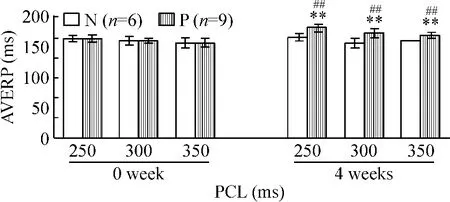
Figure 3.The changes of atrioventricular node effective refractory period(AVERP)at different PCL.Meam ±SD.**P <0.01 vs before pacing(0 week);##P <0.01 vs group N.图3 起搏前后不同起搏周长房室结不应期的改变
1.5 S1S2和Burst刺激对房颤诱发情况的影响 4周后起搏组9只犬给予不同周期S1S2刺激36例次,共诱发11例次阵发性AF,对照组6只犬给予S1S2刺激24例次,共诱发1例次阵发性AF,2组比较有统计学差异(P<0.05);起搏组Burst刺激27例次,共诱发15例次阵发性AF,12例次持续性AF,对照组Burst刺激18例次,共诱发6例次阵发性AF,0例次持续性AF。起搏组4周后S1S2刺激诱发的阵发性AF和Burst刺激诱发的持续性AF与对照组比较均有显著差异(P<0.05,P<0.01);起搏组第2周2只犬发生自发性AF,4周后持续性AF的发生率高,总的AF诱发率达100%,见表3。
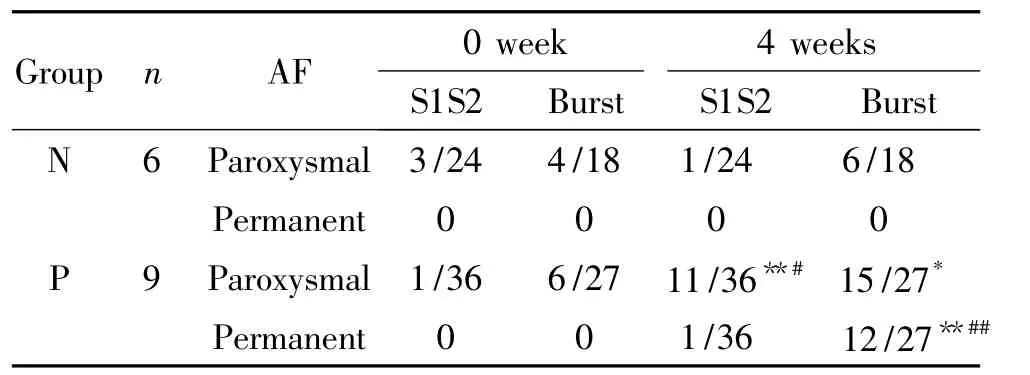
表3 起搏后房颤的诱发情况Table 3.Incidence rates of atrial fibrillation after pacing
1.6 起搏心电图和房颤心电图 Burst 600 min-1诱发的比格犬呈持续性AF心电图(走纸速度50 mm/s),P波消失,代之以f波,RR间期绝对不等,心室率500 min-1,见图4:高频起搏时的心电图见图5,起搏频率 400 min-1,2∶1 下传,心室率 200 min-1。
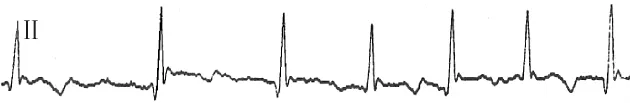
Figure 4.Cardiogram of permanent AF at Burst 600 min-1(50 mm/s).图4 Burst 600 min-1条件下诱发的持续性心电图
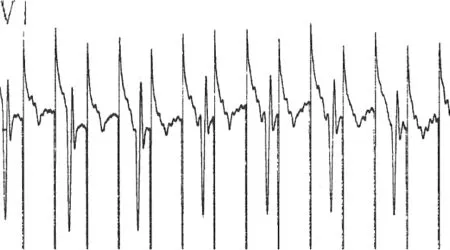
Figure 5.Cardiogram of high-rate pacing of atrium(50 mm/s).图5 心房起搏心电图
2 起搏后心脏超声的改变
P组2周后心脏超声显示左心房前后和上下、左右径都有明显增大,分别为(24.56±3.68)mm(P<0.05)、(27.33±2.87)mm(P<0.01)和(28.22±3.90)mm(P<0.05),右心房上下径增大(23.44±1.67)mm(P<0.05),见图6。2组左心室大小没有统计学意义的改变(数据未提供)。
讨 论
AF电学机制与解剖机制一直是研究的热门课题[12-13]。稳定的实验动物模型是深入研究AF电生理基础。本研究通过犬开胸手术置左心房心外膜电极,以400 min-1电脉冲持续起搏左房4周,建立稳定的AF模型,本研究的主要发现有:(1)4周后起搏组阵发性AF和持续性AF的诱发率与对照组比较均有统计学差异(分别P<0.05,P<0.01),第4周AF诱发率达100%。(2)起搏组4周后ERPA在不同基本起搏周期(250 ms、300 ms和350 ms)时均较对照组缩短(P<0.05);房室结文氏点较对照组显著延长(P<0.05);起搏组2周后心脏超声显示左心房各径线明显增大(P<0.01),右心房上下径增大(P<0.05)。(3)起搏4周后SNRT和cSNRT均延长(P<0.01)。
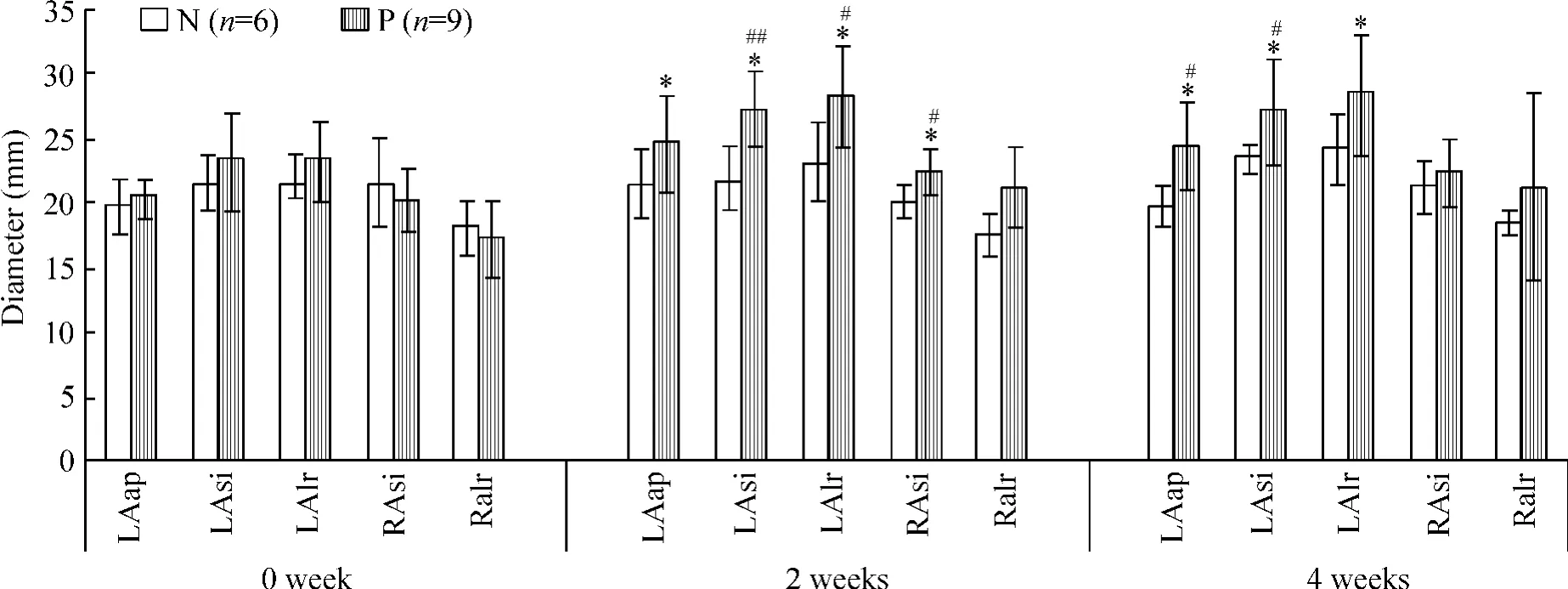
Figure 6.The changes of the echocardiography of atrium.LAap:left atrial anteroposterior diameter;LAsi:left atrium superoinferior diameter;LAlr:left atrial left-right diameter;RAsi:right atrium superoinferior diameter;RAlr:right atrial left-right diameter.Mean±SD.*P<0.05 vs before pacing(0 week);#P<0.05,##P<0.01 vs group N.图6 起搏后心房的超声改变
业已证明,AERP缩短是AF发生与维持的主要电生理基础之一,本研究经高频心房起搏4周后出现的AERP缩短与AF的基本电生理异常相吻合,提示高频持续电起搏所引起的心房电重塑主要表现为AERP缩短,倾向于AF的发生。基础研究证明,超快延迟整流钾电流(IKur)的激活使得AERP缩短,有助AF的发生,目前,IKur阻断剂治疗AF正在进行3期临床研究中[14]。至于高频持续刺激引起的这种电重塑后的电学上的变化在AF发生中所占比重有多大仍属未知,因为我们的研究还发现起搏一段时间后显示左心房各径线的增大和右心房上下径的增大这一事实,这是解剖重塑的结果。临床上,心房的扩大是AF发生、发展、维持的独立危险因素。在快速心率的介导下,到底心房肌的ERP缩短与心房的扩大孰先孰后、孰轻孰重仍是未来研究的课题。
生理状况下AVN具有递减性传导的特性,是AVN频率滤过作用的电生理基础,病理情况下也是AVN传导功能降低的重要指标之一。人类AF发作时心房率高达300~600 min-1,如果所有心房激动都下传至心室会导致室颤乃至猝死。由于有AVN递减传导功能,多数的心房激动被AVN阻滞从而限制了过快心室率的发生。临床上,AVN是控制AF心室率的靶点,包括药物治疗和射频消融[15]。这些室率控制方法的目的是使更多的心房冲动被AVN阻滞,确保心室率减慢[15]。Zhang 等[8]报道了长期AF后AVN电重塑并出现心室率自发降低这一现象。我们的研究结果提示持续快速心房起搏引起了AVN电重塑,表现为AVN文氏点不应期和房室结有效不应期延长。有证据表明持续快速心房刺激后AVN周围纤维化和脂肪浸润增加。研究[16]证实G蛋白偶联的受体在调节心脏的自动节律性方面起重要作用,自主神经系统通过G蛋白偶联的受体对心脏的自动节律调节有强大的作用,这些受体包括β肾上腺素能受体和毒蕈碱受体,而这些受体都位于特殊的心脏传导系统如SAN和AVN。快速心房起搏是否通过G蛋白偶联的受体介导SAN和AVN的重塑有待进一步研究。
实践中,常常可观察到快速型AF终止后出现的缓慢窦性心律或交界性逸搏心律甚至出现晕厥症状,临床上称“心动过速-心动过缓综合征”,经AF射频消融后缓慢心律失常不再发生。研究证明AF是导致心动过速-心动过缓综合症患者SAN功能障碍的原因之一[17]。然而具体机制尚不清楚。本研究犬起搏4周后SNRT和cSNRT均较对照组延长(P<0.01)。既往的动物实验和临床实验数据均证实持续的AF将导致SAN重塑[18-20],表现为窦房结恢复时间延长。Elvan等[19]在慢性起搏诱导的狗AF模型中,最初认识到房性心律失常可能会导致SAN功能障碍。Hadian等[20]证实短时间的快速心房起搏(10~15 min)也可导致SAN重塑。狗持续的快速心房起搏(>2 weeks)和慢性AF出现SAN功能紊乱,表现为窦房结恢复时间延长和固有心率降低[19]。AF患者给予射频消融后SAN功能可以得到改善,提示心动过速诱导 SAN重塑[21]。快速起搏导致的SAN、AVN功能异常在给予神经节消融后功能恢复[9]。虽然导致SAN功能不全及室上性心律失常之间关联的机制尚未完全阐明,有研究发现AF患者SAN病变的进展与心动过缓时不应期异质性有关[22]。可能与SAN、AVN周围组织传导阻滞有关,阵发性AF可能抑制SAN功能造成长期窦性暂停。因此临床上应认识到此现象是部分可逆的,通过AF消融治疗可以避免心脏起搏器植入术[21]。
深入研究发现AF终止后SAN和AVN电生理特性可逐渐恢复至正常,但心房的收缩功能却没有恢复,提示在AF中,除了电重塑外,心房发生了结构重塑[23-25],表现为肌溶解、心肌死亡、心房纤维化和心房的扩大。目前已经证实AF与左心房扩大相关,左心房的扩大可能是AF持续的结果,同时左心房扩大导致或者部分导致AF发生或者维持。因为心房扩大可能增加AF时心房对药物或者电转复的不应性,以及血栓形成的风险。心房间质纤维化是心房的结构重构的一个共同特点。早期的干预心房扩大即使对于无症状AF都被认为是有价值的治疗策略。
[1] Benjamin EJ,Wolf PA,D'Agostino RB,et al.Impact of atrial fibrillation on the risk of death:the Framingham Heart Study[J].Circulation,1998,98(10):946-952.
[2] Wijffels MC,Kirchhof CJ,Dorland R,et al.Atrial fibrillation begets atrial fibrillation:a study in awake chronically instrumented goats[J].Circulation,1995,92(7):1954-1968.
[3] Verheule S,Sato T,Everett T 4th,et al.Increased vulnerability to atrial fibrillation in transgenic mice with selective atrial fibrosis caused by overexpression of TGF-β[J].Circ Res,2004,94(11):1458-1465.
[4] Allessie M,Ausma J,Schotten U.Electrical,contractile and structural remodeling during atrial fibrillation[J].Cardiovasc Res,2002,54(2):230-246.
[5] Gomes JA,Kang PS,Matheson M,et al.Coexistence of sick sinus rhythm and atrial flutter-fibrillation[J].Circulation,1981,63(1):80-86.
[6] Hocini M,Sanders P,Deisenhofer I,et al.Reverse remodeling of sinus node function after catheter ablation of atrial fibrillation in patients with prolonged sinus pauses[J].Circulation,2003,108(10):1172-1175.
[7] Zhang Y,Yamada H,Bibevski S,et al.Chronic atrioventricular nodal vagal stimulation:first evidence for longterm ventricular rate control in canine atrial fibrillation model[J].Circulation,2005,112(19):2904-2911.
[8] Zhang Y,Mazgalev TN.Atrioventricular node functional remodeling induced byatrialfibrillation[J].Heart Rhythm,2012,9(9):1419-1425.
[9] Cui B,Lu Z,He B,et al.Acute effects of ganglionated plexi ablation on sinoatrial nodal and atrioventricular nodal functions[J].Auton Neurosci,2011,161(1-2):87-94.
[10] Sparks PB,Jayaprakash S,Vohra JK,et al.Electrical remodeling of the atria associated with paroxysmal and chronic atrial flutter[J].Circulation,2000,102(15):1807-1813.
[11] van den Berg MP,van Gelder IC.Atrial fibrillation and sinus node dysfunction[J].J Am Coll Cardiol,2001,38(5):1585.
[12] Allessie M,Kirchhof C,Scheffer GJ,et al.Regional control of atrial fibrillation by rapid pacing in conscious dogs[J].Circulation,1991,84(4):1689-1697.
[13]段卡丹,李裕舒,史晓婧.房颤患者血清对心肌成纤维细胞趋化运动的影响[J].中国病理生理杂志,2011,27(4):662-665.
[14] Ehrlich JR,Nattel S.Novel approaches for pharmacological management of atrial fibrillation[J].Drugs,2009,69(7):757-774.
[15] Zhang Y,Mazgalev TN.Ventricular rate control during atrial fibrillation and AV node modifications:past,present,and future[J].Pacing Clin Electrophysiol,2004,27(3):382-393.
[16] Fu Y,Huang X,Piao L,et al.Endogenous RGS proteins modulate SA and AV nodal functions in isolated heart:implications for sick sinus syndrome and AV block[J].Am J Physiol Heart Circ Physiol,2007,292(5):H2532-H2539.
[17] Fuster V,Ryden LE,Cannom DS,et al.2011 ACCF/AHA/HRS focused updates incorporated into the ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation:a report of the American College of Cardiology Foundation/American Heart Association Task orce on practice guidelines[J].Circulation,2011,123(10):e269-e367.
[18] Page RL,Tang AS,Prystowsky EN.Effect of continuous enhanced vagal tone on atrioventricular nodal and sinoatrial nodal function in humans[J].Circ Res,1991,68(6):1614-1620.
[19]Elvan A,Wylie K,Zipes DP.Pacing-induced chronic atrial fibrillation impairs sinus node function in dogs:electrophysiological remodeling[J].Circulation,1996,94(11):2953-2960.
[20] Hadian D,Zipes DP,Olgin JE,et al.Short-term rapid atrial pacing produces electrical remodeling of sinus nodefunction in humans[J].J Cardiovasc Electrophysiol,2002,13(6):584-586.
[21] Hocini M,Sanders P,Deisenhofer I,et al.Reverse remodeling of sinus node function after catheter ablation of atrial fibrillation in patients with prolonged sinus pauses[J].Circulation,2003,108(10):1172-1175.
[22]Luck JC,Engel TR.Dispersion of atrial refractoriness in patients with sinus node dysfunction[J].Circulation,1979,60(2):404-412.
[23] Sanfilippo AJ,Abascal VM,Sheehan M,et al.Atrial enlargement as a consequence of atrial fibrillation:a prospective echocardiographic study[J].Circulation,1990,82(3):792-797.
[24] Aime-Sempe C,Folliguet T,Rucker-Martin C,et al.Myocardial cell death in fibrillating and dilated human right atria[J].J Am Coll Cardiol,1999,34(5):1577-1586.
[25]Kumagai K,Nakashima H,Urata H,et al.Effects of angiotensin II type 1 receptor antagonist on electrical and structural remodeling in atrial fibrillation[J].J Am Coll Cardiol,2003,41(12):2197-2204.
