功能化氧化石墨烯作为基因和抗肿瘤药物纳米载体的制备及性能研究
2013-11-04曹秀芬冯福立杨晓英
曹秀芬,冯福立,杨晓英,周 晶
(天津医科大学药学院,天津市临床药物治疗和诊断重点实验室,天津 300070)
目前肝脏肿瘤的药物治疗仍不理想,其主要原因之一就是药物对肝脏的选择性低,如果将抗癌活性药物与运载药物的特殊载体相联而制成前药,使该药到达特定的肝脏病灶,则可以显著提高抗癌疗效[1]。基于纳米材料的药物载体由于具有高效的药物负载量、靶向运输和控制释放等优点,在生物医学领域有广泛的应用前景[2-3]。石墨烯(graphene)是碳原子紧密堆积成单层二维蜂窝状晶格结构的一种碳质新材料,氧化石墨烯(GO)为单层的氧化石墨,平面上含有羧基、羟基、环氧基等,表面丰富的官能团赋予其新的特性,如分散性、亲水性、与聚合物的兼容性等[4-5]。研究发现,通过π-π 共轭、静电作用等非共价键作用能有效地将化学药物、DNA、RNA 等固定在氧化石墨烯上[6-7]。本试验采用具有良好生物相容性的乳糖酸和天然多糖-壳聚糖作为修饰GO 的材料,从协同用药的层面出发,制备出可同时运载基因药物和抗肿瘤药物DOX 的纳米载体。另外,乳糖酰化壳聚糖可以模拟去唾液酸糖蛋白,具有肝靶向性[8],这种设计使得载体能够肝靶向的运输基因和抗肿瘤药物,提高疗效的同时也降低药物对人体正常器官、组织的毒副作用。
1 材料和方法
1.1 试剂与仪器 GO(南开大学高分子研究所提供),壳聚糖(青岛海普生物技术有限公司,脱乙酰度80%),乳糖酸(上海晶纯试剂有限公司),EDC[1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,Aldrich],NHS(N-羟基琥珀酰亚胺,上海晶纯试剂有限公司),三乙胺(天津市化学试剂批发公司),2,3-环氧丙基三甲基氯化铵(Adamas),DOX(上海浩然生物技术有限公司),改良型RPMI-1640 培养基(赛默飞世尔生物化学制品北京有限公司),WST-1 细胞增殖及细胞毒性检测试剂盒(碧云天生物科技有限公司),FAM-DNA 序列为5′-TGC-ATT-TTTAAT-GGT-ATT-TA-3′-FAM(上海生工生物科技有限公司)。傅立叶红外光谱仪(Bruker,Tensor 27),紫外光谱仪(JASCO,V-570),酶标仪(Promega,Glo-Max誖-Multi),离心机(Eppendorf,centrifuge 5810R),电位及纳米粒度分析仪(美国贝克曼库尔特有限公司,Delsa Nano C),琼脂糖凝胶电泳仪(BIO-RAD,PowerPac Basic),紫外成像仪(BioRad),激光共聚焦荧光显微镜(Olympus,FV1000)。
1.2 GO-LCO+的制备 称取乳糖酸267 mg,溶于10 mL 蒸馏水中,加入NHS、EDC 各50 mmol/L,电磁搅拌活化40 min。称1 g 纯化壳聚糖,加入活化的乳糖酸中,超声溶解,三乙胺调PH 至8~9,电磁搅拌40℃反应48 h。过葡聚糖凝胶柱纯化乳糖酰化壳聚糖(LCO),冷冻干燥。取3 mg GO,加入NHS、EDC 50 mmol/L,超声溶解后电磁搅拌,活化40 min,向已活化的GO 中加入80 mg 的LCO,溶解后用三乙胺调节pH 至8~9,40℃电磁搅拌反应48 h。纯化处理后加入400 mg 过量的2,3-环氧丙基三甲基氯化铵,超声溶解后,80℃油浴,搅拌反应24 h,12 000 r/min离心洗涤数次后定容至1 mg/mL。
1.3 GO-LCO+的表征 GO-LCO+的结构和形态采用傅立叶红外光谱仪(FT-IR)、电位及纳米粒度分析仪、原子力显微镜(AFM)检测和观察。采用溴化钾压片法测定壳聚糖(CO)、乳糖酰化壳聚糖(LCO)、GO-LCO+的红外光谱图。将载体分散在水溶液中,滴于云母片上,在涂膜机上旋涂均匀后烘干,AFM 观察修饰前后的形态特征。用电位及纳米粒度分析仪检测载体所带电荷情况。
1.4 GO-LCO+对抗肿瘤药物DOX 负载量的研究 取1 mg/mL 的载体溶液6 mL,加入669μg/mL的DOX 溶液12 mL,避光搅拌24 h。12 000 r/min 离心1 h,取上层清液,测定吸光度,利用事先绘制的药物浓度-吸光度标准曲线计算出离心清液中药物的浓度。根据公式(1)计算载药量。

W为负载量,C0为初始加入的DOX 的浓度,V0为初始加入的DOX 的体积,C1为载药后经离心所得的上清液中DOX 的浓度,V1为载药后经离心所得的上清液的体积,m为载体的质量。
1.5 电泳试验及细胞摄取试验 2μL FAM-DNA(10μmol/L)分别与0、1、2、3、4、5、6、8、10、12、14μL GO-LCO+(0.5 mg/mL)混合,室温孵育1 h 后琼脂糖凝胶电泳,紫外成像仪上观察。25μL GO-LCO+(1 mg/mL)与4μL FAM-DNA(20μmol/L)混合,室温孵育1 h 后,加入1640 基本培养基至500μL,转染QGY-7703 细胞30 min,另外,4μL FAM-DNA(20μmol/L)相同条件下转染,作为对照试验。最后用4%多聚甲醛固定,水溶性封片剂封片,在激光共聚焦荧光显微镜下观察。
1.6 细胞毒性试验 QGY-7703 细胞培养于含体积分数10%灭活的小牛血清、1%青/链霉素的RPMI 1640 培养液中,在37℃,含体积分数5%CO2的培养箱中培养,长满后用0.25%的胰酶消化,以1:3 传代。按每孔约5×103个细胞接种于96 孔细胞培养板中,每孔终体积为200μL,培养箱中培养1 d 后,按浓 度 分别为0.1、1、10、100、500μg/mL 加 入 载 体GO-LCO+,每个浓度设置3个复孔。培养48 h 后,弃去孔内的培养基,并向孔板内加入WST 10μL 和1640 基本培养基100μL,培养箱中孵育2 h 后,用酶标仪测定450 nm 波长处每孔的吸光值,以未加载体的孔作为对照孔,以空白孔作为调零孔,按公式(2)计算上述培养基中的细胞存活率。

W为细胞存活率,A为试验孔吸光值,A0为空白孔吸光值,A1为对照孔吸光值。
2 结果
2.1 GO-LCO+的表征
2.1.1 GO-LCO+的红外光谱鉴定 CO 的IR 特征峰,如图1 所示,1 648 cm-1(C=O 伸缩振动峰,酰胺Ⅰ带),1 549 cm-1(酰胺Ⅱ带),与CO 相比LCO 的特征IR 谱峰,1 639 cm-1(酰胺Ⅰ带)和1 561 cm-1(酰胺Ⅱ带)处的峰强明显增加,说明乳糖酸分子中的羧基与壳聚糖分子中的氨基以酰胺键偶联。
GO 的特征IR 谱峰,1 730 cm-1(羧基上的C=O的伸缩振动峰),1 620 cm-1(C=C 的伸缩振动峰),与GO 相比,GO-LCO+的特征IR 谱峰,出现了2 925 cm-1和2 855 cm-1(C-H 伸缩振动峰),1 639 cm-1(C=O 伸缩振动峰),而1 730 cm-1处-COOH 的吸收峰消失,说明LCO 与GO 以酰胺键的形式成功连接。

2.1.2 GO-LCO+的形态特征 由图2 可见,GO 和GO-LCO+大小分布均匀,具有良好的纳米形态。GO大小在200 nm 左右,厚度约为1 nm,表明GO为单层形态。修饰之后GO-LCO+大小有所增大,厚度达到10 nm,进一步证明LCO 被成功连接到GO 上。
2.1.3 Zeta 电位 GO 的Zeta 电位为-33.61 mV,没有季铵化的乳糖酰化壳聚糖修饰的GO(GO-LCO)的Zeta 电位为-11.24 mV,季铵化后的乳糖酰化壳聚糖修饰的GO(GO-LCO+)的Zeta 电位为+21.40 mV。说明2,3-环氧丙基三甲基氯化铵被成功连接上,季铵化可以显著提高载体在水溶液中的稳定性,并且使其带上正电荷,可以和DNA、RNA 以静电作用连接。
2.2 载药性能分析 DOX 在233 nm 处有很强的紫外吸收峰,将DOX 溶液稀释成特定浓度,测定其在233 nm 处的吸光度,得到DOX 的浓度-吸光度标准曲线y=0.006 51+0.057 33x。载药24 h 后离心,测定上清的吸光度,由测得的浓度-吸光度标准曲线计算出上清液中DOX 的浓度为287μg/mL,根据公式(1)计算出DOX 的负载量为477μg/mg。
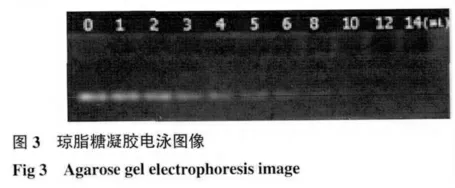
2.3 电泳试验的结果分析 GO-LCO+带正电荷,而FAM-DNA 带负电荷,可以通过静电吸附。负载到GO-LCO+上的FAM-DNA 被阻滞在琼脂糖凝胶孔内,而未被负载的FAM-DNA 在电场的作用下迁移。如图3 所示,不同量的GO-LCO+与相同量的FAM-DNA 分别混合,随着载体量的增加,FAMDNA 的亮度减弱,10μL 处FAM-DNA 的亮度消失,说明此处FAM-DNA 全部负载到GO-LCO+上,负载量为4μmol/g。

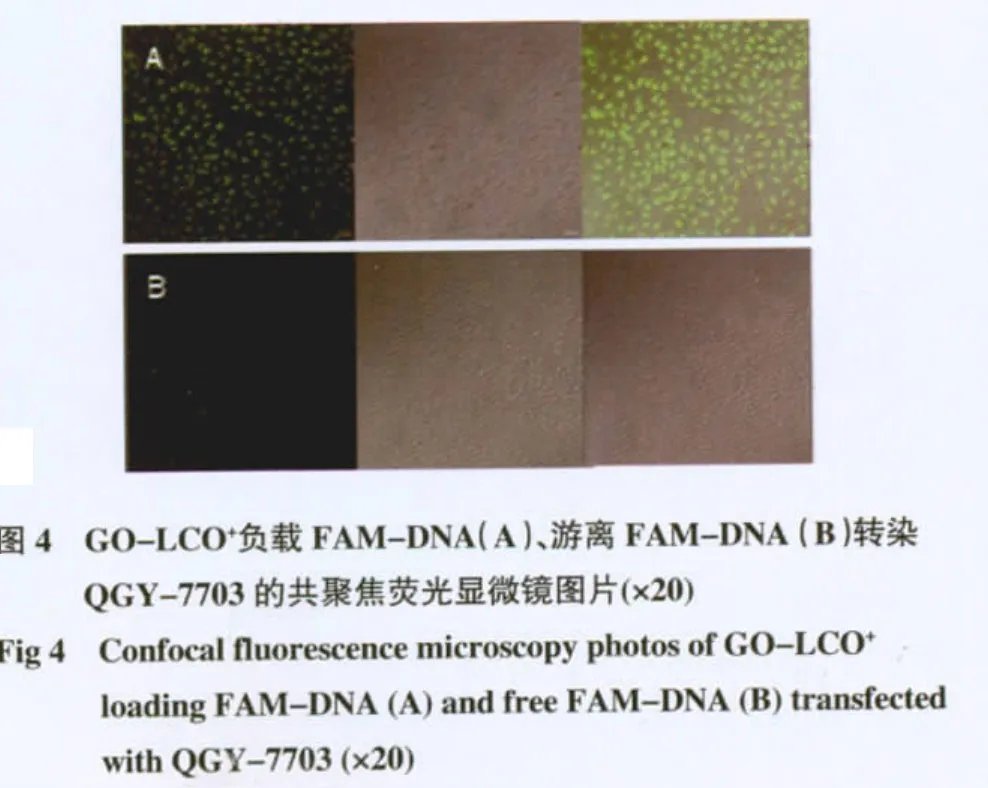
2.4 细胞摄取试验结果分析 FAM-DNA 上连接荧光素,可以在激光共聚焦荧光显微镜下观察。结果表明GO-LCO+可以运载FAM-DNA 快速到达QGY-7703 细胞中,显示较强的荧光强度,而相同条件下,没有载体携载的FAM-DNA 则很难进入细胞,见图4。
2.5 细胞毒性试验结果分析 WST-1 细胞增殖及细胞毒性检测试剂盒是一种广泛应用于细胞增殖和细胞毒性的快速高灵敏度检测试剂盒,在电子耦合试剂存在的情况下,可以被线粒体内的一些脱氢酶还原生成橙黄色的有色甲。细胞增殖越多越快,则颜色越深,细胞毒性越大,则颜色越浅。如图5 所示,载体浓度到达100μg/mL 时,对细胞QGY-7703基本没有毒性,当载体浓度到达500μg/mL 后,出现了明显毒性,但是使用GO-LCO+作为载体的浓度远低于100μg/mL。这表明GO-LCO+的毒性很低,在使用浓度范围内对细胞基本没有毒性。

3 讨论
近年来,碳纳米材料一直是科技创新的前沿研究领域,1985年发现的富勒烯和1991年发现的碳纳米管,掀起了碳材料的研究热潮。2004年英国Manchester 大学Geim 领导的研究组[9]首次采用机械剥离法获得了单层的新型二维碳原子晶体—石墨烯,因其独特的结构和优异的电学[10]、热学[11]、力学[12]、光学性能[13]以及在纳米技术中的潜在应用性而倍受关注。石墨烯是由碳原子以sp2 杂化连接的单原子层构成的,其基本结构单元为有机材料中最稳定的苯六元环,其厚度仅为0.35 nm,是目前发现的最薄的二维材料[14]。石墨烯已成为备受关注的研究热点,而其在生物医药领域的研究还处于探索阶段。
虽然石墨烯是由稳定的六元环构成,但是其边沿以及缺陷部位具有较高的反应活性,可以通过化学氧化的方法制备氧化石墨烯。氧化石墨烯含有大量的羧基、羟基和环氧键等活性基团,可以利用这些基团与其它分子之间的化学反应对石墨烯进行功能化修饰。Dai 等[15]首先制备了具有生物相容性的聚乙二醇功能化的石墨烯,通过碳二亚胺催化将聚乙二醇的氨基连接到氧化石墨烯的羧基上,使这种功能化的石墨烯具有了良好的水溶性,并且能够在血浆、细胞培养液等生理环境下保持稳定的分散,作为抗肿瘤药物喜树碱衍生物SN38 的载体,开启了石墨烯在生物医药领域的应用研究。Zhang 等[16]采用阳离子聚合物聚乙烯亚胺修饰GO,负载siRNA 和DOX,实验结果证明这种输送体系可以显著增强抗肿瘤疗效,而目前基于石墨烯的肝靶向抗肿瘤药物载体的研究报道很少。
盐酸阿霉素(DOX)是广谱的抗肿瘤药物,临床上主要用于治疗乳腺癌、甲状腺癌、肝癌、卵巢癌、肉瘤等实体瘤。DOX 易溶于水,既具有脂溶性蒽环配基和水溶性柔红糖胺,又有酸性的酚羟基和碱性氨基,易通过细胞膜进入肿瘤细胞,具有很强的药理活性。而氧化石墨烯两面均具有芳香结构,可以通过π-π 共轭、氢键和疏水效应等非共价键和抗肿瘤药DOX 的蒽环作用,负载于GO-LCO+表面,因此选择DOX 作为装载药物,来考察载体GO-LCO+在生物医药方面的应用。DNA、miRNA、siRNA 等基因药物都带正电荷,很难进入细胞发挥其疗效,因此开发出一种基因药物载体很重要[17]。Zeta 电位显示GO-LCO+带正电荷,可以通过静电吸附作用将基因药物负载于载体上。
本试验采用一种新颖的修饰方法,首先制备乳糖酰化壳聚糖,通过酰胺键连接壳聚糖的氨基和GO 的羧基,制备出乳糖酰化壳聚糖修饰的GO,最后利用2,3-环氧丙基三甲基氯化铵将其季铵化,从协同用药的层面出发,制备出既可以携带基因药物,又可以负载抗肿瘤药物的载体GO-LCO+,并对DOX 和FAM-DNA 的负载量进行了检测。通过激光共聚焦荧光显微镜观察显示,载体可以快速高效地运载FAM-DNA 到达肝癌细胞,通过WST-1 试验对载体的细胞毒性进行了检测,证明载体本身具有较低的细胞毒性。研究结果初步证明GO-LCO+可以用于基因和抗肿瘤药物运载输送的研究,为氧化石墨烯在生物医学领域的应用以及今后的研究奠定了基础。另外,乳糖酰化壳聚糖可以模拟去唾液酸糖蛋白,作为抗肿瘤药物的肝靶向载体,对于GOLCO+的肝肿瘤靶向性有待进一步研究。
[1]马淑艳.甘草有效成分的制备及甘草次酸类肝靶向抗癌前药的合成研究[D].乌鲁木齐:新疆医科大学,2008
[2]Burger K N,Staffhorst R W,de Vijlder H C,et al.Nanocapsules:lipid-coated aggregates of cisplatin with high cytotoxicity[J].Nat Med,2002,8(1):81
[3]Guo R,Li R,Li X,et al.Dual-functional alginic acid hybrid nanospheres for cell imaging and drug delivery[J].Small,2009,5(6):709
[4]Guo H L,Wang X F,Qian Q Y,et al.A green approach to the synthesis of graphene nanosheets[J].ACS Nano,2009,3(9):2653
[5]Li X L,Zhang G Y,Bai X D,et al.Highly conducting graphene sheets and langmuir-blodgett films[J].Nat Nanotech,2008,3(9):538
[6]Zhang L,Xia J,Zhao Q,et al.Functional graphene oxide as a nanocarrier for controlled loading and targeted delivery of mixed anticancer drugs[J].Small,2010,6(4):537
[7]Peng C,Hu W,Zhou Y,et al.Intracellular imaging with a graphene-based fluorescent probe[J].Small,2010,6(15):1686
[8]王银松,韩月莲,李英霞,等.甲氨蝶呤-乳糖酰基壳聚糖的制备及其体外实验[J].高等学校化学学报,2007,28(6):1092
[9]Geim A K,Novoselov K S.The rise of grapheme[J].Nat Mater,2007,6(3):183
[10]Novoselov K S,Jiang Z,Zhang Y,et al.Room-temperature quantum hall effect in graphene[J].Science,2007,315(5817):1379
[11]Balandin A A,Ghosh S,Bao W,et al.Superior thermal conductivity of single-layer grapheme[J].Nano Lett,2008,8(3):902
[12]Lee C,Wei X,Kysar J W,et al.Measurement of the elastic properties and intrinsic strength of monolayer grapheme[J].Science,2008,321(5887):385
[13]Mak K F,Sfeir M Y,Wu Y,et al.Measurement of the optical conductivity of grapheme[J].Phys Rev Lett,2008,101(19):196405
[14]Novoselov K S,Geim A K,Morozov S V,et al.Electric field effect in atomically thin carbon films[J].Science,2004,306(5696):666
[15]Sun X,Liu Z,Welsher K,et al.Nano-Graphene oxide for cellular imaging and drug delivery[J].Nano Res,2008,1(3):203
[16]Zhang L,Lu Z,Zhao Q,et al.Enhanced chemotherapy efficacy by sequential delivery of siRNA and anticancer drugs using PEIGrafted graphene oxide[J].Small,2011,7(4):460
[17]Yang X Y,Niu G L,Cao X F,et al.The preparation of functionalized graphene oxide for targeted intracellular delivery of siRNA[J].J Mater Chem,2012,22(13):6649
