散风解表颗粒剂质量控制方法研究
2013-11-04孙旺强王姿婧戴学文房志仲
孙旺强,王姿婧,戴学文,刘 青,房志仲
(1.天津医科大学研究生院,天津 300070;2.天津市安定医院药剂科,天津 300222;3.天津医科大学药学院药剂学教研室,天津市临床药物关键技术重点实验室,天津 300070)
散风解表颗粒剂是由金银花、赤芍、黄芩、板蓝根、生地、大青叶等多味中药材经提取加工制成的纯中药制剂,为天津医科大学药剂学教研室根据中医经典方剂结合临床应用组方。主治功能为解表散风、清热解毒之功效,主要用于流行性和病毒性感冒等临床症状的治疗。其主要功效为清热解表,疏散风热,多用于透疹、风热感冒、温病发热等症状的治疗。为了更好地控制质量,笔者对散风解表颗粒剂中的赤芍和金银花进行了定性研究,并采用HPLC 法对主要成分芍药苷和绿原酸进行了含量测定,为申报新药提供质量控制理论依据。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器 高效液相色谱仪(spectra-physics),输液泵(SP8810 precision isocratic pump),紫外检测器(Spectra 100 variable wavelength detector),Kromasil C18色谱柱(5μm,200 mm×4.6 mm),Anastar 色谱工作站,高精密度单相交流稳压电源(ZDY-Ⅱ-1 IKVA,国营启东电讯厂),ALC-210.4 型电子分析天平(北京赛多利斯仪器系统有限公司),KQ-100B 型超声波清洗器(昆山市超声仪器有限公司),酸度计PHS-25(数显)pH 计(上海精密科学仪器有限公司),80-2B 型离心机(上海安亭科学仪器厂),电热鼓风干燥箱(天津天宇实验仪器有限公司),CBIOUV3 紫外荧光灯(北京赛百奥科技有限公司)。
1.1.2 试药 芍药苷对照品(中国药品生物制品检定所,批号为110736-200731,置五氧化二磷减压干燥器中干燥12 h 以上);绿原酸对照品(批号110753-200413,中国药品生物制品鉴定所),散风解表颗粒(天津医科大学药剂学教研室自制,3 批),薄层层析硅胶G(青岛海洋化工厂,薄层层析用),乙腈、甲醇(天津市风船化学试剂科技有限公司,色谱纯),其它试剂均为市售分析纯,重蒸水(自制)。
1.2 方法
1.2.1 薄层色谱鉴别[1~4]
1.2.1.1 赤芍的薄层色谱鉴别:(1)制备对照品溶液取芍药苷对照品,加适量甲醇超声使溶解,制成每1 mL 含2 mg 芍药苷的对照品溶液。(2)供试品溶液的制备 取散风解表颗粒,研细,精密称定2 g 于25 mL 量瓶中,加甲醇10 mL,超声15 min,过滤,滤液作供试品溶液。(3)赤芍单味药材溶液的制备 取赤芍药材粉末0.5 g 加甲醇10 mL,超声提取15 min,过滤,滤液作为赤芍单味药材溶液。(4)阴性对照溶液的制备 按处方量及工艺制备方法,制备不含赤芍的阴性对照品,根据供试品的制备方法制备阴性溶液,即得。照《中国药典》2010 版(附录ⅥB),分别吸取上述4 种溶液各10μL,分别点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇-水(15∶40∶18∶10)为展开剂,展开,取出,喷以0.5%香草醛硫酸-乙醇溶液(1∶6),热风吹至斑点清晰,日光下检视。
1.2.1.2 金银花的薄层色谱鉴别:(1)对照品溶液的制备 取绿原酸对照品,加甲醇制成1 mg/mL 的溶液,即为对照品溶液。(2)供试品溶液的制备 取散风解表颗粒,研细,称取约2 g,置于25 mL 量瓶中,加甲醇10 mL,超声提取15 min,过滤,滤液即为供试品溶液。(3)金银花单味药材溶液的制备 取金银花药材0.2 g,研细,加甲醇5 mL,超声提取15 min,过滤,滤液即为金银花对照药材溶液。(4)阴性对照溶液的制备 按处方量及工艺制备方法,制备不含金银花的阴性对照品,根据供试品的制备方法制备阴性溶液,即得。照《中国药典》2010 版(附录ⅥB),分别吸取上述4 种溶液各10μL,分别点于同一硅胶G 薄层板上,以乙酸丁酯-甲酸-水(7∶2.5∶2.5)为展开剂,展开,取出,晾干,在365 nm 紫外灯下检视。
1.2.2 芍药苷和绿原酸的含量测定[5~9]
1.2.2.1 色谱条件:(1)芍药苷的色谱条件 色谱柱:TIANHE Kromasil C18(200 mm×4.6 mm,5μm);流动相:乙腈-水(18∶82);流速:0.8 mL/min;检测波长:230 nm;柱温:室温;进样量:20μL。(2)金银花的色谱条件 色谱柱:TIANHE Kromasil C18(200 mm×4.6 mm,5μm);流动相:甲醇-水-冰醋酸-三乙胺(25∶75∶1∶0.1);流速:0.8 mL/min;检测波长:328 nm;柱温:室温;进样量:20μL。
1.2.2.2 溶液的制备:芍药苷检测用溶液的制备:(1)对照品溶液的制备 取芍药苷标准品精密称取5 mg 于10 mL 量瓶中,加适量甲醇超声使溶解,静止至室温,加甲醇稀释定容,摇匀,制成每1 mL 含500μg 芍药苷的溶液,即为对照品溶液。(2)供试品溶液的制备 取散风解表颗粒,研细,精密称取2 g,置于25 mL 量瓶中,精密加入10 mL 甲醇,超声处理15 min,静止至室温,以2 000 r/min 的转速离心5 min,精密量取上清液5 mL 于10 mL 容量瓶中,用甲醇稀释定容,即得。(3)阴性对照溶液的制备 按处方量及工艺制备方法,制备不含赤芍的阴性对照品,根据供试品的制备方法制备阴性溶液,即得。绿原酸检测用溶液的制备:(1)对照品溶液的制备 取绿原酸标准品,精称10 mg,置于10 mL 量瓶中,甲醇定容成1 mg/mL 的溶液,即为对照品溶液。(2)取散风解表颗粒剂,研细,精密称取0.3 g 样品,置于量瓶中,加10 mL 50%甲醇,超声提取15 min,静置至室温,以2 000 r/min 的转速用离心机离心5 min,取上清液6 mL 置于10 mL 量瓶中,用甲醇沉淀,定容。超声5 min,静置至室温,以2 000 r/min 的转速用离心机离心5 min,取上清液8 mL 置于10 mL 量瓶中,用流动相稀释定容。(3)阴性对照溶液的制备 按处方量及工艺制备方法,制备不含金银花的阴性对照品,根据供试品的制备方法制备阴性溶液,即得。
1.2.2.3 线性关系考察:(1)芍药苷:分别精密吸取500μg/mL 芍药苷对照溶液0.6、0.8、1、1.2、1.4、1.6和1.8 mL 置10 mL 量瓶中,用流动相定容至刻度,浓度分别为30、40、50、60、70、80 和90μg/mL,分别进样20μL,记录峰面积。(2)绿原酸:分别精密吸收1 mg/mL 对照品溶液0.075、0.1、0.125、0.15、0.175、0.2 和0.225 mL 置10 mL 量瓶中,流动相稀释定容,浓度依次为7.5、10、12.5、15、17.5、20 和22.5μg/mL,分别进样20μL,记录峰面积。
1.2.2.4 精密度试验:芍药苷按照“1.2.2.1(1)项下”,绿原酸“1.2.2.1(2)项下”色谱条件精密吸取同一供试品溶液重复进样6次,测定峰面积,计算RSD。
1.2.2.5 稳定性试验:精密称取样品,按供试品溶液制备方法操作,按照“1.2.2.1 项下”色谱条件,分别在0、3、6、9、12、24 h 内注入色谱仪,测定峰面积,计算RSD。
1.2.2.6 重复性试验:各称取样品6 份,按供试品溶液制备方法操作,按照“1.2.2.1 项下”色谱条件,各取20μL 进样,测定峰面积,计算RSD。
1.2.2.7 加样回收率试验:芍药苷:精密称取0.5 g散风解表颗粒,分别加入0.58、0.76 和0.87 mL 的500μg/mL 的芍药苷对照品溶液,作为80%、100%和120%加样回收溶液,按供试品溶液方法操作制得样品溶液,进样20μL。绿原酸:采用加样回收法,精密称取0.3 g 散风解表颗粒,分别加入0.205、0.256 和0.308 mL 的1 mg/mL 的绿原酸对照品溶液作为80%,100%和120%加样回收溶液。按照1.2.3.2 项下方法提取,得3 种不同浓度的溶液。按上述色谱条件,进样20μL,测定峰面积,计算回收率。
1.2.2.8 样品测定:取3 批样品,每批3 份,按“1.2.2.2 项下”供试品溶液方法操作,测定芍药苷和绿原酸含量:按“1.2.2.1 项下”色谱条件,进样20μL,测定峰面积,测定芍药苷和绿原酸的含量。
2 结果
2.1 薄层层析 赤芍:供试品、药材和芍药苷对照色谱在相应的位置上显相同蓝紫色斑点,阴性对照色谱与芍药苷对照色谱在相应位置上显淡红色斑点,供试品溶液的Rf 值均为0.28;金银花:供试品、金银花、绿原酸对照品在相应位置显相同斑点,Rf值均为0.38,而阴性对照相应位置没有斑点。
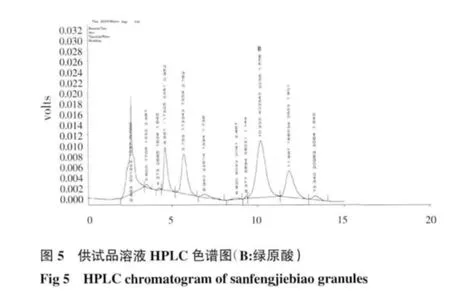
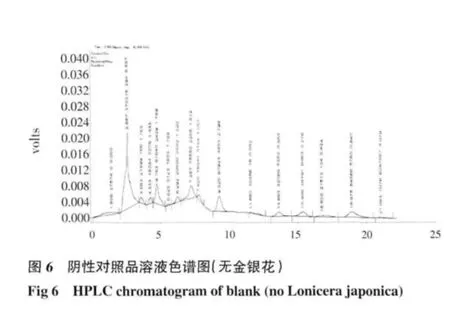
2.2 HPLC 测定结果 芍药苷:在供试品溶液的色谱图中,在与对照品溶液色谱图中相应保留时间处,有相同的色谱峰,而阴性对照溶液无干扰峰,结果见图1~3;绿原酸:在供试品色谱图中,在与对照品色谱图相应的保留时间处,有相同的色谱峰,而阴性对照溶液无干扰峰,结果见图4~6。
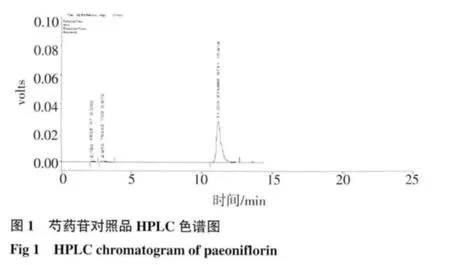
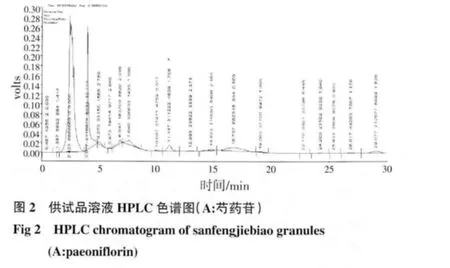
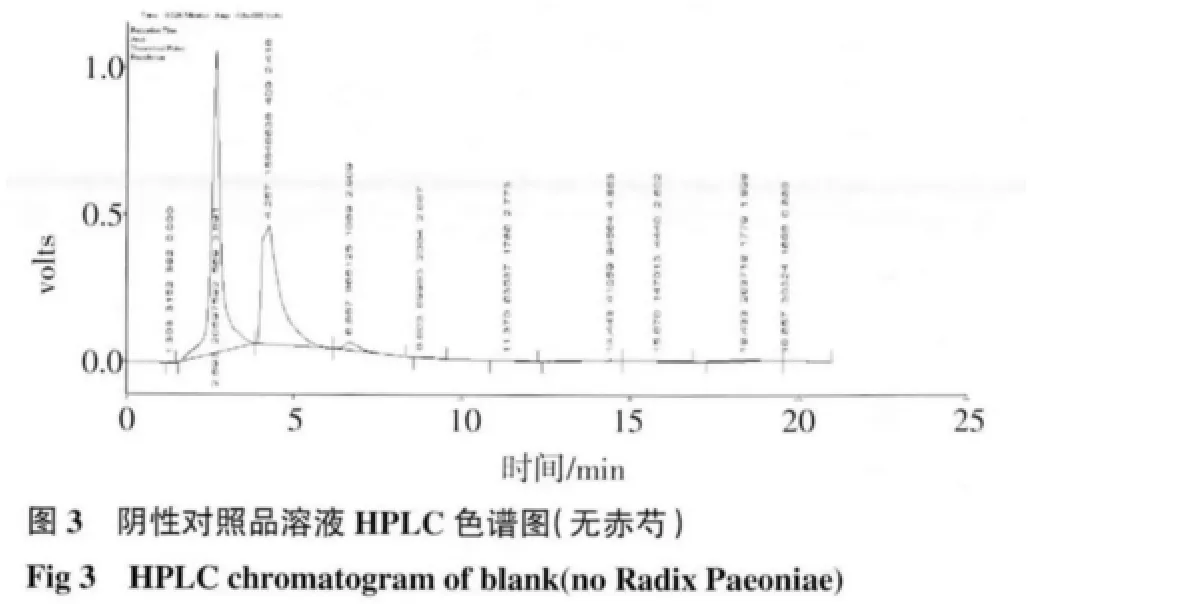
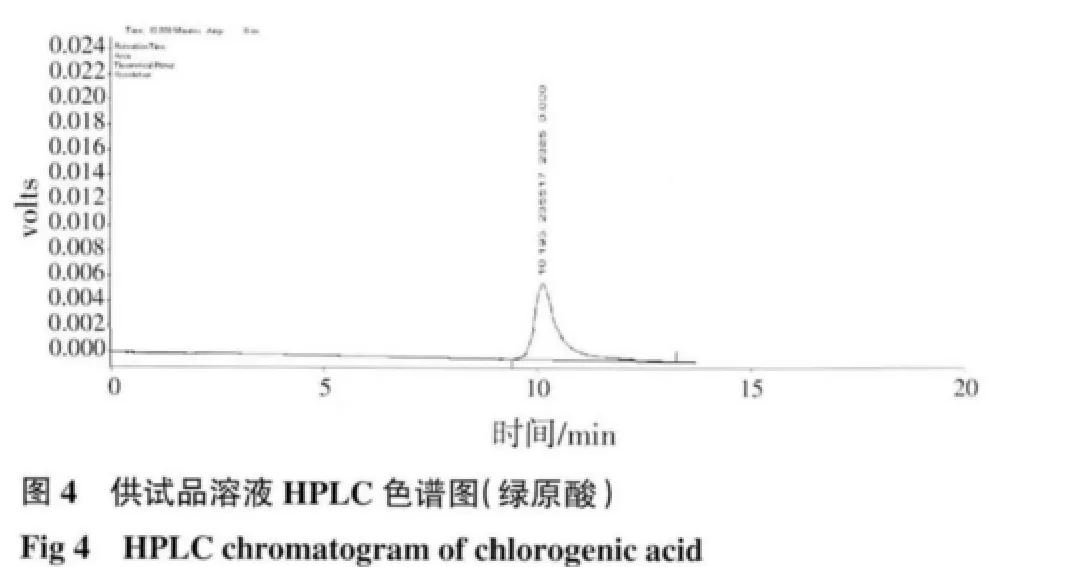
2.3 线性关系考察 芍药苷:以峰面积(Y)对浓度(X)做线性回归的标准曲线,方程为Y=8 411.9X-26 839,r=0.999 5。结果表明,在30~90μg/mL 的浓度范围内线性良好;绿原酸:以峰面积(Y)对浓度(X)做线性回归的标准曲线,方程为Y=88 869X-15 223,r=0.999 7。结果表明,在5~25μg/mL 的浓度范围内线性良好。
2.4 精密度试验 芍药苷日内精密度的RSD为1.18%,日间精密度RSD为1.50%;绿原酸日内精密度RSD为1.10%,日间精密度RSD为1.25%,方法重现性良好,符合要求。
2.5 稳定性试验 芍药苷的RSD为1.68%,绿原酸的RSD为1.24%。结果表明,芍药苷和金银花溶液在24 h 内稳定。
2.6 重复性试验 供试品中芍药苷的RSD为1.22%,绿原酸的RSD为1.47%,本试验重复性较好。
2.7 加样回收试验 结果见表1~2。
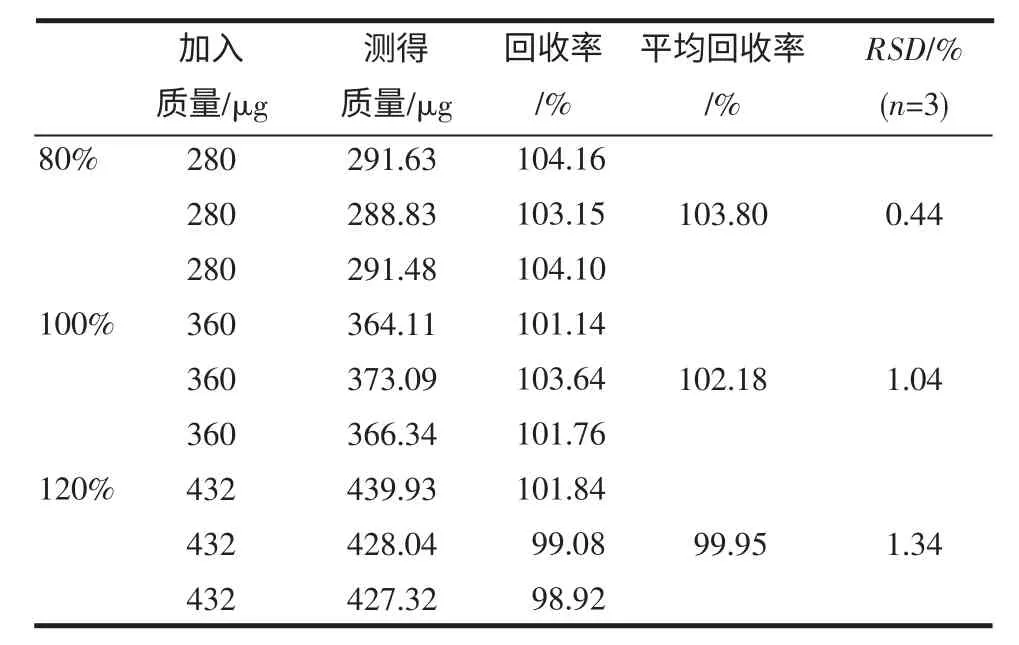
表1 芍药苷回收率试验(n=9)Tab 1 Result of recovery of paeoniflorin(n=9)
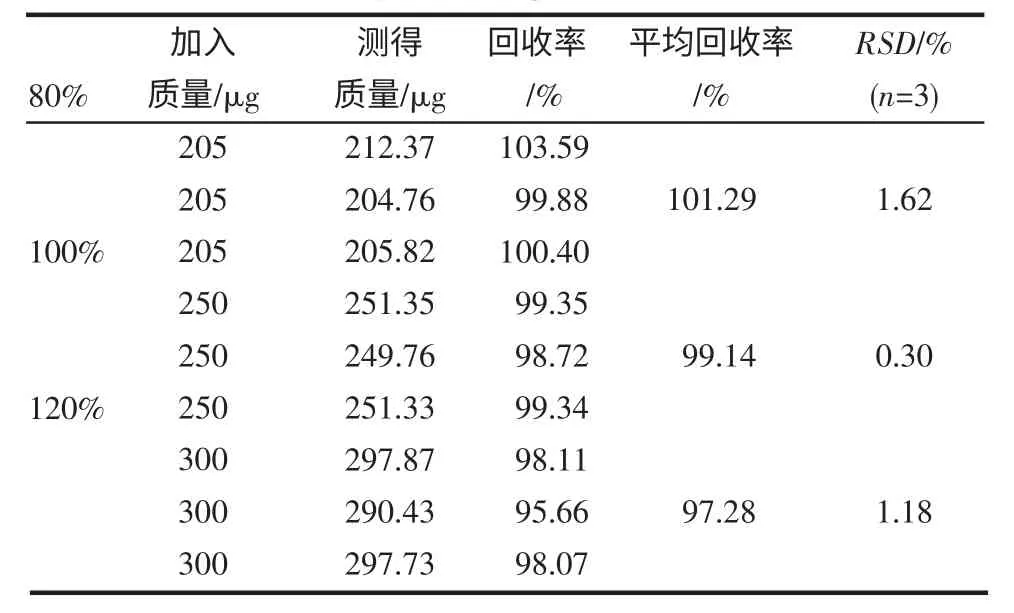
表2 绿原酸回收率试验(n=9)Tab 2 Result of recovery of chlorogenic acid
2.8 含量测定 取3 批样品,每批3 份,按供试品溶液方法操作,测定芍药苷平均含量分别为1 470.67、1 392.51 和1 482.31μg/2 g,RSD 分别为1.69%、1.67%和1.57%;绿原酸平均含量分别为230.10、245.99 和207.26μg/0.3 g,RSD 分别为0.92%、1.10%和1.31%,含量较平均。
3 讨论
3.1 薄层色谱条件 曾经使用过三氯甲烷-甲醇-水(13∶7∶2)作为展开剂,展开后发现在薄层板点样原点处于板面上均没有出现相应的蓝紫色斑点,而在薄层板的展开前沿位置上有相应的蓝紫色斑点,认为展开剂的极性过大。改用三氯甲烷-乙酸乙酯-甲醇-水(15∶40∶18∶10)作展开剂,此展开系统相较于之前有明显改进,且方法使用简便快捷,结果明确,可以作为此处方的薄层色谱的展开系统。
3.2 色谱条件的确定 芍药苷:根据文献报道[4],曾经尝试使用甲醇∶水作为流动相,用芍药苷对照品溶液进样后,发现芍药苷色谱峰峰型不对称,使用乙腈∶水(18∶82)流动相系统,芍药苷色谱峰达到基线分离,且没有干扰,因此确定流动相组成成分。
3.3 绿原酸检测波长 《中国药典》2010 一部中关于绿原酸检测波长的相关描述有差异,取绿原酸对照品适量,用甲醇作为溶剂稀释成适当浓度溶液。以甲醇为空白对照,按照紫外分光光度法,在190~500 nm 波长范围内进行扫描,最大吸收波长在328nm。
3.4 绿原酸流动相的选择 我们发现《中国药典》2010年版和多数参考文献中采用的流动相pH<3,酸性过强。由于C18色谱柱的最佳使用pH 在3~8 之间,为了保护色谱柱,延长色谱柱的使用寿命,选择甲醇-水-冰醋酸-三乙胺(25∶75∶1∶0.1)为流动相。
3.5 供试品溶液制备 采用50%甲醇为提取溶剂和超声提取时,选用10、15 和20 min,结果表明:50%甲醇提取、超声提取15 min,处理样品完全,杂质峰小。
[1]国家药典委员会.《中国药典》(2010 版一部)[S].北京:中国医药科技出版社,2010:147-148
[2]国家药典委员会.《中国药典》(2010 版一部)[S].北京:中国医药科技出版社,2010:205-206
[3]周娟,王颖,伍丕娥,等.血府逐瘀软胶囊中药材的鉴别及芍药苷的含量测定[J].华西药学杂志,2006,21(5):475
[4]徐英宏,肇丽梅,席燕.赤丹丸的薄层鉴别和芍药苷的含量测定[J].中国医药工业杂志,2003,34(8):411
[5]邓芬,叶晓川,方红,等.通痹颗粒质量标准研究[J].中成药,2003,25(12):1019
[6]段启,赵振东,陈华师.HPLC 法测定不同产地栀子中绿原酸[J].西北药学杂志,2009,24(6):449
[7]徐雅敏.HPLC 法测定小儿解表颗粒中金银花及单味金银花绿原酸的含量[J].湖北中医学院学报,2008,10(4):28
[8]房志仲,杨金荣,张璇,等.解热抗炎I 号口服液中绿原酸定性定量方法的研究[J].天津医科大学学报,2000,6(2):153
[9]唐奇.HPLC 法测定复方金银花颗粒中绿原酸的含量[J].中国现代药物应用,2010,4(19):133
