杜仲对MC3T3-E1 成骨细胞及OPG/RANKL 比值的影响
2013-11-04徐祥赫苏艳芳颜世伦
徐祥赫 ,刘 钊,王 虹,苏艳芳,颜世伦,张 君,张 涛
(1.天津医科大学一中心临床学院骨科,天津 300192;2.天津中医药大学中医药研究院,天津 300193;3.天津大学药物科学与技术学院,天津 300072)
骨质疏松症(osteoporosis,OP) 是以一种骨量低下,骨微结构破坏,导致骨脆性增加,易发生骨折为特征的全身性骨病。根据我国2003-2006年的流行病学调查显示,50 岁以上骨质疏松症总患病率女性为20.7%,男性为14.4%。2006年在50 岁以上人群中约有6 944 万人患有骨质疏松症,约2 亿1 千万人存在低骨量。骨质疏松的严重后果是发生骨质疏松性骨折,其危害很大,将会导致病残率和死亡率的增加。骨质疏松症及骨质疏松性骨折的治疗和护理,需要投入巨大的人力和物力,费用高昂,造成沉重的家庭、社会和经济负担[1]。杜仲最早记载于《神农本草经》,被列为上品,具有补肝肾、强筋骨、健腰膝、安胎气、降血压等功效,如今已是被广泛接受的中药。现代研究发现,杜仲具有调节血压、降低血糖、调节血脂、抗菌、抗病毒、抑制肿瘤细胞生长、抗骨质疏松症作用等[2]。目前尚未有关于杜仲作用于OPG/RANKL/RANK 信号通路治疗骨质疏松症的报道。本实验通过含有杜仲的培养基培养MC3T3-E1细胞,观察杜仲对成骨细胞骨保护素(osteoprotegerin,OPG)、核因子κB 受体活化因子配体(ligand of receptor activator of NF-κB,RANKL)表达的影响,为今后进一步探寻杜仲防治骨质疏松症的机制提供基础。
1 材料和方法
1.1 材料
1.1.1 实验细胞 MC3T3-E1(天津中医药大学中医药研究院实验室提供)
1.1.2 药物及试剂 杜仲乙醇提取物(由天津大学苏艳芳教授实验室提供);DMEM 培养基(Solarbio);胎牛血清(Hyclone);胰蛋白酶、MTT、DMSO、BCA 蛋白定量试剂盒、Trixon-100(均来源于北京鼎国生物科技有限公司);碱性磷酸酶试剂盒(ALP,南京建成生物科技有限公司);OPG RANKL 试剂盒(上海源叶生物科技有限公司)。
1.2 方法
1.2.1 配药 杜仲乙醇提取物溶解于DMSO,稀释浓度为100 mg/mL 的溶液储存备用,实验组终浓度为10-1、10-2、10-3mg/mL,空白对照组浓度为0 mg/mL。
1.2.2 细胞增殖检测 细胞按5×103个/mL 密度接种于96 孔板,24 h 后换液,空白对照组加入0 mg/mL杜仲乙醇提取物的培养基,实验组分别加入浓度为10-1、10-2、10-3mg/mL 的含杜仲乙醇提取物的培养基,每种浓度各设6个重复孔。在加入受试药72 h后,每孔加入MTT 液20μL,继续培养4 h 后弃培养液,再在每孔加入150μL DMSO,酶联免疫检测仪上490 nm 波长处测实验组和对照组各孔吸光度值,结果用OD490表示。
1.2.3 碱性磷酸酶检测 细胞按5×103个/mL 密度接种于96 孔板,24 h 后换液,空白对照组加入0 mg/mL 杜仲乙醇提取物的培养基,实验组分别加入浓度为10-1、10-2、10-3mg/mL 的含杜仲乙醇提取物的培养基,每种浓度各设6个重复孔。在加入受试药72 h后,弃培养液,每孔加入1%Trixon-100,并放入4℃冰箱1 h 裂解细胞。1 h 后各孔取10μL 细胞裂解液,根据BCA 蛋白定量试剂盒的说明在562 nm 处检测各孔的吸光度值,测蛋白浓度;各孔取30μL细胞裂解液,根据ALP 试剂盒的说明在520 nm 处检测各孔的吸光度值。经公式:(测定孔吸光度值-空白孔吸光度值)/(标准孔吸光度值-空白孔吸光度值)×酚标准品浓度÷待测样本蛋白浓度,得出每孔碱性磷酸酶的含量。
1.2.4 OPG、RANKL 的检测 细胞按5×103个/mL密度接种于96 孔板,24 h 后换液,空白对照组加入0 mg/mL 杜仲乙醇提取物的培养基,实验组分别加入浓度为10-1、10-2、10-3mg/mL 的含杜仲乙醇提取物的培养基,每种浓度各设6个重复孔。在加入受试药72 h 后,每孔吸取10μL 上清液放入OPG 和RANKL 的专用检测板中,根据ELISA 试剂盒说明检测各孔的OPG 和RANKL 的值。
2 结果
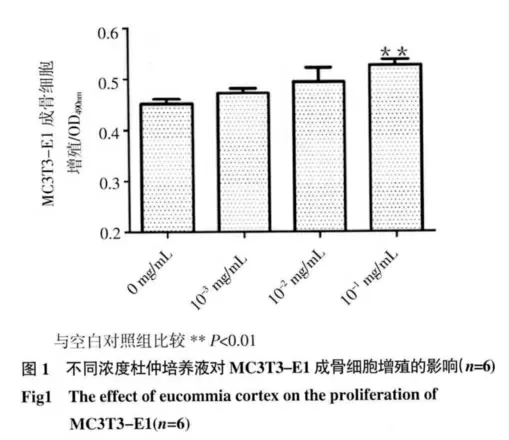
2.1 细胞增殖情况 见图1,加药72 h 后加药组均可促进MC3T3-E1 成骨细胞增殖,且10-1mg/mL组OD 值显著升高,与对照组相比有显著性差异(P<0.01)。表明杜仲对MC3T3-E1 成骨细胞有促进增殖作用,并且有浓度依赖性。
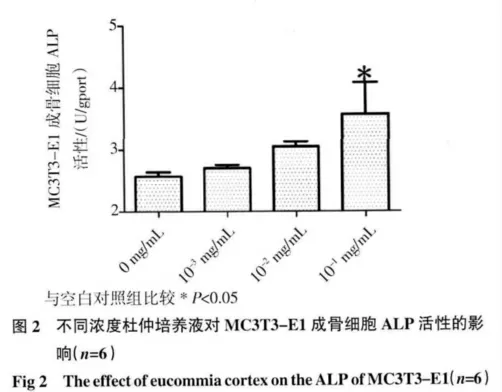
2.2 ALP 活性测定结果 见图2,加药72 h 后加药组均可促进ALP 分泌,且10-1mg/mL组的ALP 活性明显高于对照组,且有显著性差异(P<0.05)。表明杜仲对MC3T3-E1 成骨细胞可促进分化成熟,并有浓度依赖性。
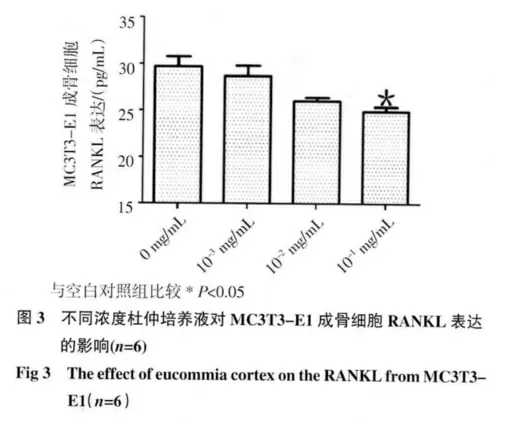
2.3 RANKL 活性测定结果 见图3,加药72 h 后10-1mg/mL组MC3T3-E1 成骨细胞的RANKL 水平明显低于对照组,且有显著性差异(P<0.05)。
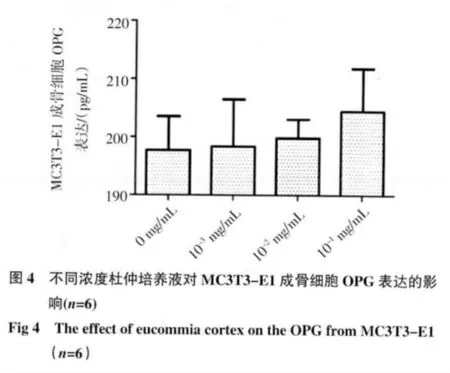
2.4 OPG 活性测定结果 见图4,加药72 h 后杜仲实验组与空白对照组比较可促进OPG 分泌,但与空白对照组比较未见明显差异(P>0.05)。
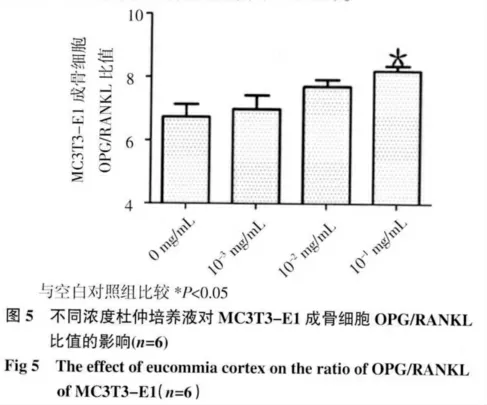
2.5 OPG/RANKL 比值 见图5,经计算杜仲组OPG/RANKL 比值高于空白对照组,且10-1mg/mL组MC3T3-E1 成骨细胞的OPG/RANKL 比值明显高于对照组,有显著性差异( )
3 讨论
骨量的维持是通过反复的骨吸收和骨重建完成的[3]。健康人体内成骨细胞和破骨细胞的数量维持在相对平衡状态以维持正常骨量。一旦破骨细胞的数量超过了成骨细胞的数量打破了相对平衡,就会导致包括骨质疏松症在内的诸多骨病[4]。
RANKL 是一种Ⅱ型同源三聚体跨膜蛋白,高表达于成熟的成骨细胞,其受体是核因子κB 受体活化因子(receptor activator of NF-κB,RANK)。RANK是Ⅰ型跨膜蛋白,是肿瘤坏死因子(TNF)家族成员之一,高表达于成熟的破骨细胞和破骨前体细胞。RANKL 结合到成熟的破骨细胞和破骨前体细胞表面的RANK,促进破骨细胞的分化、活化并抑制其凋亡。OPG 是肿瘤坏死因子受体(TNFR)家族成员,在成熟的成骨细胞上高表达。在骨组织中,OPG 作为一种诱骗受体,可以竞争性的与RANKL 结合,其结合力强于RANKL 与RANK 的结合,从而抑制RANKL 与破骨细胞表面的RANK 结合,抑制破骨细胞的分化成熟[5]。
OPG/ RANKL/ RANK 系统是近年来发现的在破骨细胞分化过程中的一个重要信号传导通路,在调节成骨细胞与破骨细胞之间的平衡发挥重要作用。骨吸收刺激因子是先通过刺激成骨细胞后,再将信号传递给破骨细胞,继而引起破骨细胞下游信号的级联瀑布反应。成骨细胞接受刺激因子的作用后分泌RANKL,RANKL 与破骨前体细胞表面的RANK 结合后,激活核因子κB 通路(nuclear factorkappa B,NF-κB),促使破骨前体细胞分化为成熟的破骨细胞。成骨细胞在接受骨吸收刺激因子时,同时分泌OPG 并以旁分泌方式与RANKL 结合。OPG/RANKL 比值的变化对于维持成骨细胞与破骨细胞之间的平衡很重要,OPG/RANKL 的比值上升可抑制破骨细胞活性和数量[6]。
杜仲中的主要成分是木质素类、环烯醚萜类、黄酮类[2],均对骨质疏松症有积极的防治作用。体外实验表明,杜仲水提液可明显促进大鼠成骨细胞增殖[7],体内实验表明,杜仲可抑制去卵巢大鼠的骨质疏松症,且可明显减少骨密度的降低(BMD)[8]。
通过本实验可知,杜仲实验组均可促进MC3T3-E1 成骨细胞增殖和分化成熟,并有浓度依赖性,10-1mg/mL组与空白组比较可明显促进MC3T3-E1成骨细胞增殖和分化成熟(P<0.05)。杜仲还进一步促进OPG 分泌和抑制RANKL,但与空白对照组比较,杜仲对OPG 无明显促进作用(P>0.05),而对RANKL 有明显抑制作用(P<0.05)。最终结果杜仲可提高OPG/RANKL 的比值(P<0.05)。本实验发现,杜仲通过促进MC3T3-E1 成骨细胞增殖、分化成熟和提高OPG/RANKL 的比值,可间接抑制破骨细胞活性,实现防治骨质疏松症的目的。但杜仲对OPG/RANKL/RANK 系统的作用机制尚不明确,有待于继续研究。基于本实验,为后续杜仲活性成分治疗骨质疏松症提供理论依据。
[1]中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊治指南(2011年)[J].中华骨质疏松和骨矿盐疾病杂志,2011,4(1):2
[2]侯惺,吕文海.近十年杜仲药理研究述要[G].中华中医药学会中药炮制分会2008年学术研讨会论文集,2008:96
[3]Harda S,Rodan G A.Control of osteoblast function an regulation of bone mass[J].Nature,2003,423(6937):349
[4]Lee S U,Shin H K,Min Y K,et al.Accelerates osteoblast differentiation through phosphatidylinositol 3-kinase activation and bone morphogenetic protein -2 gene expression [J].Int Immunopharma col,2008,8(5):741
[5]Anna N,Addolorata C,Francesco P C.Osteoblast physiology in normal and pathological conditions[J].Cell Tissue Res,2011,343(2):289
[6]仲蕾蕾,杨冰,黄晓斌,等.OPG/RANKL/RANK 系统在成骨细胞和破骨细胞相互调节中的作用[J].中国骨质疏松杂志,2011,17(22):1010
[7]邹宇云,韩博,王炼,等.杜仲水提液对大鼠成骨细胞增殖的影响[J].中国兽医杂志,2010,46(8):75
[8]Zhang R,Liu Z G,Li C,et al.Du-Zhong(Eucommia ulmoides Oliv.)cortex extract prevent OVX-induced osteoporosis in rats[J].Bone,2009,45(3):553
