miR-19a 在结肠癌中高表达以及通过靶定DLC1促进结肠癌细胞增殖
2013-11-04郭运生王益民周文阔
郭运生,戚 峰,刘 彤,王益民,周文阔
(1.天津医科大学总医院普通外科,普通外科研究所,天津 300052;2.秦皇岛市第一医院普外二科,秦皇岛 066000)
结肠癌是世界上最常见的恶性肿瘤之一,严重威胁着人类的健康。近年来结肠癌的发病率呈现不断上升的趋势,尽管有手术、化疗等治疗手段,结肠癌病人的5年生存率还是不到10%[1]。因此,深入探讨结肠癌的发病机制,寻找治疗结肠癌有效的分子标记物是至关重要的。微小RNA(miRNA)是一类非编码小RNA 分子,长度约22~25个核苷酸。它可以通过与靶基因3’非翻译区域(3’UTR)的结合位点互补或者不完全互补,促进靶基因的mRNA 降解或者是翻译抑制,并通过此途径参与细胞生长、增殖、分化、凋亡等多个生物学过程[2]。根据其下游靶基因在肿瘤中的功能,miRNA 扮演着肿瘤抑制基因或者是肿瘤癌基因的角色。多项研究已经证实在结肠癌中存在着多个差异性表达的miRNA[3-4]。先前的microRNA 芯片报道发现miR-19a 在结肠癌细胞中是高表达的[5-7],但对于miR-19a 在结肠癌中的作用机制及下游靶基因的研究甚少。本实验旨在寻找miR-19a 下游靶基因,为结肠癌的治疗提供新的靶点。
1 材料与方法
1.1 材料 人结肠癌细胞系SW620 和SW480 均由中国科学院上海生命科学院细胞库提供;8 对结肠癌组织和癌旁正常组织由天津医科大学总医院提供并经过病理学鉴定;转染试剂LipofactamineTM2000购买于美国的Invitrogen 公司;miR-19a mimic 和miR-19a 的反义寡核苷酸均购买于上海吉玛技术制药有限公司。
1.2 方法
1.2.1 细胞培养 SW620 和SW480 均在含有10%胎牛血清的MEMα 的培养液中培养,并含有1%抗生素(链霉素和青霉素)。放置在含有5%CO2的37°C孵箱。
1.2.2 EGFP 荧光报告载体实验 第一天将细胞种在24 孔培养板中(5×104/孔),待第二天细胞密度呈70%左右时,按照LipofactamineTM2000 说明书对细胞进行转染。细胞同时转染miR-19a mimic 和含有DLC1 3’UTR 的荧光报告载体以及对照质粒。转染48 h 后,用1×PBS 清洗细胞,然后用RIPA 裂解细胞,提取蛋白,最后用荧光光度仪(日立)进行荧光值的测量,以RFP 转染作为内参。
1.2.3 RNA 提取和实时荧光定量PCR(real time PCR)RNA 的提取按照Trizol 说明书进行。对于miRNA 的逆转录反应(RT),用特异的miR-19a 的RT 反应,而对于cDNA 的逆转录反应,利用OligodT作为通用引物。对于Real-time PCR 反应体系,遵循以下流程:cDNA 1μL、Primers 各1μL,SYBR 2 荧光染料10μL,无菌蒸馏水7μL。反应程序为95℃变性5 min,然后是95℃,15 s、58℃,30 s、72℃,30 s,进行40个循环(试剂购自Takara 公司,PCR 仪器是Bio-Rad 系统)。
1.2.4 Western blot 第一天将细胞种在6 孔培养板中(30×104/孔),待第二天细胞密度呈70%左右时,按照LipofactamineTM2000 说明书对细胞进行转染。转染48 h 后,利用RIPA 裂解细胞提取蛋白,利用BCA 蛋白测定法进行蛋白浓度测定,最后将30μg 蛋白进行上样,利用SDS-PAGE 胶进行western blot。DLC1 的抗体(抗兔的多克隆抗体)购自武汉三鹰公司,二抗是羊抗兔的单克隆抗体。GAPDH 作为内参。
1.2.5 MTT 比色法检测细胞增殖 第一天将细胞种在96 孔培养板中(2×104/孔),待第二天细胞密度呈70%左右时,按照LipofactamineTM2000 说明书对细胞进行转染。分别在转染24、48 和72 h 进行MTT检测。.每孔加入MTT10μL/100μL 培养液,继续孵育4 h,弃培养液后再加入甲基亚砜(DMSO),避光振荡10 min 至结晶溶解,空白对照调零,并用酶标仪测定570 nm 波长处吸光度值(A)。
1.2.6 克隆形成能力检测细胞增殖 将转染了miR-19a 的细胞消化种到12 孔板(200个细胞/孔)。每隔3 d 对细胞进行换液,待10 d 左右细胞克隆大于50个细胞时,用PBS 清洗细胞,然后用结晶紫进行染色,最后计数形成的克隆。
2 结果
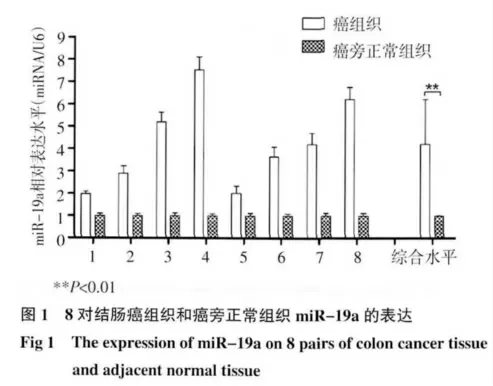
2.1 Real time PCR 检测结肠癌组织和癌旁正常组织中miR-19a 的表达结果 8 对结肠癌组织和癌旁正常组织进行miR-19a 的实时荧光定量PCR 检测,结果表明miR-19a 在结肠癌组织中的表达明显高于癌旁正常组织(P<0.01)(图1)。
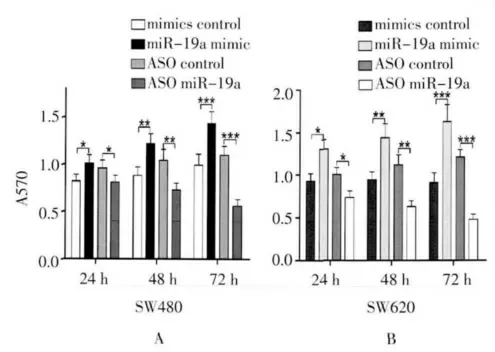
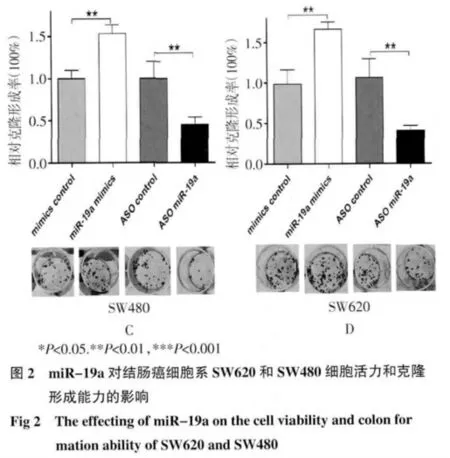
2.2 MTT 比色法和克隆形成检测miR-19a 对结肠癌细胞增殖的影响 SW620 和SW480 细胞内转染miR-19a mimic 或是miR-19a 的反义寡核苷酸(ASO)后,MTT 比色法检测细胞的活性。结果显示在转染24、48 和72 h 后,miR-19a mimic组的细胞活性较对照组明显升高,ASO miR-19a组细胞的活性较对照组明显降低(图2A,2B)。克隆形成实验结果与MTT 实验结果一致(图2C,2D)。
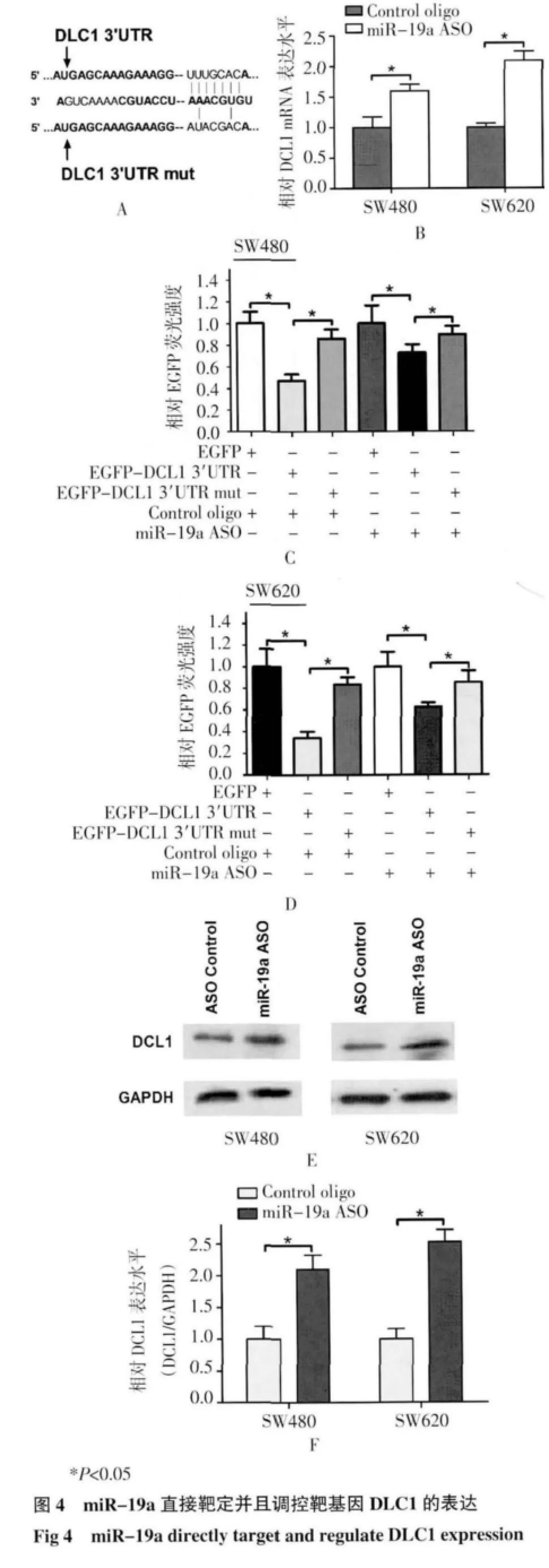
2.3 miR-19a 靶基因的生物信息学预测及荧光报告载体验证 Pictar,TargegtScan 对miR-19a 的靶基因进行预测,结果显示在DLC1 的3’UTR 上含有miR-19a 的结合位点(图3)。

为证明DLC1为miR-19a 的直接调控靶基因,本研究构建了含DLC1 与miR-19a结合位点序列及其结合位点突变序列的EGFP 报告载体(图4A)。Real time PCR 结果显示在SW620 和SW480 细胞内封闭miR-19a 的表达后,DLC1 的mRNA 水平升高(P<0.01)(图4B)。EGFP 报告载体结果显示,封闭miR-19a 后,含有结合位点的报告载体荧光强度增强(P<0.01),而将结合位点突变后,miR-19a 对突变的报告载体的荧光值没有影响(图4C,4D)。western blot 结果与以上实验一致(图4E,4F)。
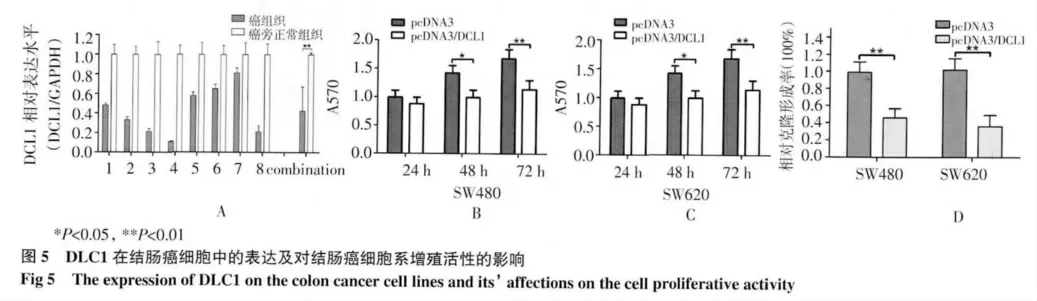
2.4 MTT 比色法和克隆形成检测DLC1 对细胞增殖的影响 Real time PCR 实验显示与癌旁正常组织相比,DLC1 在结肠癌组织内表达降低(P<0.01)(图5A)。SW620 和SW480 细胞转染过表达的DLC1质粒后,MTT 比色显示结肠癌细胞的增殖活性较对照组降低(P<0.01),并且细胞的克隆形成能力下降(P<0.01)(图5B,5C,5D)。
3 讨论
研究发现miRNA 在肿瘤发生发展过程中起着基因调控因子的作用。在肿瘤中会有多种miRNA的异常表达,这与肿瘤的发生发展密不可分。miR-19a 由一个单一的多顺反子miR-17-92 基因簇编码,在多种肿瘤组织中起到原癌基因的作用。研究发现miR-19a 在结肠癌细胞中呈现高表达,但是对miR-19a 在结肠癌细胞中发挥的作用却是了解甚少。Xu 等[8]发现miR-19a 通过靶定CUL5 促进宫颈癌细胞的生长和增殖。在本文中,我们通过实时荧光定量PCR 验证了miR-19a 在结肠癌组织中的高表达情况,并且通过MTT 比色法和克隆形成实验发现miR-19a 促进结肠癌细胞的增殖,这一结果与之前关于miR-19a 在宫颈癌中的研究结果相似。
miRNA 需要通过在转录后水平调控它的靶基因来发挥作用,本研究验证了DLC1 是miR-19a 的直接靶基因。DLC1 是最早在1998年Yuan 等[9]首次成功地在肝癌细胞中确定的一个抑癌基因,陆续的研究发现DLC1 在肝癌﹑肺癌﹑前列腺癌等肿瘤中低表达,扮演着抑癌基因的角色[10-12]。与这些研究结果类似,我们的实验验证了DLC1 在结肠癌组织中也是低表达的,并且抑制细胞的增殖,同样也扮演着抑癌基因的作用。除了DLC1 外,有研究报道在不同的细胞系中,miR-19a 还可以通过靶定CUL5,TNF-α,IMPDH1 and NPEPL1 等靶基因调控细胞的生物学行为[8,13-14]。因此,在结肠癌细胞中,除了DLC1 外,miR-19a 是否还调控其他靶基因共同促进结肠癌细胞的增殖需要进一步研究。
目前对于结肠癌的发生发展机制,尽管提出了多种理论解释,但是这种疾病的确切发生机制仍未完全阐明。所以寻找结肠癌新的诊断标志物具有重要意义。本文中我们发现miR-19a 在结肠癌细胞的增殖中起着重要作用,miR-19a 通过抑制DLC1 的作用而促进结肠癌细胞的增殖,这一结果为寻找结肠癌的致病提供了新的分子机制,并且为探索治疗结肠癌新的分子标记物提供了新的策略。
[1]Gregersen L H,Jacobsen A B,Frankel L B,et al.MicroRNA-145 targets YES and STAT1 in colon cancer cells[J].PLoS One,2010,5(1):e8836
[2]Bartel D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281
[3]Song B,Wang Y,Titmus M A,et al.Molecular mechanism of chemoresistance by miR-215 in osteosarcoma and colon cancer cells[J].Mol Cancer,2010,9:96
[4]Song B,Wang Y,Xi Y,et al.Mechanism of chemoresistance mediated by miR-140 in human osteosarcoma and colon cancer cells[J].Oncogene,2009,28(46):4065
[5]Cekaite L,Rantala J K,Bruun J,et al.MiR-9,-31,and -182 deregulation promote proliferation and tumor cell survival in colon cancer[J].Neoplasia,2012,14(9):868
[6]Arndt G M,Dossey L,Cullen L M,et al.Characterization of global microRNA expression reveals oncogenic potential of miR-145 in metastatic colorectal cancer[J].BMC Cancer,2009,9:374
[7]邹健,于晓峰,虞阳,等.MicroRNA 在人结肠癌干细胞中的表达谱[J].世界华人消化杂志,2010(02):173
[8]Xu X M,Wang X B,Chen M M,et al.MicroRNA-19a and -19b regulate cervical carcinoma cell proliferation and invasion by targeting CUL5[J].Cancer Letters,2012,322(2):148
[9]Feng Y,Zhou H X,Li J H,et al.[Expression of deleted in liver cancer 1 and phosphorelated focal adhesion kinase in breast cancer][J].Nan Fang Yi Ke Da Xue Xue Bao,2011,31(8):1448
[10]Liao Y C,Lo S H.Deleted in liver cancer-1(DLC-1):a tumor suppressor not just for liver[J].Int J Biochem Cell Biol,2008,40(5):843
[11]Yang X,Popescu N C,Zimonjic D B.DLC1 interaction with S100A10 mediates inhibition of in vitro cell invasion and tumorigenicity of lung cancer cells through a RhoGAP-independent mechanism[J].Cancer Res,2011,71(8):2916
[12]Low J S,Tao Q,Ng K M,et al.A novel isoform of the 8p22 tumor suppressor gene DLC1 suppresses tumor growth and is frequently silenced in multiple common tumors[J].Oncogene,2011,30(16):1923
[13]Ouchida M,Kanzaki H,Ito S,et al.Novel direct targets of miR-19a identified in breast cancer cells by a quantitative proteomic approach[J].PLoS One,2012,7(8):e44095
[14]Liu M,Wang Z,Yang S,et al.TNF-α is a novel target of miR-19a[J].Int J Oncol,2011,38(4):1013
