人类P100 蛋白过表达和降表达慢病毒质粒构建及其过表达和降表达白血病细胞株的建立
2013-11-04支蕾,宋娟,姚智,杨洁
支 蕾,宋 娟,姚 智,杨 洁
(天津医科大学免疫学系,国家教育部免疫微环境与疾病重点实验室,天津市细胞与分子免疫学重点实验室,天津 300070)
人类P100 蛋白是一种进化保守,在真核生物体中广泛表达的多功能蛋白,P100 蛋白能促进STAT5 和STAT6 的转录活性,参与Pre-mRNA 剪切[1],增强mRNA 翻译的稳定性[2],也能降解RNA,因此P100 蛋白对细胞生长发育和癌变可能有重要作用,但有关其功能目前尚不完全清楚。因此有必要构建过表达和降表达p100 的质粒,从上调和下调两个方面着手研究P100 蛋白的生物学功能。慢病毒载体是指以人类免疫缺陷病毒-1(HIV-1)来源的一种病毒载体,包含了包装、转染、稳定整合所需要的遗传信息。笔者在慢病毒载体上插入外源基因,在慢病毒包装质粒、包装细胞系的辅助下,经过病毒包装成为有感染力的假病毒颗粒,再通过感染白血病细胞,实现外源基因在白血病细胞中的稳定表达。RNA 干扰技术则是利用短双链RNA 分子降解与之互补的靶mRNA,从而抑制蛋白表达[8],笔者利用RNA 干扰技术抑制P100 蛋白表达。本实验中我们构建含p100 全长基因和针对p100 基因的shRNA 的真核绿色荧光蛋白(GFP)的慢病毒载体,感染NB4 白血病细胞系,分别从上调和下调两个方向研究人类P100 蛋白在白血病中的生物学功能,为该基因功能和相关机制的深入研究奠定基础。
1 材料与方法
1.1 材料 含有人p100 基因片段的重组质粒pEGFP-C2-p l00为本实验室保存;慢病毒载体pCDH1-MCS1-EF1-copGFP 质粒及其包装质粒,293T 细胞由中国医学科学院血液学研究所血液肿瘤实验室惠赠,pLKO.3G 质粒及其包装质粒由天津医科大学免疫学教研室保存;感受态细菌transl-T1为本实验室保存;Not I、EcoRI 和BamHI 限制性内切酶、T4 连接酶购自Fermentas 公司;PacⅠ限制性内切酶购自美国NEB 公司;引物合成由北京六合通公司完成;去内毒素质粒抽提试剂盒购自Omega 公司;回收试剂盒购自北京博大泰克公司;鼠抗人P100 单克隆抗体由本实验室制备;鼠抗人betaactin 单克隆抗体为Sigma 公司产品;辣根过氧化物酶标抗鼠IgG为美国KPL 公司产品。
1.2 方法
1.2.1 人类P100 蛋白过表达慢病毒载体质粒的构建
1.2.1.1 目的片段的获得及质粒载体的酶切纯化:使用Eco RI 和BamHI 限制性内切酶分别对含有人p100 基因片段的重组质粒pEGFP-C2-p100 和慢病毒载体pCDH1-MCS1-EF1-copGFP 质粒进行双酶切,37℃孵育2 h。反应条件:10×Buffer 2μL,Eco RI/BamHI 0.5μL,pEGFP-C2-p100 0.5 pmol/ pCDH1-MCS1-EF1-copGFP 0.05 pmol,ddH2O 补足20μL。经1%琼脂糖凝胶电泳分析并纯化回收酶切片段,以获得目的片段。载体构建模式见图1。

1.2.1.2 体外连接:将带有Eco RI 和BamHI 粘性末端的p100 片段与具有同样粘性末端的pCDH1-MCS1-EF1-copGFP 慢病毒质粒载体连接。反应体系为10×NEB T4 DNA ligase buffer 1μL,NEB T4 DNA ligase 0.5μL,p100 DNA 片 段 0.3 pmol,pCDH1-MCS1-EF1-copGFP 慢病毒质粒酶切片段DNA 0.03 pmol,ddH2O 补足10μL,16℃12 h。
1.2.1.3 重组体的转化、扩增:将连接产物pCDH1-MCS1-EF1-p100-copGFP 转入感受态细菌transl-T1内,通过含有氨苄青霉素的LB 琼脂培养板筛选出单克隆菌落,进行扩增。
1.2.1.4 重组体酶切鉴定:用Eco RI 和BamHI 对重组的pCDH1-MCS1-EF1-p100 -copGFP 质粒进行酶切。结果通过1%琼脂糖凝胶电泳鉴定。
1.2.2 人类P100 蛋白降表达慢病毒载体质粒构建
1.2.2.1 引物设计:针对p100 cDNA 序列设计siRNA。序列如下:P100 I:5′-AAGGCATGA GAGCTAATAATC-3′。siRNA 类型为shRNA;载体为pLKO.3G 载体。Sense+Loop+antisense DNA 模板:P100 I.正 链:5′-AATT—AAGGCATGAG AGCTA ATAATC—CTCGAG—GATTATTAGCTCTCATGCC—TTTTTTAT -3′ ;P100 I.反 链:5′ -AAAAAAA—GGCATGAGAGCTAATAATC—CTCGAG—GATTAT TAGCTCTCATGCCTT-3′。阴性对照HK shRNA 序列:GACTTCATAAGGCG CATGC;Sense+Loop+antisense DNA 模 板:HK:GACTTCATAAGGCGCATGC。HK 正链:5′-AATT—GACTTCATAAGGCGCATGC—CTCGAG—GCATGCGCC TTATGAAGTC—TTTTTTTAT-3′;HK 反链:5′-AAAAAAA—GACTTC ATAAGGCGCATGC—CTCGAG—GCATGCGCCTTA TGAAGTC-3′。载体构建模式见图2。
1.2.2.2 PCR 退火:PCR 反应条件:正链引物5μL;反链引物5μL;10×NEB buffer 25μL;ddH2O 补足35μL。反应条件:95℃4 min,70℃10 min,慢慢降到室温。2%琼脂糖凝胶电泳鉴定。
1.2.2.3 质粒载体的酶切纯化:利用PacⅠ限制性内切酶酶切pLKO.3G 克隆载体,37℃孵育2 h,经1%琼脂糖凝胶电泳分析并纯化回收酶切片段,以获得目的片段。再利用EcoRI 限制性内切酶二次酶切pLKO.3G 载体片段,37℃孵育2 h,经1%琼脂糖凝胶电泳分析并纯化回收酶切片段,以获得目的片段。酶切反应体系为10×NEB buffer 15μL,PacⅠ限制性内切酶/ EcoRI 限制性内切酶1μL,pLKO.3G载体质粒6μg,ddH2O 补足50μL。
1.2.2.4 酶切产物与退火oligo 连接:将经PacⅠ和EcoRI 限制性内切酶酶切pLKO.3G 克隆载体的酶切产物与PCR 退火oligo 进行体外连接。反应体系为10×NEB T4 DNA ligase buffer 2μL,NEB T4 DNA ligase 1μL,退火oligo DNA 片段0.3 pmol,pLKO.3G慢病毒质粒载体DNA 0.03 pmol,ddH2O 补足20μL,16℃12 h。
1.2.2.5 重组体的转化、扩增:将连接产物pLKO.3Gshp100 质粒及pLKO.3G-HK 质粒的构建分别转化感受态细菌transl-T1内,通过含有氨苄青霉素的LB 琼脂培养板筛选出单克隆菌落,进行扩增。
1.2.2.6 重组体酶切鉴定:用BamHⅠ和NotⅠ对pLKO.3G-shp100 质粒及pLKO.3G-HK 质粒进行酶切。将经酶切鉴定证实已插入外源片段的质粒送公司测序。
1.2.3 慢病毒的包装 重组质粒pCDH1-MCS1-EF1-p100-copGFP 和空载体质粒pCDH1-MCS1-EF1-copGFP,分别与包装质粒pPACKA、pPACKB、pPACKC,用磷酸钙沉淀法共转染293T 细胞;对于重组质粒pLKO.3G-shp100 和pLKO.3G-HK 及空载体质粒pLKO.3G,分别与包装质粒psPAX2、pMD2.G 共转染293T 细胞。由于慢病毒载体均表达GFP,于转染后48 h 即可置于荧光显微镜下观察293T 细胞的GFP 表达情况。分别于转染后24、48、72 h 收集病毒上清,2 000 r/min 离心5 min 后,用0.45μm 的滤器过滤后,储存于-80℃冰箱。
1.2.4 细胞的培养和感染 将生长状态良好的5×105NB4 细胞接种于24 孔板中,在含有1 mL 无胎牛血清的1640 培养基中培养。将病毒上清加入NB4细胞中,同时加聚凝胺Polybrene(终浓度8μg/mL),50 000 r/min 离心90 min,置37℃5%CO2孵箱培养;6 h 后补足10%胎牛血清。感染72 h 后在荧光显微镜下观察细胞内荧光情况,显微数码相机拍照。
1.2.5 Western blot 检测P100 蛋白的表达 用RIPA 裂解细胞收集全细胞提取物,离心取上清,BCA法进行蛋白定量,取等量蛋白样品进行SDS-PAGE电泳,经半干转印至PVDF 膜后,经5%脱脂奶粉封闭,用本实验室制备的P100 抗体及二抗孵育,加入曝光底物进行曝光。所有Western blot 均以beta-actin为内参。
2 结果
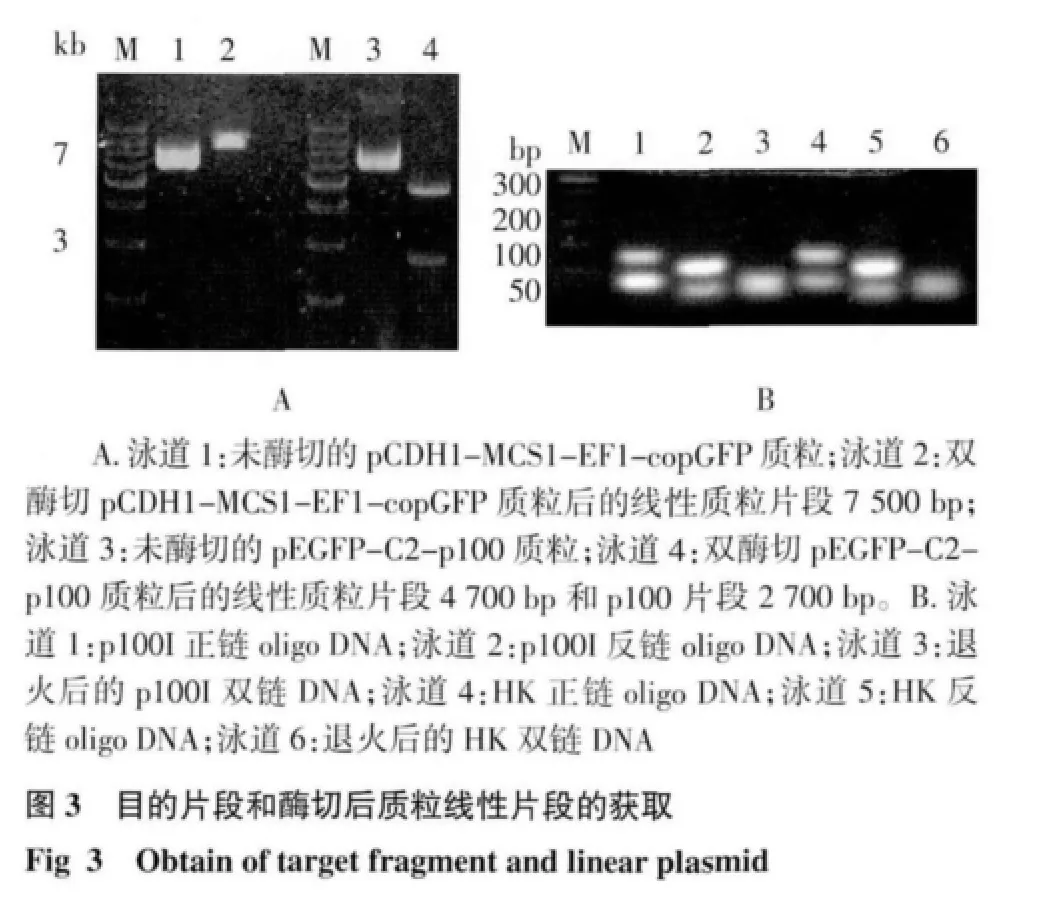
2.1 目的片段的获得及质粒载体的酶切纯化 载体pCDH1-MCS1-EF1-copGFP 质粒经EcoRI 和BamHⅠ双酶切后,可见约7 500 bp 的线性质粒片段(图3A);将pEGFP-C2-p100 质粒经同样酶切后,通过电泳可观察到目的片段,其中p100 全长片段为2 700 bp 和pEGFP-C2-p100 质粒线性片段约4 700 bp(图3A)。合成p100 和HK shRNA oligo DNA,分别将2组互补oligo DNA 进行退火,经琼脂糖凝胶电泳可见2 条合成的DNA 单链片段退火为1 条双链DNA 片段,结果表明退火成功(图3B)。
2.2 重组质粒的鉴定 利用Eco RI 和BamHⅠ对pCDH1-MCS1-EF1-p100-cop GFP(pCDH-p100)质粒进行双酶切,从酶切产物中观察到约2 700 bp 人类p100 片段(图4A)。用BamH Ⅰ和Not Ⅰ对pLKO.3G-shp100(pLKO-shp100)质粒及pLKO.3GHK(pLKO-HK)质粒进行酶切,结果显示插入人类p100 干扰片段及HK 对照片段的质粒载体经双酶切后产生2 274 bp 的片段,而未插入人类p100 干扰片段及HK 对照片段的质粒载体经双酶切后产生2 224 bp 的片段(图4B),并将经酶切鉴定证实已插入外源性片段的质粒送公司测序,测序的引物序列为人U6 启动子的正向引物序列:5′-GACTATCATATGCTTACCGT-3′,测序序列如图4C、4D。
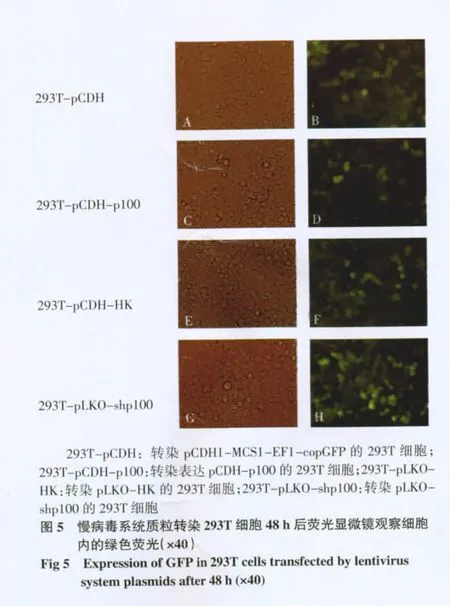
2.3 慢病毒包装 将慢病毒系统质粒共转染293T细胞,48 h 后可见细胞内高表达绿色荧光,见图5。

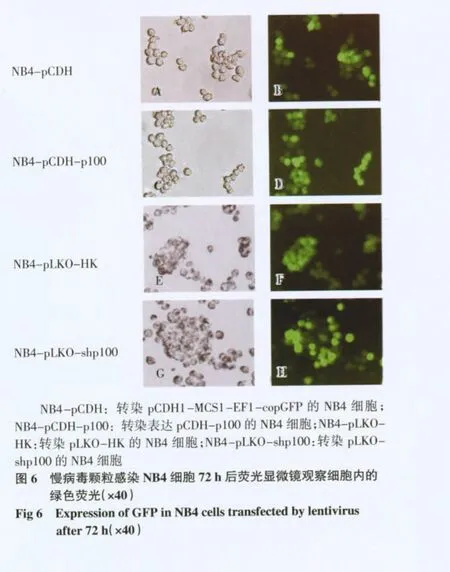
2.4 白血病细胞的感染 假病毒颗粒感染NB4细胞72 h 后可见细胞内高表达绿色荧光,见图6。4组被感染细胞的GFP 阳性率均在90%以上。
2.5 Western blot 检测单克隆细胞株的P100 蛋白表达 将感染后筛选出单克隆的细胞株分别裂解,用Western blot 检测P100 蛋白的表达情况,结果显示,野生型NB4 细胞表达内源性P100 蛋白,见图7A;转染表达p100 的NB4 细胞株(NB4-pCDHp100)中P100 蛋白的表达量较多,而转染pCDH1-MCS1-EF1-copGFP 的NB4 细胞株(NB4-pCDH)中P100 蛋白的表达量基本没有影响(图7A)。转染表达p100 shRNA 的NB4 细胞株(NB4-pLKOshp100)中P100 蛋白的表达量较少,而对照细胞组(NB4-pLKO-HK)中P100 表达量没有受影响,见图7B。

3 讨论
p100 有多功能结构域,能够在不同蛋白复合物中发挥着不同的作用。人类P100 蛋白由N 端4个重复葡萄球菌核酸酶样的SN(1~4)结构域及C 端的Tudor-SN5(TSN)结构域组成。TD 结构域也能够钩住snRNA 的甲基基团。SN 结构域与转录复合物相互结合包括RNA 聚合酶Ⅱ,CREB 结合蛋白(CREB binding protein,CBP),RNA 解链酶A,调控特异性基因转录活性[3]。
近年研究发现人类P100 蛋白与多种疾病相关,如肝癌[4],结肠癌[5],乳腺癌[6],前列腺癌[7],肺癌[8],肾癌[9]。而且,P100 蛋白与疾病的关系越来越受到人们的重视。然而P100 蛋白在白血病发生中作用及分子机制的研究尚有很多空白有待补充。因此笔者构建可稳定过表达P100 的白血病细胞株及可稳定抑制P100 表达的白血病细胞株是非常有必要的,并且可相互作为对照,对后续的P100 蛋白的进一步研究具有非常重要的意义。
慢病毒转染技术在血液系统疾病中具有很好的应用前景,但早期由于缺乏使外源目的基因在白血病细胞稳定表达的方法,这方面的研究进展不明显。而目前慢病毒载体可将外源目的基因直接导入白血病细胞中,从而可能成为治疗白血病的有效途径。笔者采用慢病毒转染白血病细胞,并筛选出过表达及降表达的白血病细胞株,为深入探讨P100 蛋白在白血病发生中的作用提供便利工具。此外笔者构建的慢病毒载体能够融合表达GFP,因此笔者可以通过荧光显微镜及流式细胞术检测细胞的转染效率,还可以利用激光共聚焦显微镜或免疫荧光染色方法观察P100 蛋白在细胞内的定位情况及P100蛋白与不同荧光标记的其他蛋白的结合定位情况,故此质粒的构建对进一步研究P100 蛋白的功能具有重要作用。虽然慢病毒转染技术具有转染后目的蛋白表达效率高,实验可重复性好等优点,但重组病毒的滴度不宜控制。为达到良好的转染效果,实验过程中还需要注意以下几点:(1)包装细胞系和转染细胞的生长状态;(2)控制包装质粒与载体质粒的比例;(3)注意收集到含假病毒颗粒上清液的保存,尽量避免反复冻融。
综上所述,构建人类P100 蛋白过表达和降表达慢病毒质粒及筛选出P100 蛋白过表达和降表达的白血病细胞株具有重要的临床意义和必要的实验基础,深入系统地研究P100 蛋白在白血病发生中的作用及分子机制,可加深对白血病生成机制的认识,有助于筛选白血病治疗的新靶点。
[1]Yang J,V覿lineva T,Hong J,et al.Transcriptional co-activator protein p100 interacts with snRNP proteins and facilitates the assembly of the spliceosome[J].Nucleic Acids Res,2007,35(13):4485
[2]Paukku K,Kalkkinen N,Silvennoinen O,et al.p100 increases AT1R expression through interaction with AT1R 3′-UTR [J].Nucleic Acids Res,2008,36(13):4474
[3]Shaw N,Zhao M,Cheng C,et al.The multifunctional human p100 protein 'hooks' methylated ligands[J].Nat Struct Mol Biol,2007,14(8):779
[4]Yoo B K,Santhekadur P K,Gredler R,et al.Increased RNA-induced silencing complex(RISC)activity contributes to hepatocellular carcinoma[J].Hepatology,2011,53(5):1538
[5]Tsuchiya N,Ochiai M,Nakashima K,et al.SND1,a component of RNA-induced silencing complex,is up-regulated in human colon cancers and implicated in early stage colon carcinogenesis[J].Cancer Res,2007,67(19):9568
[6]Blanco M A,Alec姚kovi'c M,Hua Y,et al.Identification of staphylococcal nuclease domain-containing 1(SND1)as a Metadher in interacting protein with metastasis-promoting functions[J].J Biol Chem,2011,286(22):19982
[7]Kuruma H,Kamata Y,Takahashi H,et al.Staphylococcal nuclease domain -containing protein 1 as a potential tissue marker for prostate cancer[J].Am J Pathol,2009,174(6):2044
[8]Chiosea S,Jelezcova E,Chandran U,et al.Overexpression of Dicer in precursor lesions of lung adenocarcinoma[J].Cancer Res,2007,67(5):2345
[9]Brito G C,Fachel A A,Vettore A L,et al.Identification of protein coding and intronic noncoding RNAs down-regulated in clear cell renal carcinoma[J].Mol Carcinog,2008,47(10):757
