静电纺丝法构建食道上皮组织
2013-10-31陈玲吕静静於学禅康骋竺亚斌
陈玲,吕静静,於学禅,康骋,竺亚斌
宁波大学医学院,浙江 宁波 315211
食道是消化道中很重要的一个组成部分,担负着将水和食物从口咽部输送至胃部的功能。可是全世界因食道病变引起的新发病患及死亡病患正逐年增加,其中发病情况最为严峻的是食道癌[1]。据研究 90%的食道癌发生在食道上皮组织,由鳞状上皮细胞变异所致;另外约 10%的腺癌先由鳞状上皮变异为含腺体上皮然后再演变成食管腺癌的[2-3]。从上面来看,上皮组织变异是导致食道癌发生的主要原因之一,因此构建工程化食道上皮替代病变组织显得尤为重要。
聚乳酸 (PLA)是 FDA认可的具有良好生物相容性和降解性的生物材料,在组织工程中被广泛用于骨、软骨、人造皮肤、周围神经等的支架基材[4-6]。但是由于疏水性和细胞惰性导致其在生物医药领域的应用受到一定限制[7]。人们对PLA进行了一些改性研究,如加入壳聚糖、明胶等天然生物大分子[8-9]或与聚乙醇酸、聚多巴胺等亲水性高分子[10-11]共混或共聚来提高其亲水性及细胞相容性。我们实验室则将PLA与丝素蛋白 (SF)结合使用以期克服 PLA的这些缺陷。丝素蛋白是从蚕丝中提取的一种天然生物大分子,作为手术缝线用于临床已有 100多年的历史。组成丝素蛋白的氨基酸主要是极性氨基酸,能为细胞提供结合位点,对机体细胞粘附力强,且具有缓慢降解性以及良好的力学性能和氧气渗透性[12-14]。
在前期实验中,我们对支持上皮细胞生长的基膜的拓扑结构、化学组成及含量进行了分析,发现基膜由纳米纤维相互交织而成网状结构,纤维直径从28到165 nm,平均为 (66±24)nm,基膜厚度从53到151 nm,平均 (86±15)nm,主要成分是IV型胶原蛋白、层粘连蛋白、巢蛋白及蛋白聚糖等[15]。本文根据上皮细胞与基膜相互作用、相互依存的结构特点,将 PLA和 SF共混纺丝,制备PLA/SF电纺支架,并将从猪食道中提取的基膜蛋白混合液涂覆接枝其上,以期构建具有天然构造的食道上皮组织,为将来替代或修复病变食道上皮组织提供实验基础。
1 材料与方法
1.1 原料与试剂
聚乳酸 (PLA,Mn 300 kDa,宁波环球生物材料有限公司);蚕丝 (宁波市江东吉达贸易有限公司);三氟乙酸 (TFA,上海达瑞精细化学品有限公司);DMEM、Dispase、AAS (100 U/mL penicillin,100 U/mL streptomycin,0.25 g/mL amphotericin B)、FBS (Gibco公司,美国);鼠抗人角蛋白 14抗体 (CK14,Santa Cruz Biotechnology);FITC-标记羊抗鼠IgG (北京奥博森生物科技公司);4',6'-二脒基-2-苯基吲哚(DAPI,Sigma);所有用于Western blotting实验的试剂购于碧云天生物试剂研究所;其余试剂均购于国药集团化学试剂有限公司,本实验所使用的水均为去离子水。
1.2 丝素蛋白 (SF)的提取
将蚕丝剪碎,置于0.5% Na2CO3水溶液中煮沸1 h,用水反复冲洗干净蚕丝表面的丝胶,烘干。取脱胶后的蚕丝与Ca2(NO3)2·4H2O共混,其浴比为蚕丝:Ca2(NO3)2·4H2O=1∶20,80 ℃水浴溶解1.5 h,用水透析3 d,每4 h换水1次,使用 20 000分子量的聚乙二醇浓缩至低含水量,冷冻真空抽干,得海绵状丝素蛋白,备用。
1.3 电纺丝支架的制备
将PLA溶于二氯甲烷及二甲基甲酰胺 (DMF)混合液 (3∶2,V∶V)中,PLA、SF 按比例 (1∶2,W∶W)溶于三氟乙酸中,制备成浓度为 0.10~0.25 g/mL的PLA、PLA/SF电纺液,利用本实验室自制的静电纺丝系统[15]进行电纺,通过调节电压10~25 kV、接收距离7~11 cm以及流速0.2~1.5 mL/h,得到不同形态的纤维膜,在光镜下观察电纺纤维的尺寸是否均匀,是否有液滴产生,确定电纺条件。利用锡纸和玻片 (Ф14 mm)作为承载电纺丝纤维的载体,其中锡纸载体是为了进行纤维支架表征,玻片是为了检测细胞相容性,收集的纤维膜室温晾干后,置于 4 ℃保存,备用。
1.4 猪食道基膜蛋白的提取与支架上的涂覆接枝
从屠宰场获得猪食道粘膜及粘膜下层,洗净,剪碎,依次浸入以下溶液中低温匀浆,1) 3.4 mol/L NaCl,0.05 mol/L Tris-HCl,蛋白酶抑制剂(2 mmol/L苯甲基磺酰氟,1 mmol/L N-甲基马来酰亚胺);2)0.5 mol/L NaCl,0.05 mol/L Tris-HCl,蛋白酶抑制剂。匀浆液低温离心 (8 000 r/min,20 min),取上清液存于-70 ℃,备用[16]。
将上述制备的PLA电纺支架置于24孔培养板中,每孔滴加300 μL蛋白提取液,4 ℃冰箱放置24 h,PBS清洗3次,去除多余蛋白,真空冻干后4 ℃冷藏,备用。
1.5 电纺丝支架的表征
1.5.1 扫描电镜观察
将电纺纤维膜利用导电胶固定在样品台上,表面喷金 (E-1010,Hitach)80 s后在扫描电镜 (SEM)(S-3400N,Hitach)下观察纤维的形态并拍照。利用Image J图像分析软件对电镜图像进行分析,每个样品选取3张SEM图片,每张图片至少对30根纤维进行直径的测量,纤维直径用平均值±标准差 (x±s)表示。
1.5.2 力学性能测试
将电纺纤维膜裁成测试有效长度为2 cm,宽度1 cm的哑铃状,利用测厚仪测得样品厚度在0.1~0.3 mm之间,每组纤维膜取3个样品,在力学测试仪 (3 366,Instron)上以1 mm/min的加载速度施加应力进行拉伸测试,测试结果取平均值。
1.5.3 降解性能测试
备用电纺纤维膜用75%的酒精浸泡2 h消毒处理后,再用灭菌PBS进行漂洗,最后浸入含100 U/mL双抗的PBS (pH 7.4)溶液中,37 ℃水浴,按1 d、3 d、7 d、15 d、30 d、60 d等6个时间点取样。取出的样品用蒸馏水洗涤干净,真空抽干后称重。每组支架每个时间点取 3个平行样品,取平均值。按下列公式计算失重率:
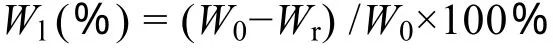
其中,Wl代表失重率 (%);W0代表原重;Wr代表余重。
1.6 支架细胞相容性研究
1.6.1 支架的预处理
75%酒精浸泡电纺纤维膜支架4 h,PBS置换去净酒精,DMEM培养基浸泡0.5 h后吸去多余培养液,置于培养箱中,待接种细胞。
1.6.2 上皮细胞的原代培养及支架上种植
取屠宰场现宰新鲜猪食管3~4 cm,沿纵轴切开后,修剪去除肉眼可见的粘膜下组织,以含100 U/mL双抗的PBS溶液轻轻刮洗粘膜上层表面,95%酒精冲洗1次,75%酒精冲洗1次,1%次氯酸钠轻轻刮洗1 min,PBS清洗3次,浸入含100 U/mL双抗的PBS中带回。实验室超净台中,5%碘伏浸泡3 min,PBS清洗干净;然后将标本浸入50 mg/mL Dispase分离酶消化液(PBS配制),4 ℃过夜,使鳞状上皮细胞层与基底的间质层分离。随后将上皮层剪碎,用胰蛋白酶在37 ℃水浴条件下消化10 min,将鳞状上皮细胞层分离为单细胞悬液,用等量含 10%胎牛血清的DMEM培养基终止消化,吸管吹打均匀,弃去组织碎块,1 500 r/min离心5 min,弃上清,含100 U/mL AAS的完全培养基吹打成单细胞悬液,接种在培养瓶中。培养箱中 37 ℃、5%CO2培养24 h第1次换液,然后每隔4 d换液1次,待细胞密度达80%左右后用胰蛋白酶消化,按1∶2分瓶传代。取2~4代细胞进行实验。
1.6.3 支架上细胞形态观察
0.25 %胰蛋白酶消化培养中上皮细胞,利用含10%胎牛血清的DMEM培养基重悬细胞,以2.6×104cells/cm2的密度种植于聚苯乙烯 24孔细胞培养板 (TCPS)中的电纺纤维膜支架上。14 d后终止培养,吸去培养基,用PBS清洗干净,2.5%戊二醛水溶液室温固定0.5 h,PBS清洗 3次,蒸馏水清洗 3次,经酒精系列梯度脱水 (30%、40%、50%、70%、80%、90%、95%、95%、100%、100%),室温真空干燥,样品喷金后,扫描电镜观察细胞在支架上的粘附及铺展情况。
1.6.4 MTT法检测细胞粘附与增殖
将上皮细胞种植支架上,分别培养2 d、7 d、14 d的细胞支架培养物为实验组,未铺加支架的 96孔细胞培养板 (TCPS)为对照组。通过MTT比色法检测细胞粘附增殖情况:每孔加入MTT (0.5 mg/mL)溶液 40 μL,继续培养 4 h,小心弃去上清液,保留底部蓝色结晶,每孔再加入400 μL二甲基亚砜 (DMSO),吹打均匀,并对应移至另一空96孔板,在490 nm波长下用酶标仪 (MaxM5,Spectra)测定各孔的吸光度值。每组设3个复孔,并测试3次,取平均值。
1.6.5 免疫荧光分析
细胞培养14 d后,吸弃24孔板中的培养基,PBS清洗3次;4%多聚甲醛室温固定30 min;0.1% Triton X-100破膜10 min,PBS清洗3次,每次10 min;羊血清室温封闭1 h,吸干血清;加入一抗 CK14 (鼠抗人,按1∶100稀释),4 ℃孵育过夜,PBS清洗3次,每次10 min;异硫氰酸荧光素 (FITC)标记的二抗 (羊抗鼠,按 1∶100稀释)室温避光孵育1 h,PBS清洗3次,每次5 min;4',6'-二脒基-2-苯基吲哚 (DAPI,3 mg/mL)浸染10 min,PBS清洗3次,每次10 min。使用抗荧光淬灭剂进行封片,立即在激光共聚焦显微镜 (FV-1000,Olympus)下进行荧光观察及拍照。
1.6.6 Western blotting分析
细胞培养14 d后,吸弃培养基,PBS清洗3次,用含有单去污剂 (PMSF)的蛋白裂解液(RIPA)抽提蛋白,冰上裂解30 min,将蛋白液吸至EP管中,4 ℃、12 000 r/min离心5 min,取上清。将25 μL蛋白提取液加入5%浓缩胶,电泳槽 (Mini-protean tetra system, Bio-RAD)接通电源,起始电压80 V,待溴酚蓝条带进入12%分离胶后调整电压为100 V。电泳结束后,80 V恒定电压转膜1.5 h。随后,把PVDF膜浸泡在含 5%脱脂奶粉的 TBS-T溶液中,室温封闭1 h。将PVDF膜置于CK14角蛋白 (封闭液稀释1∶200)溶液中,在摇床上室温孵育1 h。TBS-T洗膜3次。然后将PVDF膜用辣根过氧化物酶标记的羊抗鼠-IGg二抗 (1∶2 000封闭液稀释)室温孵育1 h,洗膜。暗室中,底片曝光、显影、定影,扫描成图,利用Image J软件进行分析。
2 结果与分析
2.1 电纺支架的表征
2.1.1 支架的纤维特征
在静电纺丝过程中,纤维形态的影响因素有很多,如溶液浓度、溶剂、电压、接收距离、溶液流速、以及周围环境等[17-20]。本文中所使用的电纺设备为本课题组自行研制、设计,在参考了以前的实验成果的基础上[21-23],通过不断调整纺丝条件,并经过光学显微镜对电纺纤维的观察,确定最佳电纺丝参数 (表1)。
高分子聚合物溶液通过静电纺丝法制成纤维膜的有利条件是对纤维直径的可控性。SEM观察电纺纤维的表面形貌如图 1所示,PLA和PLA/SF在上述纺丝条件下均形成了纤维,表面上也没有明显的液珠,纤维之间孔隙较大,连通性好,这样的结构在进行细胞培养时有利于营养液的流通和代谢物的排出[24]。通过Image J软件的分析,得到两组支架的纤维直径 (表2),PLA和PLA/SF的纤维直径均分布在200至400 nm之间,而且丝素蛋白的加入使电纺丝纤维的平均直径明显下降。
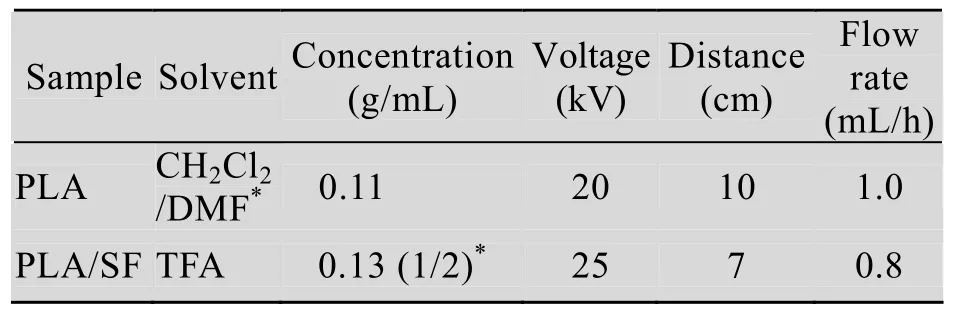
表1 PLA和PLA/SF电纺丝参数Table 1 Electrospinning parameters for PLA and PLA/SF scaffold

图1 多孔纤维支架扫描电镜图Fig. 1 Scaffold morphology observed under SEM. (a)PLA. (b)PLA/SF.

表2 电纺丝支架的纤维直径及力学性能参数Table 2 Quantitative results of scaffold’s diameter(nm)and mechanical properties
2.1.2 支架的力学性能
组织工程支架除了要给种子细胞提供足够的生长空间外,还要在细胞尚未形成组织之前,能为细胞提供一定的支撑且承受再生组织及周边组织、器官及细胞等微环境带来的张力;因此体外构建的支架不仅要求具有一定的强度,还要具有一定的柔软度,以利于细胞在其上进行迁移运动。图2为PLA、PLA/SF纤维膜的应力-应变曲线。支架的最大应力 (ó)、最大应变 (ε)及杨氏模量 (E)见表 2。PLA 纤维膜的最大应力为(1.8±0.2)MPa,在应变为 (11.2±1.2)%时出现屈服,有局部断裂发生。PLA与 SF共纺所得的PLA/SF纤维膜的最大应力为 (2.4±0.4)MPa,高于PLA。这是可以理解的,因为SF本身具有很好的机械强度,素有生物钢美称,SF和PLA共纺所得纤维其机械强度也因此得到提升。另外,PLA/SF在达到最大应变 (13.4±0.9)% 时发生断裂。从上来看,PLA/SF的应力和应变与猪食道脱细胞后的粘膜及粘膜下层基质的力学性能 (拉升应力 (2±0.84)MPa)[25]相近。因此,我们认为 PLA/SF电纺丝支架在力学性能上可以满足作为构建食道上皮的支架要求。
2.1.3 支架的降解性能
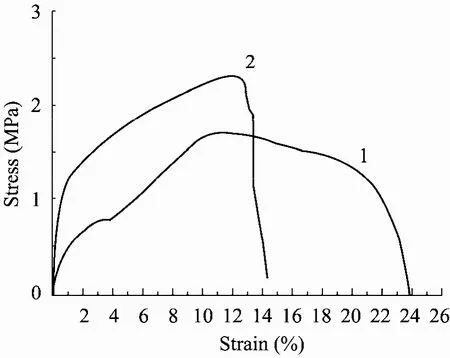
图2 电纺支架材料的力学性能Fig. 2 Tensile stress-strain curve of electrospinning scaffolds. 1: PLA; 2: PLA/SF.
细胞在支架上生长的过程中,支架的降解速率必须与细胞的生长速度相吻合,过快或者过慢均会影响细胞的生长[26-27]。支架的降解性主要取决于构成支架的材料的降解性:对于聚合物来说,它的降解包括聚合物本身分子链逐渐断裂而生成低聚物、低分子量降解产物甚至单体及低分子量降解产物所有的化学过程[28]。所以影响聚合物降解的因素有很多,如:聚合物本身的化学性质如组成成分、分子链间的相互作用、材料的亲/疏水性以及结构参数如外形、结晶度、取向程度、表面结构等[29-31]。实验证明,可降解聚合物在体内、体外的降解规律具有很好的相似性,支架在体外的降解情况能为组织工程支架体内实验的降解情况提供参考依据[32-34]。本实验将支架浸于PBS (pH 7.4,相当于生理盐水)溶液中,以60 d为测试周期,检测支架的质量损失为计量指标,统计支架体外降解率,如图 3所示。PLA/SF和PLA的降解趋势非常接近,在7 d以前支架降解速率变化不甚明显,在7~30 d之间,支架的 PLA降解速率急剧升到达 17.4%后又趋于平缓。但是降解率60 d时达 (20.4±0.9)%,相较于之前Vieira等的研究稍有增大。他们发现从第2周开始,支架的质量损耗就有大幅增加,达到20%左右[35],这与我们的实验结果相似。
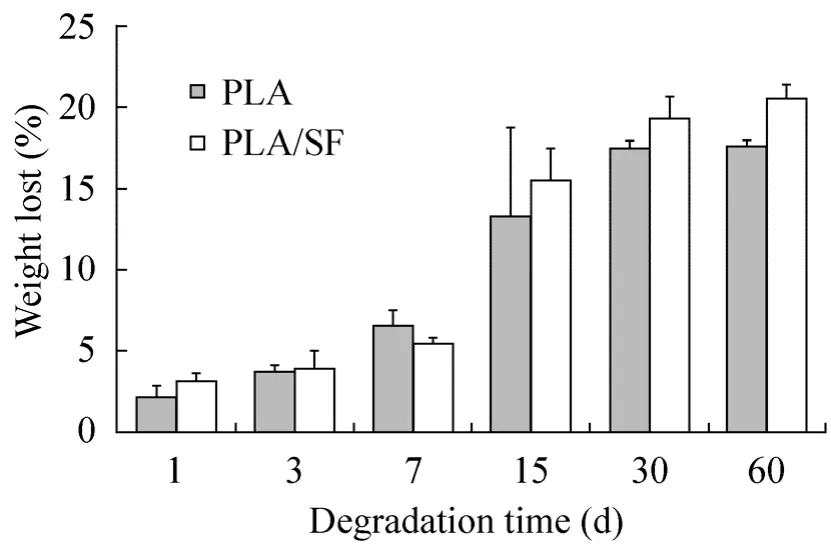
图3 电纺支架PLA和PLA/SF的质量损失随时间的变化Fig. 3 Weight loss (%)of PLA and PLA/SF as a function of time. Scaffolds was immersed in PBS (pH 7.4)supplemented with 100 U/mL Penicillinstreptomycin at 37 ℃.
2.2 电纺支架的细胞相容性
组成上皮组织的上皮细胞是生长在基膜上的复层未角化的鳞状上皮细胞,呈连续性片状构造,而这一层基膜虽然只有几十纳米的厚度,却对上皮细胞的生长、迁移及功能分化起着非常重要的作用。在前期研究中,我们发现基膜是由IV型胶原蛋白、层粘连蛋白、巢蛋白及蛋白聚糖等组成的纳米纤维交织而成的网状结构。为了提高高分子复合材料的生物相容性为了提高支架的相容性,很多研究工作是在人工支架上接枝胶原蛋白[36-39],其中的Ⅳ型胶原蛋白起促使上皮细胞生长,迁移至表皮形成粘膜层的作用。但是它仅仅是食道粘膜基层蛋白中的一种,因此我们从猪食道粘膜组织中提取了基膜的蛋白液,并将其包被于PLA的电纺丝纤维上,希望提高支架的上皮细胞相容性 (图4)。检测其上上皮细胞的生长情况,同时将PLA和PLA/SF (图1)作为对照组。结果发现基膜蛋白提取液接枝的PLA支架与空白PLA支架相比,纤维稍有变粗、钝化,孔尺寸稍小,但是更加平滑。

图4 coated-PLA支架扫描电镜图Fig. 4 SEM picture of coated-PLA scaffold.
上皮细胞是一种贴壁生长的细胞,其活性的不同与纤维支架中的纤维形态、结晶结构以及化学组成相关[40]。因此我们可以通过检测 3种支架上细胞的粘附及增殖能力的不同来评断支架细胞相容性的优劣。我们将猪F3上皮细胞分别种植于PLA、PLA/SF和 coated-PLA三种电纺丝支架上一定时间后对其细胞型貌和粘附增殖情况进行检测。
从培养14 d的扫描电镜图可以看出上皮细胞在 3种支架上均有一定的粘附和增殖。但是在PLA支架上上皮细胞生长密度较低,未连接成片 (图5a,箭头);PLA/SF支架上上皮细胞的生长情况较PLA稍好 (图5b);coated-PLA支架上上皮细胞的生长密度不仅远远高于 PLA、PLA/SF支架 (图5c),而且细胞与支架纤维融为一体连接细胞呈铺路石状紧密排列 (图5c2),与原代上皮细胞相同[41],这样支架更有利于细胞的粘附以及细胞间作用。

图5 上皮细胞生长在支架上的扫描电镜图Fig. 5 Cell morphology observed under SEM. ECs were seeded on the scaffolds of PLA (a), PLA/SF (b)and coated-PLA (c). 1 and 2, different magnification. Cells were seeded at the density of 2.6´104 cells /cm2and cultured for 14 d at 37 ℃ in humidified air with 5% CO2 (The same conditions were followed for all cell culture).
上皮细胞本身紧密连接呈连续性片状生长,并被基底膜所支撑;而在离体培养时,通常比其他种类的细胞更难粘附于体外基底材料。在检测上皮细胞线粒体活性随时间变化的14 d中,我们以第2 天的细胞活性反映细胞在支架上的粘附率,PLA作为负对照,TCPS作为正对照。图6显示上皮细胞在PLA、PLA/SF、coated-PLA支架上的粘附率依次升高,虽然不及 TCPS,但是 coated-PLA支架上的细胞活性相较PLA支架提高了很多。在7 d及14 d时coated-PLA支架上的上皮细胞活性是3种支架中最好的,PLA/SF次之。这说明涂覆接枝在支架上的基膜蛋白提取液对上皮细胞具有明显的支持作用,这可能是因为提取于食道的基膜蛋白给细胞提供了一个类似于与体内细胞外基质的微环境,大大促进了上皮细胞的生长。其次,来自于动物体的丝素蛋白的存在也对提高支架的细胞相容性具有促进作用,这些结果与 SEM所观察到的结果也是一致的。
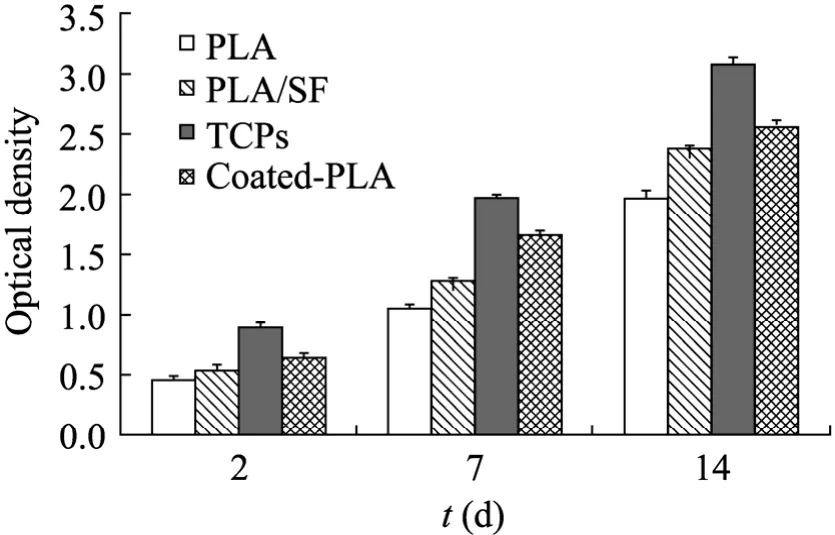
图6 细胞活性随时间的变化Fig. 6 Mitochondrial activity of epithelial cells as a function of culture time.
2.3 免疫组化分析
食道上皮层组织由里(靠近基膜)及外(内腔)依细胞分化程度可以分为基底层、棘层及角质层 3层。外层角质层细胞高度分化呈多角形,其胞质中含有大量角蛋白丝,具有很好的机械性能如耐磨、耐穿刺等,在不断脱落的同时,自我修复能力也比较强。棘层细胞较肥大,胞浆较丰富。而基底层细胞属新生上皮,细胞拥挤,体积圆润小巧,排列与铺路石相似,分布于正常食管粘膜上皮基底层和基底旁细胞层,其功能是增殖分化以修补外两层细胞的损失、脱落。从猪食道粘膜分离得到的上皮细胞呈现了铺路石状的上皮细胞型貌 (图7a2,b2,c2)。
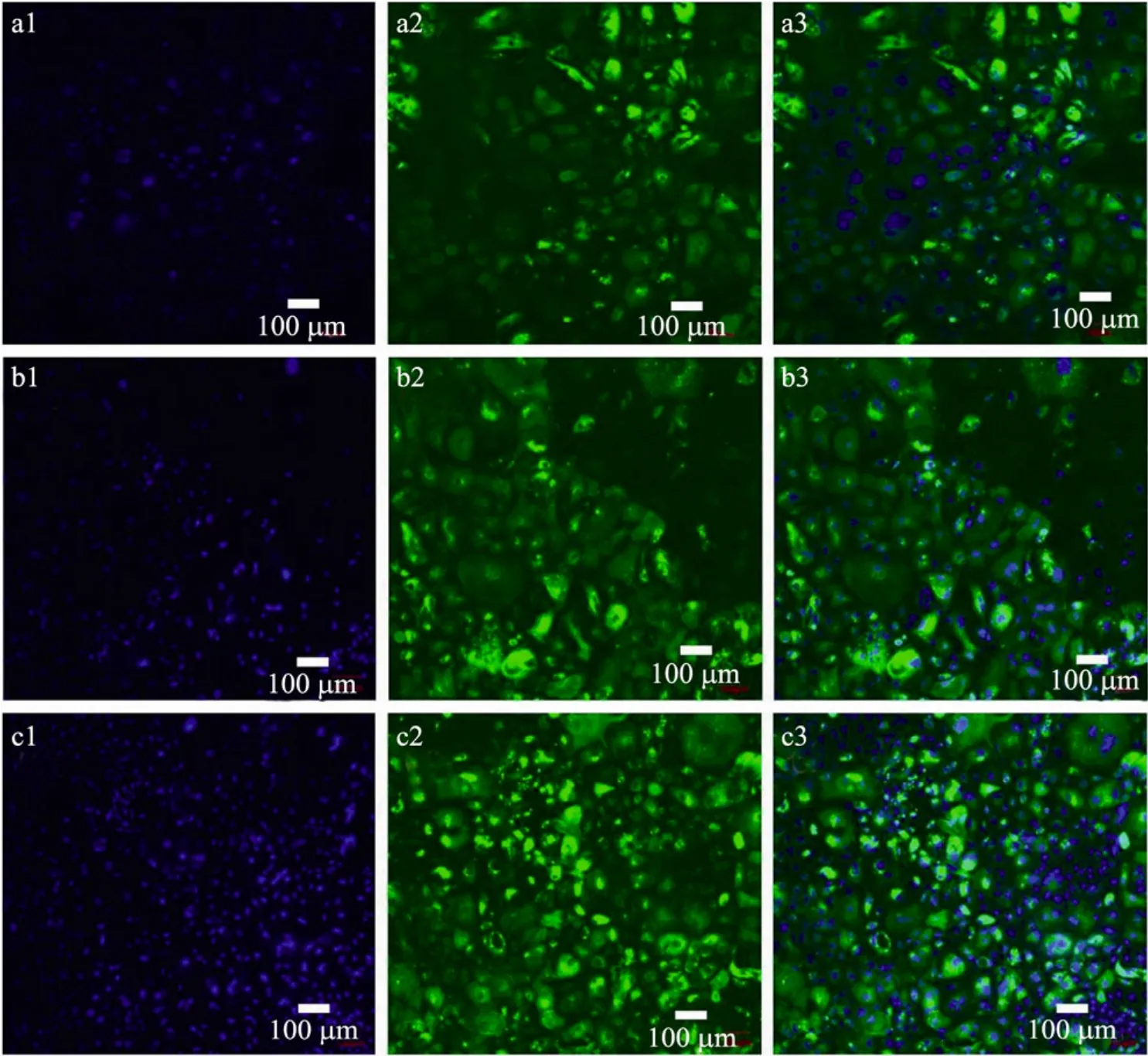
图7 种植在支架上的上皮细胞CK14角蛋白免疫荧光图Fig. 7 Immunofluorescences of epithelial cells seeded on scaffolds. Anti-keratin CK14 was used as the primary antibody. The nuclei were stained with DAPI to display blue (1)and the keratin was stained with anti-CK14 to display green (2). (3)is the composite of (1)and (2). (a)PLA, (b)PLA/SF and (c)coated-PLA.
角蛋白作为上皮细胞特异性结构蛋白,是上皮细胞分化的标志性产物[42]。其中,CK14角蛋白仅在基底层上皮细胞胞质中表达[43],可以用来作为基底层上皮细胞的鉴定,其在胞质中的含量是细胞增殖活力的一个评判指标。细胞经过14 d的培养,以单克隆抗体CK14免疫染色细胞质,DAPI染细胞核,通过激光共聚焦显微镜观察细胞的形态、增殖活力,其中蓝色 (1)为细胞核,绿色 (2)为CK14蛋白染色,(3)是二者的复合。图 7可以看出多数细胞均有少量CK14蛋白的表达,说明在支架上种植的细胞确为上皮细胞,且活性较好,分化未完全,具有很好的增殖能力。通过蓝色细胞核的计数,各支架表面生长的上皮细胞密度由低到高依次为PLA (图 7a)、PLA/SF (图 7b)、coated-PLA (图7c)。这一结果与MTT法测得的细胞增殖率结果一致。
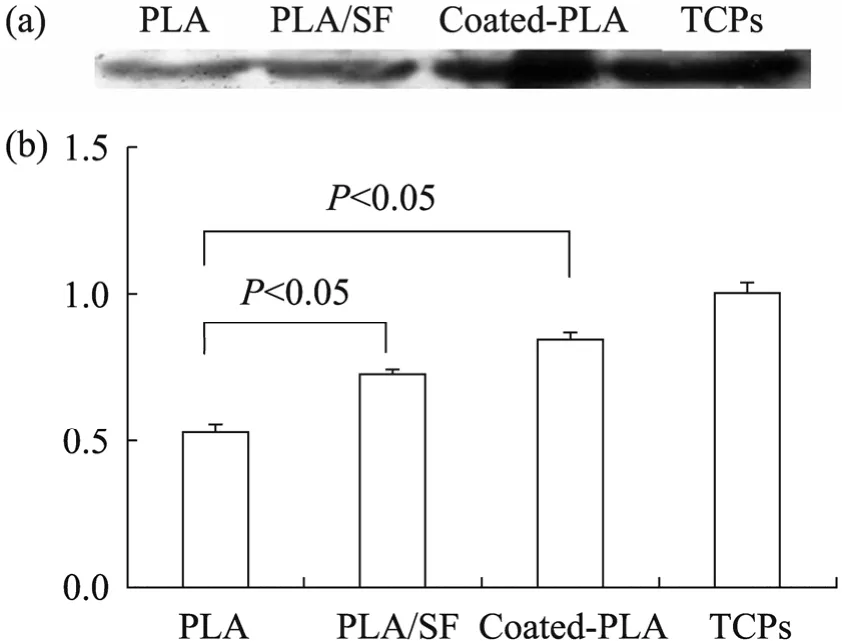
图8 Western blotting测定支架上细胞的CK14角蛋白相对表达量Fig. 8 Relative quantification of CK14 expressed by epithelial cells cultured on different scaffolds using Western blotting technology. (a)The stripes from left to right represent the CK14 expression of cells on PLA,PLA/SF, coated-PLA scaffolds and TCPS, respectively.Cells were cultured in vitro for 14 d. (b)Quantitative analysis of CK14 (results were relatively percented by TCPS). P values less than 0.05 were considered to be significant.
运用Western blotting技术对培养中的细胞其 CK14角蛋白表达情况进行了检测 (图 8)。由左至右的灰条带分别代表 CK14角蛋白在PLA、PLA/SF、coated-PLA支架及 TCPS上的表达量 (图8a)。条带的颜色逐渐加深,表明蛋白量逐渐增加,PLA上细胞的 CK14角蛋白量最少,PLA/SF上次之,coated-PLA上细胞的CK14角蛋白是这3种支架中最多的。定量分析后 (图8b)显示,上皮细胞在coated-PLA支架上和在PLA/SF上表达的CK14角蛋白量均明显比在 PLA支架上的表达量多。这说明细胞在coated-PLA和 PLA/SF两种支架上的增殖能力强于PLA支架。
3 结论
我们以PLA为基材,利用静电纺丝技术,模拟食道基膜结构,构建了PLA及PLA/SF两种纳米纤维多孔支架。经纤维形态、力学行为、降解等性能检测,发现PLA/SF电纺纤维膜纤维结构更趋近于基膜结构,且机械性能更好;通过MTT、免疫荧光、Western blotting等方法检测支架与上皮细胞的作用情况,表明PLA/SF具有与原代上皮细胞较好的相容性。从猪食道粘膜中提取基膜蛋白液并将其涂覆接枝于PLA支架纤维表面后,上皮细胞的粘附和增殖得到了明显提高;而且体外培养14 d后仍然维持CK14蛋白的表达功能,我们认为基膜蛋白的包被可以提供给体外培养的细胞以类似体内的生长微环境,有助于上皮细胞的生长和功能分化。目前,我们正在尝试将上皮组织的电纺丝纤维支架与肌组织的构建相结合,为最终构建出具有完善形状和功能的组织工程化食道提供有力的实验依据。
[1]Pisani P, Parkin DM, Bray F, et al. Estimates of the worldwide mortality from 25 cancers in 1990.Int J Cancer, 1999, 83(1): 18−29.
[2]Daly JM, Fry WA, Little AG, et al. Esophageal cancer: results of an American College of Surgeons patient care evaluation study. J Am Coll Surg, 2000, 190(5): 562−572.
[3]Enzinger PC, Mayer RJ. Esophageal cancer. N Engl J Med, 2003, 349(23): 2241−2252.
[4]Jung Y, Park MS, Lee JW, et al.Cartilageregeneration with highly-elastic three-dimensional scaffolds prepared from biodegradable poly (L-lactide-co-3-caprolactone).Biomaterials, 2008, 29(35): 4630−4636.
[5]Gundy S, Manning G, O’Connell E, et al. Human coronary artery smooth muscle cell response to a novel PLA textile/fibrin gel composite scaffold.Acta Biomater, 2008, 4(6): 1734−1744.
[6]Shum AW, Mak AF. Morphological and biomechanical characterization of poly (glycolic acid)scaffolds after in vitro degradation. Polym Degrad Stab, 2003, 81(1): 141−149.
[7]Kurella A, Dahotre NB. Review paper: surface modification for bioimplants: the role of laser surface engineering. J Biomater Appl, 2005,20(1): 5−50.
[8]Li LH, Ding S, Zhou CR. Preparation and biological evaluation of PLA/chitosan composite M aterials. J Biomed Eng, 2003, 20(3): 398−400(in Chinese).李立华, 丁珊, 周长忍. 聚乳酸/壳聚糖多孔支架材料的生物学性能评价. 生物医学工程学杂志, 2003, 20(3): 398−400.
[9]Lazzeri L, Cascone MG, Danti S, et al.Gelatine/PLLA sponge-like scaffolds:morphological and biological characterization. J Mater Sci Mater Med, 2006, 17(12): 1211−1217.
[10]Cantón I, Mckean R, Charnley M, et al.Development of an Ibuprofen-releasing biodegradable PLA/PGA electrospun scaffold for tissue regeneration. Biotechnol Bioeng, 2010,105(2): 396−408.
[11]Cont L, Grant D, Scotchford C, et al. Composite PLA scaffolds reinforced with PDO fibers for tissue engineering. J Biomater Appl, 2011, 27(6):707–716.
[12]Chen L, Zhu YB, Li YY, et al. Progress and prospect of electrospun silk fibroin in construction of tissue-engineering scaffold. Chin J Biotech,2011, 27(6): 831−837 (in Chinese).陈玲, 竺亚斌, 李媛媛, 等. 丝素蛋白在电纺丝法构建组织工程支架中的应用进展. 生物工程学报, 2011, 27(6): 831−837.
[13]Servoli E, Maniglio D, Motta A, et al. Surface properties of silk fibroin films and their interaction with fibroblasts. Macromol Biosci,2005, 5(12): 1175−1183.
[14]Gil ES, Park SH, Marchant J, et al. Response of human corneal fibroblasts on silk film surface patterns. Macromol Biosci, 2010, 10(6): 664−673.
[15]Zhu YB. A electrospining device was applied to prepare porous nanfibers: China, 200810062323.8. 2008−10−08 (in Chinese).竺亚斌. 一种用于制备多空纳米纤维的电纺装置: 中国, 200810062323. 8. 2008−10−08.
[16]Li Y, Zhu Y, Yu H, et al. Topographic characterization and protein quantification of esophageal basement membrane for scaffold design reference in tissue engineering. J Biomed Mater Res B Appl Biomater, 2012, 100B(1):265−273.
[17]Pham QP, Sharma U, Mikos AG. Electrospun poly(ε-caprolactone)microfiber and multilayer nanofiber/microfiber scaffolds: characterization of scaffolds and measurement of cellular infiltration.Biomacromolecules, 2006, 7(10): 2796−2805.
[18]Haghi A, Akbari M. Trends in electrospinning of natural nanofibers. Phys Status Solid A, 2007,204(6): 1830−1834.
[19]Chong E, Phan T, Lim I, et al. Evaluation of electrospun PCL/gelatin nanofibrous scaffold for wound healing and layered dermal reconstitution.ActaBiomater, 2007, 3(3): 321−330.
[20]Szentivanyi A, Chakradeo T, Zernetsch H, et al.Electrospun cellular microenvironments:Understanding controlled release and scaffold structure. Adv Drug Deliv Rev, 2011, 63(4):209−220.
[21]Zhu YB, Li YY, Liu YX. Fabrication of gelatin and polycaprolactonecomposite fibers using electrospinning technology. Chin J Ningbo Univ:Nat Sci Eng, 2009, 22(3): 408−413 (in Chinese).竺亚斌, 李媛媛, 刘玉新. 电纺丝复合纤维的制备及其影响因素探讨. 宁波大学学报: 理工版,2009, 22(3): 408−413.
[22]Zhu Y, Leong MF, Ong WF, et al. Esophageal epithelium regeneration on fibronectin grafted poly(L-lactide-co-caprolactone)(PLLC)nanofiber scaffold. Biomaterials, 2007, 28(5): 861−868.
[23]Zhu Y, Cao Y, Pan J, et al. Macro-alignment of electrospun fibers for vascular tissue engineering.J Biomed Mater Res B, Appl Biomater, 2009,92(2): 508−516.
[24]Li C, Vepari C, Jin HJ, et al. Electrospun silk-BMP-2 scaffolds for bone tissue engineering.Biomaterials, 2006, 27(16): 3115−3124.
[25]Yu JY, Zhu YB, Li YY, et al. Fabrication and mechanical properties of decellularized esophageal submucosal matrix. Chin J Biomed Eng, 2011, 30(2): 312−315 (in Chinese).俞 珺瑶, 竺亚斌, 李媛媛, 等. 食管粘膜下层脱细胞基质的制备及其力学性能. 中国生物医学工程学报, 2011, 30(2): 312−315.
[26]Ma PX. Biomimetic materials for tissue engineering.Adv Drug Deliv Rev, 2008, 60(2): 184−198.
[27]Yixiang D, Yong T, Liao S, et al. Degradation of electrospun nanofiber scaffold by short wave length ultraviolet radiation treatment and its potential applications in tissue engineering. Tissue Eng A, 2008, 14(8): 1321−1329.
[28]Göpferich A. Mechanisms of polymer degradation and erosion. Biomaterials, 1996, 17(2): 103−114.
[29]Lee SJ, Yoo JJ, Lim GJ, et al. In vitro evaluation of electrospun nanofiber scaffolds for vascular graft application. J Biomed Mater Res A, 2007,83(4): 999−1008.
[30]Tan AR, Ifkovits JL, Baker BM, et al.Electrospinning of photo-crosslinked and degradable fibrous scaffolds. J Biomed Mater Res A, 2008, 87(4): 1034−1043.
[31]Jose MV, Thomas V, Johnson KT, et al. Aligned PLGA/HA nanofibrous nanocomposite scaffolds for bone tissue engineering. Acta Biomater, 2009,5(1): 305−315.
[32]Landes CA, Kriener S, Menzer M, et al.Resorbable plate osteosynthesis of dislocated or pathological mandibular fractures: a prospective clinical trial of two amorphous L-/DL-lactide copolymer 2-mm miniplate systems. Plast Reconst Surg, 2003, 111(2): 601−610.
[33]Suzuki T, Kawamura H, Kasahara T, et al.Resorbable poly-L-lactide plates and screws for the treatment of mandibular condylar process fractures: a clinical and radiologic follow-up study. J Oral Maxillofac Surg, 2004, 62(8):919−924.
[34]Eppley BL. Use of resorbable plates and screws in pediatric facial fractures. J Oral Maxillofac Surg,2005, 63(3): 385−391.
[35]Vieira A, Vieira J, Ferra J, et al. Mechanical study of PLA–PCL fibers during in vitro degradation. J Mech Behav Biomed Mater, 2011, 4(3): 451−460.
[36]Duan Y, Wang Z, Yan W, et al. Preparation of collagen-coated electrospunnanofibers by remote plasma treatment and their biological properties. J Biomater Sci Polym Ed, 2007, 18(9): 1153−1164.
[37]Zhu Y, Ong WF. Epithelium regeneration on collagen (IV)grafted polycaprolactone for esophageal tissue engineering. Mater Sci Eng C,2009, 29(3): 1046−1050.
[38]Chang KY, Hung LH, Chu I, et al. The application of type II collagen and chondroitin sulfate grafted PCL porous scaffold in cartilage tissue engineering. J Biomed Mater Res A, 2010, 92(2):712−723.
[39]Singh S, Wu BM, Dunn JCY. 2012. Delivery of VEGF using collagen-coated polycaprolactone scaffolds stimulates angiogenesis. J Biomed Mater Res A, 2012, 100A(3): 720−727.
[40]Yeo IS, Oh JE, Jeong L, et al. Collagen-based biomimetic nanofibrous scaffolds: preparation and characterization of collagen/silk fibroin bicomponentnanofibrous structures.Biomacromolecules, 2008, 9(4): 1106−1116.
[41]Sarosiek J, McCallum RW. Mechanisms of oesophageal mucosal defence. Best Pract Res Clin Gastroenterol, 2000, 14(5): 701−717.
[42]Dale BA, Salonen J, Jones AH. New approaches and concepts in the study of differentiation of oral epithelia. Crit Rev Oral Biol Med, 1990, 1(3):167−190.
[43]Judd DA, Battista PJ, Behm DD. Culture of human keratinocytes in defined serum-free medium. Focus, 1997, 19(1): 2−5.
