pH与溶氧控制对解淀粉芽胞杆菌发酵粗甘油生产2,3-丁二醇的影响
2013-10-31杨套伟饶志明张显徐美娟许正宏
杨套伟,饶志明,张显,徐美娟,许正宏
1 江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122
2 江南大学药学院,江苏 无锡 214122
生物能源作为可再生能源,有望减少能源供给对石油的依赖程度[1]。2,3-丁二醇作为一种非常重要的生物基四碳平台化合物,广泛应用于化工、能源、燃料等多个领域[2]。近年来用糖质原料发酵生产 2,3-丁二醇取得了较好的实验室研究结果[2-3]。然而从2,3-丁二醇的应用前景及未来发展趋势看,开发以廉价的非粮糖质为原料发酵生产 2,3-丁二醇具有很好的发展前景[3]。利用油脂生产生物柴油的过程中,约产生 10%的副产物甘油[4]。将这些粗甘油转化为更有附加价值的产品,有利于降低这些副产物的处理成本[4]。肺炎克雷伯氏菌Klebsiella pneumoniae能利用甘油生产 2,3-丁二醇[5],但产生大量副产物1,3-丙二醇,这将增加产物后续分离纯化的成本,且该菌种具有潜在致病性,不符合工业化安全生产的要求[2]。解淀粉芽胞杆菌Bacillus amyloliquefaciens是被美国FDA认可的安全菌株[6]。因此,利用安全菌株B. amyloliquefaciens发酵粗甘油生产2,3-丁二醇具有良好应用前景。
1 材料与方法
1.1 菌种
B. amyloliquefaciens B10-127,由本研究室筛选并保藏[7]。
1.2 方法
1.2.1 培养基
种子培养基[7](g/L):葡萄糖20,胰蛋白胨10,酵母粉5,NaCl 10,自然pH值。
发酵培养基[7](g/L):粗甘油100,玉米浆 20,酵母膏 5,柠檬酸铵 3,K2HPO44,柠檬酸 5,MgSO40.2,FeSO4·7H2O 0.01,初始 pH 6.0。
粗甘油购自诸暨兴绿油脂有限公司,主要成分(W/W):88%甘油, 0.5%灰分, 0.2%甲醇, 10%水。
1.2.2 培养方法
菌种活化:将200 μL冷冻保藏的菌液接种于10 mL 种子培养基中,37 ℃、160 r/min 培养 16 h。
摇瓶发酵实验:将充分活化的种子液按 4%(V/V)接种量接种到含有 50 mL液体培养基的250 mL三角瓶中,37 ℃、160 r/min摇床培养。
发酵罐发酵实验:5 L发酵罐,装液量2.5 L,接种量4% (V/V);发酵条件:通气量0.33 vvm,发酵温度 37 ℃;流加发酵时,粗甘油水溶液补料液:500 g/600 mL; 采用脉冲流加发酵,每次流加 1/4体积的母液,甘油消耗完后即刻停止发酵。
1.2.3 分析方法
菌体量以干重(DCW)表示,产物和底物浓度检测使用高效液相色谱法,具体方法见文献[5]。
2 结果与分析
2.1 粗甘油对2,3-丁二醇发酵的影响
以纯甘油作为对照,考察了粗甘油是否适合作为2,3-丁二醇发酵的直接底物。初始甘油含量为40 g/L,结果如图1所示,发酵60 h后,菌株利用粗甘油和纯甘油的效率基本一样,分别消耗甘油36.7 g/L和38.6 g/L;另外菌体生长情况基本相同,并且2,3-丁二醇产量都在13 g/L左右。由此可知,B. amyloliquefaciens能直接以粗甘油为底物发酵生产2,3-丁二醇。
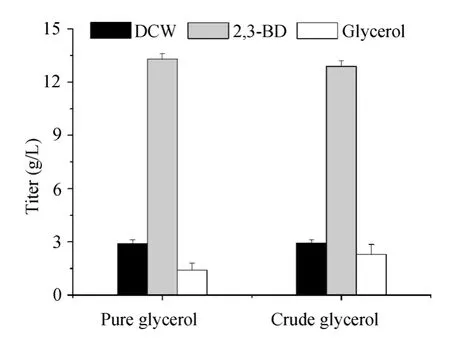
图1 不同类型的甘油对2,3-丁二醇发酵的影响Fig. 1 Effects of different types of glycerol on 2,3-BD production.
2.2 pH控制策略对2,3-丁二醇发酵的影响
2,3-丁二醇的主要生理功能是应对有机酸抑制和维持胞内氧化还原平衡[2]。设定初始 pH为5.5~7.5,考察了发酵过程中 pH控制与否对 2,3-丁二醇发酵的影响,结果如表 1所示,发酵过程中不控制pH (初始pH为6.5)更有利于菌体生长和2,3-丁二醇的合成,这和Biebl等[9]的研究结果相一致。此时,产物合成与pH变化曲线如图2所示,发酵前期pH迅速下降至5.5左右,随后pH上升至 6.5附近并呈现上下波动现象。Petrov和Petrova[5]在考察pH对K. pneumoniae发酵甘油合成2,3-丁二醇的影响时也发现类似的现象。Petrov和 Petrova解释说,2,3-丁二醇是受有机酸诱导而合成的,在初始发酵阶段,菌株先合成大量有机酸,从而导致发酵环境中pH值大幅降低,细胞因酸性环境刺激而快速转向2,3-丁二醇的合成,乙酸合成暂时中止,pH因而逐渐升高;pH升高又刺激了乙酸的合成;随后2,3-丁二醇和乙酸合成效率交替升高,从而导致pH值的上下波动。所以,发酵过程中不控制pH更能促进2,3-丁二醇的合成。
2.3 溶氧分阶段调控2,3-丁二醇发酵过程
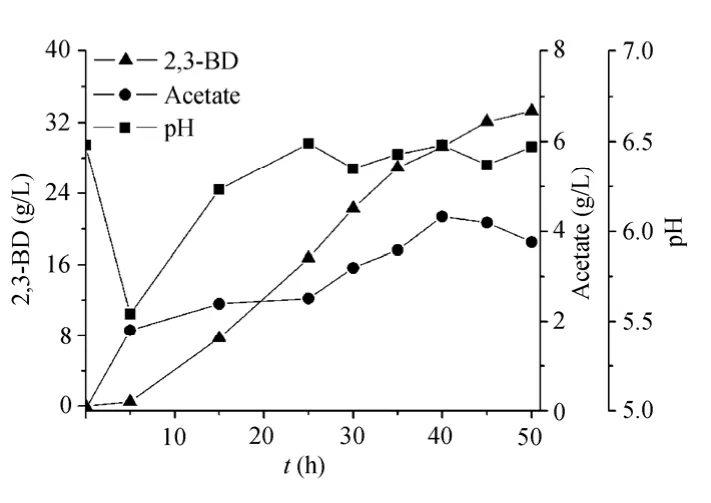
图2 pH与产物合成变化曲线Fig. 2 Time profiles of pH changes and products formation under pH non-controlled.
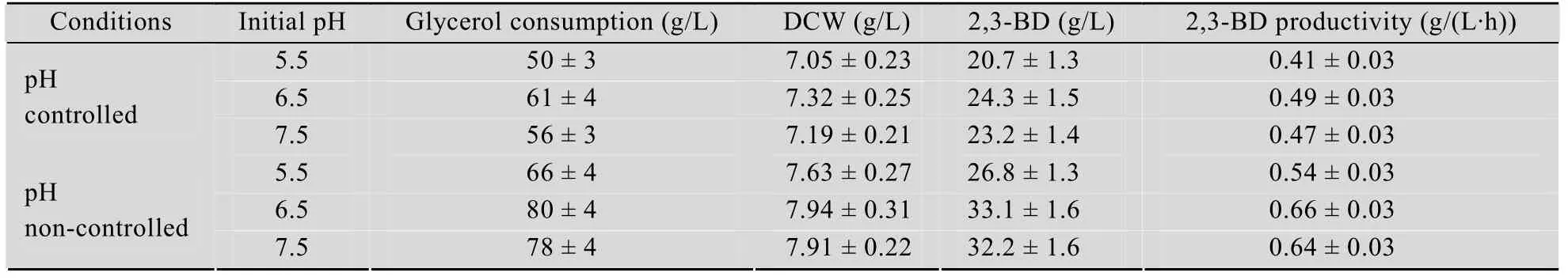
表1 pH对2,3-丁二醇发酵的影响Table 1 Effects of pH on 2,3-BD production
据文献报道[2-3,10],溶氧水平对于提高 2,3-丁二醇的发酵效率和降低乙偶姻等副产物的积累具有重要影响。根据 B. amyloliquefaciens的生理特征,我们提出了一种行之有效的溶氧控制策略。
2.3.1 不同搅拌转速下菌株B10-127 发酵生产2,3-丁二醇的动力学特征
比速率是一个相对速度,它与生物量有密切的关系,比速率用方程组(1)来定义,单位为h–1。m为生长的比速率,qs为底物消耗的比速率,qp为产物形成的比速率。根据m、qs和qp的定义式:
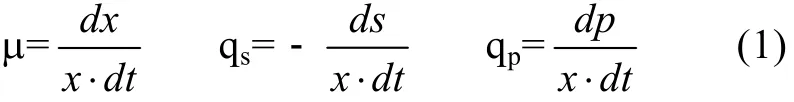
当时间间隔很小时,可以近似用(2)式直接计算得到m、qs和 qp
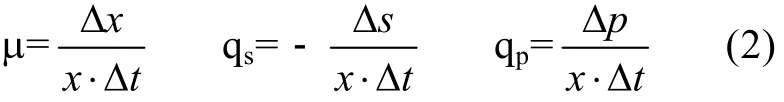
利用Orign 8.0作图软件,对图3(A~C)中的数据进行插值计算(时间间隔为 0.1 h),求解得到发酵过程不同时刻的m、qs和qp;经平滑处理,得到不同搅拌速度下动力学参数曲线(图 3D~F)。综合分析图3A~F可以发现:菌株在不同阶段对氧的需求并不相同,1)在低搅拌转速下菌株的延滞期(0~4 h)较短;2)在较高的搅拌转速下(400 r/min),细胞在发酵前期(4~18 h)具有较高的m、qs和qp,即此阶段,高转速更能促进菌体的生长和底物消耗;3)而18 h以后,在400 r/min条件下(图3D),菌体m逐渐变为负值,此时菌体衰亡速率大于生长速率,菌体量增长缓慢,qp逐渐降至负值,主要原因是菌体衰亡导致发酵液中溶氧升高,2,3-丁二醇开始逆向合成副产物乙偶姻[2]。而在350 r/min条件下,仍能维持较高的m和qp。
2.3.2 分阶段供氧控制模式的提出和实验验证
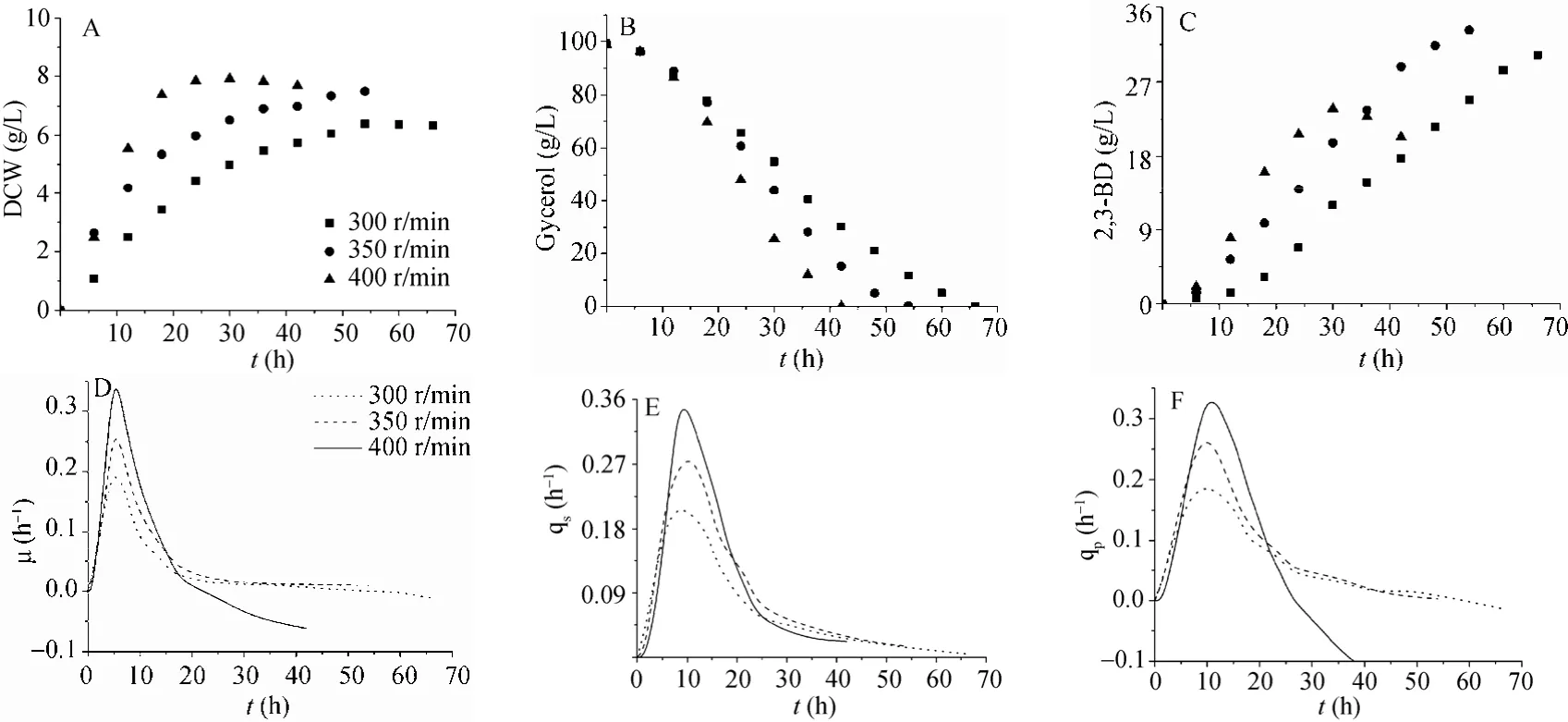
图3 不同搅拌转速下的2,3-丁二醇发酵过程动力学曲线Fig. 3 Comparison of kinetic parameters in 2,3-BD fermentation at different agitation speed.
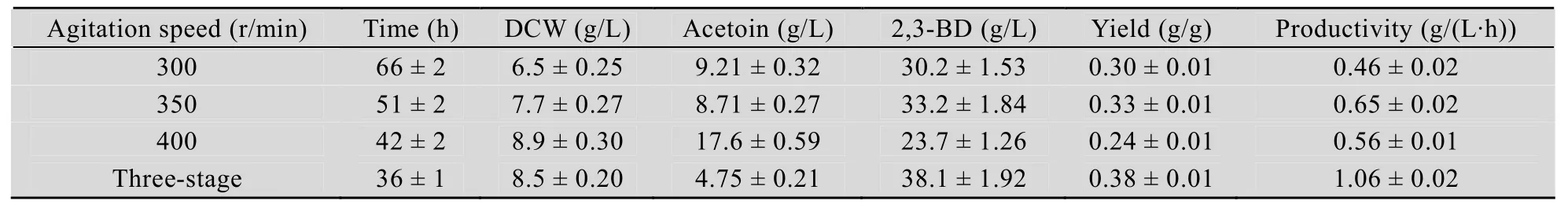
表2 搅拌转速控制策略对2,3-丁二醇发酵的影响Table 2 2,3-BD production at different agitation speed
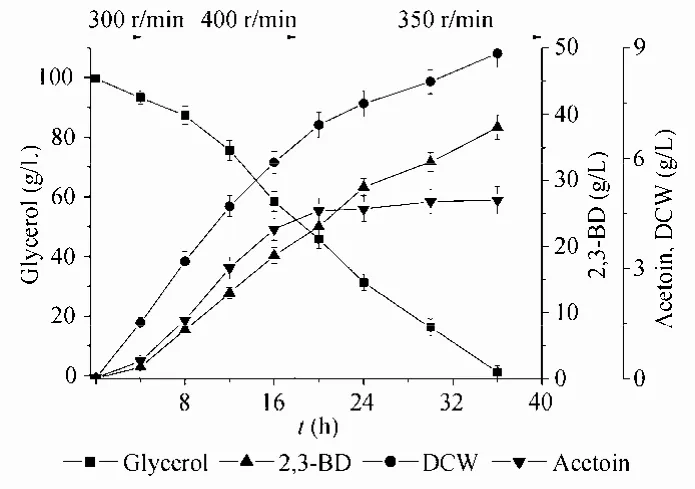
图4 分阶段控制转速条件下发酵过程曲线Fig. 4 Time profiles of 2, 3-BD fermentation using a three-stage agitation speed control strategy.
根据上述分析结果,我们提出了一种三阶段控制转速的模式 (图4),即0~4 h控制转速300 r/min,使菌体快速开始生长,缩短延滞期;在4~18 h,控制转速400 r/min,使其保持较高的m、qs和qp;18 h之后,转速将至 350 r/min,防止细胞过早衰老,保持菌体的持续生长和较高代谢速率。由表 2 可知,采用分阶段供氧控制模式,既能够保持较高的产率(0.40 g/g),又能保持较高的甘油消耗速度(2.78 g/(L·h)),发酵 36 h,2,3-丁二醇产量就达到了38.1 g/L,生产强度(1.1 g/(L·h))比恒定转速 300、350和 400 r/min时分别提高了 130%、63.1%和89.3%,副产物乙偶姻积累量分别降低了48.4%、45.5%和 73.0%。因此,该转速控制模式有利于提高 B. amyloliquefaciens发酵粗甘油生产2,3-丁二醇的产量和效率。
2.4 批式流加发酵生产2,3-丁二醇
补料流加发酵结果如图5所示,发酵72 h,2,3-丁二醇产量达到 71.2 g/L,生产强度达到0.99 g/(L·h)。Petrov 和 Petrova[11]利用 K. pneumoniae通过补料流加发酵,2,3-丁二醇产量达到70 g/L,这是此前报道的利用甘油发酵生产 2,3-丁二醇的最高产量,但其发酵周期长达160 h,生产强度仅为0.44 g/(L·h)。因此,我们的研究结果可以和目前报道的最高产量相媲美。
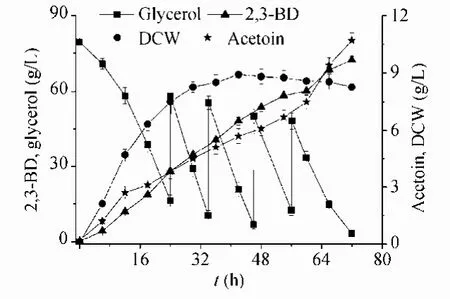
图5 粗甘油批式流加发酵生产 2,3-丁二醇过程曲线Fig. 5 Fed-batch fermentation profiles using a pulse feeding batch strategy.
3 结论
粗甘油可以作为 B. amyloliquefaciens合成2,3-丁二醇的直接底物;发酵过程中菌体通过自身对环境 pH的反馈调节更能促进 2,3-丁二醇的合成;通过三阶段转速调控策略,促进目标产物2,3-丁二醇的合成,减少副产物乙偶姻的积累。通过补料流加实验,2,3-丁二醇产量达到71.2 g/L,生产强度为 0.99 g/(L·h)。本文利用未经预处理的生物柴油副产物粗甘油为底物,为粗甘油的深加工技术开发提供了理论基础。
[1]Liu DH. Preface for special issue on bioenergy. Chin J Biotech, 2013, 29(3): 261−264 (in Chinese).刘德华. 生物能源专刊序言. 生物工程学报, 2013, 29(3):261−264.
[2]Celinska E, Grajek W. Biotechnological production of 2,3-butanediol--current state and prospects. Biotechnol Adv, 2009, 27(6): 715–725.
[3]Ji XJ, Huang H, Ouyang PK. Microbial 2,3-butanediol production: a state-of-the-art review. Biotechnol Adv, 2011,29(3): 351–364.
[4]Da Silva GP, Mack M, Contiero J. Glycerol: a promising and abundant carbon source for industrial microbiology.Biotechnol Adv, 2009, 27(1): 30–39.
[5]Petrov K, Petrova P. High production of 2,3-butanediol from glycerol by Klebsiella pneumoniae G31. Appl Microbiol Biotechnol, 2009, 84(4): 659–665.
[6]De Boer AS, Diderichsen B. On the safety of Bacillus subtilis and B. amyloliquefaciens: a review. Appl Microbiol Biotechnol, 1991, 36(1): 1–4.
[7]Yang TW, Rao ZM, Zhang X, et al. Production of 2,3-butanediol from glucose by GRAS microorganism Bacillus amyloliquefaciens. J Basic Microbiol, 2011, 51(6): 650–658.
[8]Booth I. Regulation of cytoplasmic pH in bacteria.Microbiol Rev, 1985, 49(4): 359–378.
[9]Biebl H, Zeng AP, Menzel K, et al. Fermentation of glycerol to 1,3-propanediol and 2,3-butanediol by Klebsiella pneumoniae.Appl Microbiol Biotechnol, 1998, 50(1): 24–29.
[10]Ji XJ, Huang H, Du J, et al. Enhanced 2,3-butanediol production by Klebsiella oxytoca using a two-stage agitation speed control strategy. Bioresour Technol, 2009,100(13): 3410–3414.
[11]Petrov K, Petrova P. Enhanced production of 2,3-butanediol from glycerol by forced pH fluctuations.Appl Microbiol Biotechnol, 2010, 87(3): 943–949.
