大肠杆菌AFP111菌体回收连续转化生产丁二酸
2013-10-31吴明科刘嵘明梁丽亚马江锋陈可泉姜岷
吴明科,刘嵘明,梁丽亚,马江锋,2,陈可泉,姜岷
1 南京工业大学生物与制药工程学院 材料化学工程国家重点实验室,江苏 南京 211816
2 中国石化扬子石油化工有限公司研究院,江苏 南京 210048
丁二酸,又被称为琥珀酸,是TCA循环的中间产物同时也是厌氧发酵中碳代谢的终端还原性产物之一,作为一种重要的化工原料和中间体,广泛应用于食品、化学和医药工业[1]。相对于化学合成法,生物法[2-5]合成丁二酸由于消耗低、污染小、反应温度等优点,已成为近年来研究的热点[6-7]。
大肠杆菌 AFP111是有氧-厌氧两阶段生产丁二酸的潜力菌株[8]。Vemuri等[9]研究了有氧转厌氧时间节点对菌体产丁二酸的影响,姜岷等[10]通过有氧阶段碳限制策略提高细胞活力,使AFP111产丁二酸量达到101.2 g/L。但是,随着厌氧发酵时间的延长,菌体的活力不断降低[11],菌体的产酸速率也不断下降。Andersson等[12]在发酵过程中通过去除产物丁二酸来保持菌体的高产酸能力,结果表明整个 100 h的厌氧发酵过程中丁二酸产量提高达60%以上。然而丁二酸生产效率明显降低。文中通过有氧诱导回收的菌体细胞,提高菌体转化后的产酸能力,进一步提高转化过程中丁二酸的产量及生产效率。
1 材料与方法
1.1 菌株
大肠杆菌 Escherichia coli AFP111 [F+λ-rpoS396 (Am)rph-1 △(pflAB::Cam)ldhA::Kan 95ptsG]由 David P.Clark 教授 (Southern Illinois University)惠赠。
1.2 方法
1.2.1 种子培养基
有氧摇瓶培养基:蛋白胨 10 g/L,酵母粉5 g/L,NaCl 5 g/L,pH 7.0,氯霉素添加量为25 µg/mL,硫酸卡那霉素添加量 30 µg/mL。
JSM培养基参考文献[13]。
血清瓶培养基:JSM培养基如前所述。JSM-P培养基为在JSM培养基中去除磷酸盐,JSM-N培养基为JSM培养基中去除铵盐,JSM-T培养基为在JSM培养基中去除微量元素,JSM-B培养基为在JSM培养基中去除生物素和VB1,BM培养基为只含无菌水培养基。
1.2.2 种子培养
将保存于–80 ℃冻存管中的菌株以1%的接种量转接到装液量为 5 mL的试管中,37 ℃、200 r/min过夜培养后,以1%的接种量接种到装液量为100 mL的500 mL摇瓶中,37 ℃、200 r/min培养6 h。
1.2.3 发酵罐培养
将种子液以10%的接种量接入装有3 L发酵培养基的 7.5 L发酵罐 (BioFlo 110 fermenter;New Brunswick ScientificCo., Edison, N.J.),初糖浓度为30 g/L,12.5%的氨水调节pH 6.8, 37 ℃有氧培养至初糖耗尽,流加800 g/L葡萄糖,控制菌体的相对生长速率为0.7 h–1至OD600=60;厌氧阶段,无菌过滤条件下通二氧化碳气体,通气量0.5 L/min,25%的 Na2CO3调节 pH 6.6,厌氧发酵 60 h。
1.2.4 细胞离心回收与转化发酵
两阶段发酵结束,收集发酵液,离心(5 000 r/min,10 min,4 ℃)获得细胞,用双蒸水悬浮后转入发酵罐进行转化实验。有氧诱导3 h后,厌氧发酵条件同上。
1.3 分析
细胞生物量OD600,菌体干重,葡萄糖浓度,有机酸浓度参考文献[14],酶活参考文献[15]。
2 结果
2.1 转化培养基的优化
有氧-厌氧两阶段生产丁二酸时,有氧阶段使用JSM培养基主要提供菌体生长所需营养元素,用于菌体细胞生长,而在厌氧转化过程中,菌体主要利用葡萄糖进行厌氧发酵产酸,菌体密度不会增长[9],JSM 培养基中成分更多起到缓冲盐作用。因此,优化转化培养基成分对菌体产酸以及发酵成本降低是十分重要的。
由表1可知,发酵整个过程BM培养基中菌体DCW降低最大,达到1.6 g/L,其余培养基中菌体DCW变化较小。各个组分的培养基中菌株耗糖,副产物乙酸量相差不大。当 BM 培养基为发酵培养基时,丁二酸得率最高,达到 93%,且单位细胞生产率相比于JSM培养基只降低了0.9%,所以采用BM培养基作为转化后培养基。
2.2 有氧诱导时间对菌体转化的影响
随着转化次数的增加,菌体的产酸速率逐渐降低,而通过空气进行有氧诱导可以部分恢复菌体中一些关键酶如异柠檬酸裂解酶[15-16]等活力,以利于菌体进行下一次转化过程产酸。故进行了0 h、1 h、3 h和5 h 四个不同有氧诱导时间梯度对菌体产酸的考察。由图1表明,在0~3 h范围内,菌体净产酸量 (去除厌氧开始时残留的丁二酸量)和总产酸量随着有氧诱导时间的增长而增加,而继续提高有氧诱导时间至 5 h并没有继续增加菌体产酸的能力,故选择3 h为最佳有氧诱导时间。
由表2可知,3 h诱导后磷酸烯醇式丙酮酸羧化酶 (PPC),苹果酸脱氢酶 (MDH)酶活相较于无诱导条件下分别提高了 31%和 46%,有利于还原性TCA循环支路产丁二酸,而异柠檬酸裂解酶 (ICL)酶活增加了7倍,表明乙醛酸途径得到了加强,从而有利于丁二酸的生成,使丁二酸的产量提高。
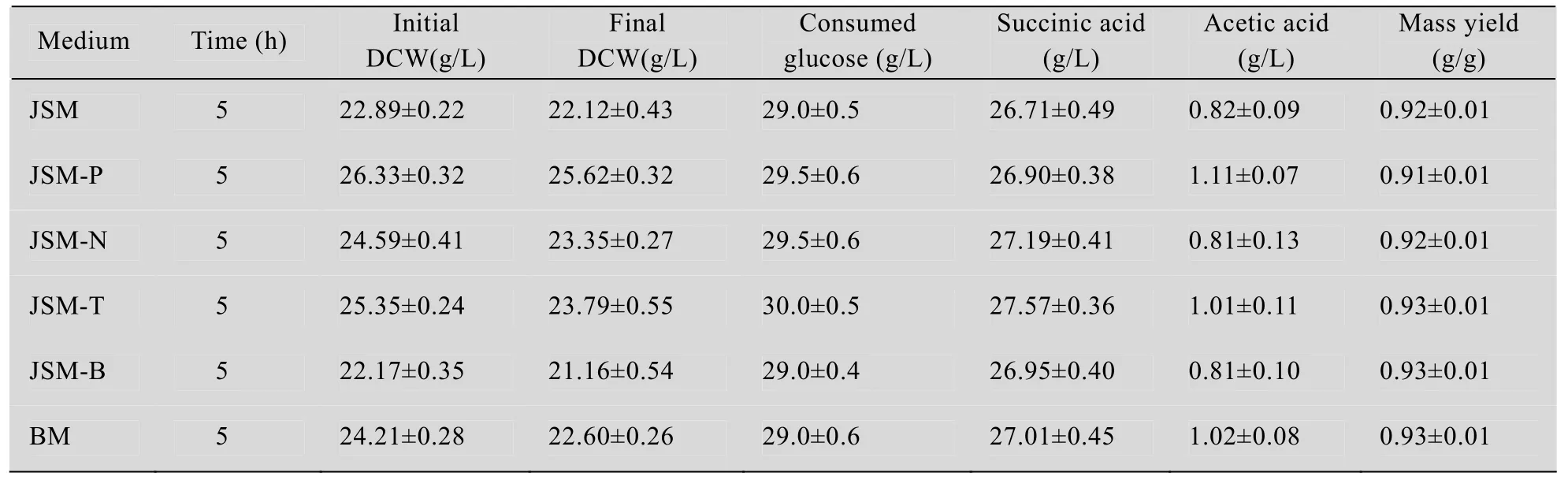
表1 厌氧血清瓶发酵后参数的测定结果Table 1 Results of these parameters on anaerobic fermentation in sealed bottles
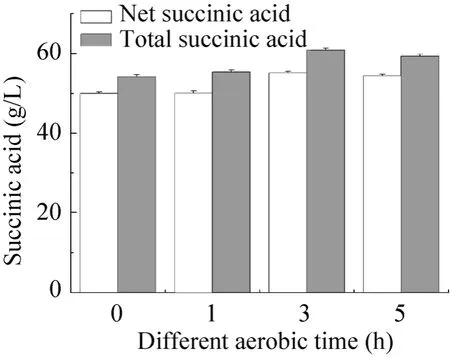
图1 不同有氧诱导时间对菌体产酸的影响Fig. 1 Effect of different aerobic time on the final succinic acid concentration. Net succinic acid equals final succinic acid concentration minus initial succinic acid concentration;total succinic acid equals final concentration.
2.3 连续转化发酵
发酵罐厌氧发酵 60 h,丁二酸产量达到68.01 g/L,单位生产率为112.88 mg/(g·h)。此时通过离心收集菌泥,用无菌水洗涤稀释OD600至60进行有氧诱导,结束后开始重新发酵。由表3可知,重新发酵后丁二酸产量分别为55.9 g/L和45.6 g/L,单位菌体的生产速率分别为92.84 mg/(g·h)和 76.30 mg/(g·h)。整个过程 (菌体有氧生长时间计算在内)产酸速度达到0.81 g/(L·h),相比于无有氧诱导条件下发酵时的产酸速度0.72 g/(L·h)提高了13%,总产量提高了19 g/L。
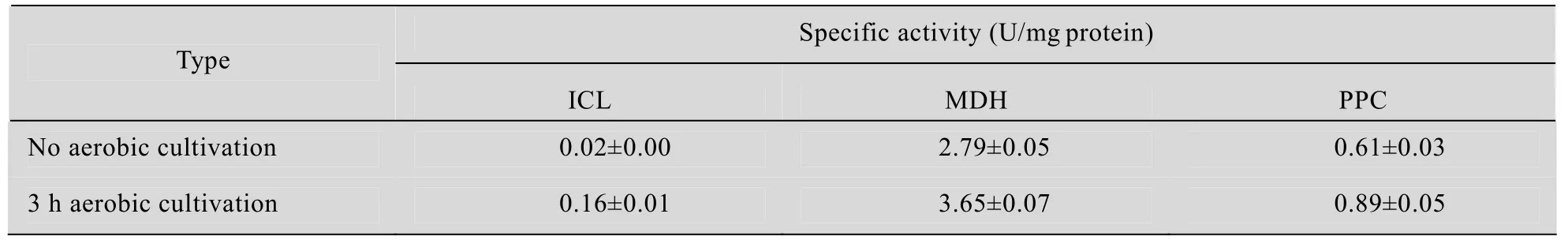
表2 厌氧发酵开始时酶活的测定Table 2 Enzyme activities of cells at the beginning of anaerobic succinate production
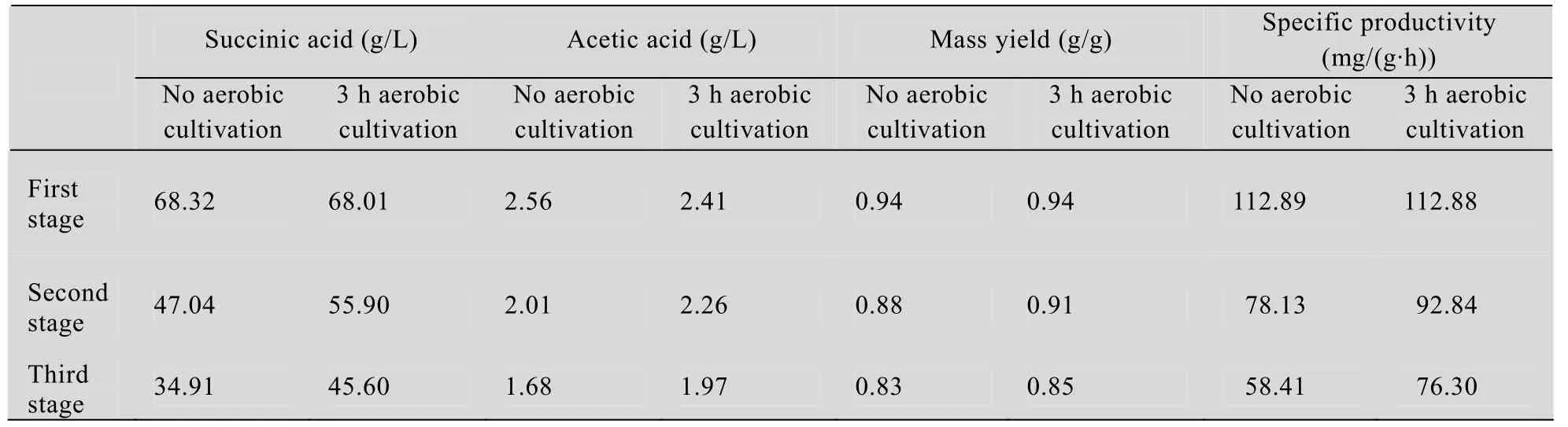
表3 发酵结果各参数的测定Table 3 Result of parameters on anaerobic fermentation
[1]Willke T, Cukalovic KD. Industrial bioconversion of renewable resources as an alternative to conventional chemistry. Appl Microbiol Biotechnol, 2002, 66(2):131–142.
[2]Lee PC, Lee SY, Hong SH, et al. Batch and continuous cultures of Mannheimia succinicproducens MBEL55E for the production of succinic acid from whey and corn steep liquor. Bioprocess Biosyst Eng, 2003, 26(1): 63–67.
[3]Clark DP. The fermentation pathways of Escherichia coli. FEMS Microbiol Rev, 1989, 63(3): 223–234.
[4]Yuzbashev TV, Yuzbasheva EY, Sobolevskaya TI, et al.Production of succinic acid at low pH by a recombinant strain of the aerobic yeast Yarrowia lipolytica.Biotechnol Bioeng, 2010, 107(4): 673–682.
[5]Lee PC, Lee WG, Lee SY, et al. Fermentative production of succinic acid from glucose and corn steep liquor by Anaerobiospirillum succiniciproducens. Biotechnol Bioprocess Eng, 2000, 5(5): 379–381.
[6]Cukalovic A, Stevens CV. Feasibility of production methods for succinic acid derevatives: a marriage of renewable resources and chemical technology. Biofuels Bioprod Biorefin, 2008, 2(6): 505–529.
[7]Song H, Lee SY. Production of succinic acid by bacterial fermentation. Enzyme Microb Technol, 2006,39(3): 352–361.
[8]Vemuri GN, Eiteman MA, Altman E. Effects of growth mode and pyruvate carboxylase on succinic acid production by metabolically engineered strains of Escherichia coli. Appl Environ Microbiol, 2002, 68(4):1715–1727.
[9]Vemuri GN, Eiteman MA, Altman E. Succinate production in dual-phase Escherichia coli fermentations depends on the time on transition from aerobic to anaerobic conditions.J Ind Microbiol Biot, 2002, 28(6): 325–332.
[10]Jiang M, Liu S, Ma J, Chen K, et al. Effect of growth phase feeding strategies on succinate production by metabolically engineered E. coli. Appl Environ Microbiol, 2010, 76(4): 1298–1300.
[11]Warnecke T, Gill RT. Organic acid toxicity, tolerance,and production in Escherichia coli biorefining applications. Microb Cell Fact, 2005, 4: 25.
[12]Andersson C, Petrova E, Berglund K, et al. Maintaining high anaerobic succinic acid productivity by product removal. Bioprocess Biosyst Eng, 2010, 33(6): 711–718.
[13]Lu S, Eiteman MA, Altman E. Effect of CO2on succinate production in dual-phase Escherichia coli fermentation. J Biotechnol, 2009, 143(3): 213–223.
[14]Liu RM, Ma JF, Liang LY, et al. Effect of overexpression of nicotinic acid phosphoribosyl transferase on succinic acid production in Escherichia coli NZN111. Chin J Biotech, 2011, 27(10): 1438–1447(in Chinese).刘嵘明, 马江峰, 梁丽亚, 等. 过量表达烟酸转磷酸核糖激酶对大肠杆菌 NZN111产丁二酸的影响. 生物工程学报, 2011, 27(10): 1438–1447.
[15]Wu H, Li ZM, Li Z, et al. Improved succinic acid production in the anaerobic culture of an Escherichia coli pflB ldhA double mutant as a result of enhanced anaplerotic activities in the preceeding aerobic culture.Appl Microbiol Bitotechnol, 2007, 73(24): 7837–7843.
[16]Wui H, Li ZM, Zhou L, et al. Enhanced anaerobic succinic acid production by Escherichia coli NZN111 aerobically grown on gluconeogenic carbon sources.Enzyme Microb Technol, 2009, 44(3): 165–169.
