小麦芽脂肪酶酶学性质以及制麦过程的酶活变化
2013-10-30王聪杜金华张开利金玉红
王聪,杜金华,张开利,金玉红
1(山东农业大学食品学院,山东 泰安,271018)
2(山东泰山啤酒有限公司,山东 泰安,271000)
脂肪酶(Lipase,EC3.1.1.3)是一种重要的水解酶类[1]。在植物中,大多数脂肪酶是作为能量储备在种子里[2]。Sullivan 和Howe 在1933 年第1 次发现在小麦种子里存在脂肪酶[3]。作为麦粒的重要组成部分,麸皮和胚芽中都含有脂肪酶,并且未发芽的种子里的脂肪酶酶活比发芽的种子里低[4]。
在糖化过程中,小麦芽中的脂肪氧化酶(Lox)会催化糖化醪中解离出来的游离亚油酸、亚麻酸以及其他具有顺,顺-1,4-戊二烯结构的多元不饱和脂肪酸以及这些酸的甘油酯[5],生成氢过氧化脂肪酸,氢过氧化脂肪酸进一步反应生成单羟基、双羟基和三羟基十八碳烯酸等羟基不饱和脂肪酸,三羟基十八碳烯酸被认为是反-2-壬烯醛的前体[6],而反-2-壬烯醛具有纸板味,是产生啤酒老化风味的主要物质[7-8]。而脂肪氧化酶的底物主要是小麦芽中的脂肪酶水解原料中甘油酯而来。因此,小麦芽中的脂肪酶是导致啤酒产生老化物反-2-壬烯醛的源头。目前,小麦芽已经广泛作为酿造啤酒的原料,了解小麦芽中脂肪酶的变化,从而找到合理的方法抑制脂肪酶的酶活,对小麦啤酒的发展具有重要意义。
1 材料与方法
1.1 主要试验材料与试剂
小麦(鲁麦21);Tris(Scientific research special);HCl(莱阳市康德化工有限公司);Na2HPO4、NaH2PO4,天津巴斯夫化工有限公司;曲拉通X-100,Sigma;对硝基苯酚丁酸酯,青岛沃克化工有限公司。
1.2 仪器
EBC-LF 麦芽标准粉碎机,北京德之杰公司;LRH-250-A 生化培养箱,广东省医疗器械厂;AL204电子天平,梅特勒-托利多有限公司;101A 电热鼓风干燥箱,黄骅市卸甲综合电器厂;UV-2100 型紫外可见分光光度计,上海尤尼柯仪器有限公司;2004-21(501)数显水浴锅,国华电器;DS-8510DTH 超声波清洗器,上海生析超声仪器有限公司;TGL-16M 高速台式冷冻离心机,湘仪离心机。
1.3 试验方法
1.3.1 小麦制麦工艺
参照Jin et al 的方法[9],小麦芽的糖化与分析参照QB/T 1686 -2008。
成品小麦芽指标:水分6.62%,糖化时间4 min,色度5.96EBC,浊度2.69EBC,黏度1.51cP,pH5.99,酸度0.93,氨基氮147.46 mg/L,库值35%。
1.3.2 脂肪酶酶活测定
1.3.2.1 粗酶提取
成品麦芽磨碎,磨筛孔0.2 mm[10]。取5g 磨碎麦芽(0.000 1 g)转入100 mL 容量瓶中,加入50 mL 50 mmoL/L Tris-HCL(pH 7.0),在冰浴中放置15 min,期间间歇摇动。溶液转入50 mL 离心管中,在10 000 r/min、4℃[10]下离心10 min[11]。上清液经0.22 μm 滤膜过滤转入10mL 容量瓶中并贮存于4℃的冰箱中[10]。
1.3.2.2 底物溶液制备
50 mmoL/L 对硝基苯酚丁酸酯储备液的制备[12]略有改动:将88 μL 对硝基苯酚丁酸酯加到10 mL 容量瓶中,用乙腈定容。
2 mmoL/L 对硝基苯酚丁酸酯的制备:取4 mL 储备液于100 mL 容量瓶中,用含0.4% TritonX-100 的蒸馏水定容(现用现配储于棕色瓶)。
1.3.2.3 酶分析
200 μL 粗酶液加到比色管中,加入4 600 μL 50 mmoL/L Tris-HCl 缓冲液(pH8.0)在37℃循环水浴中保温5 min,再加入200 μL 底物溶液,反应30 min,煮沸3 min 终止反应,空白为加底物之前煮沸3 min,8 000 r/min 离心5 min 后,410 nm 测定吸光值A1;对照为4 800 μL tris-HCl 缓冲液在37℃循环水浴中保温5 min,再加入200 μL 底物溶液,反应30 min,反应后煮沸3 min,以不煮沸的作为空白,8 000 r/min 离心5 min,410n m 测定吸光值A2。即A(吸光值的变化)=A1-A2。
1.3.2.4 计算与结果表达
脂肪酶酶活单位表示为:1g 干麦芽(每mL 麦汁)每分钟在410nm 处增加吸光值0.1 为1 个酶活单位,有改动[10]。计算公式如下:

式中:A,酶反应在410nm 处的吸光值变化;30,酶反应时间,min;m,提酶所需麦芽粉的质量,g;50 000,提酶所需缓冲液的体积,μL;200,反应所需酶浸出液的体积,μL;m1,麦芽的含水量,g/g;1 000,麦汁的体积,μL。
1.3.3 酶学性质的研究
1.3.3.1 最适温度的确定
分别将上述1.3.2(3)中的温度改为25、30、35、37、40、45 ℃,测定脂肪酶的酶活,找到其最适温度。
1.3.3.2 最适pH 值的确定
分别将上述1.3.2(3)中的pH 值改为6.0、6.5、7.0、7.5、8.0、8.5、9.0,测定脂肪酶的酶活,找到其最适pH。
1.3.3.3 温度对酶稳定性的影响
(1)分别将粗酶液贮藏在30、35、40、45、50、55、60、65、70 ℃下保温10 min 后,在冰水浴中迅速冷却,10 000 r/min、4 ℃下离心10 min,上清液即为粗酶液,在脂肪酶的最适温度和pH 下测定酶活。
(2)分别将粗酶液贮藏在35、45、55 ℃下60 min,每10 min 取样测定,65、70 ℃每1 min 取样测定酶活。
1.3.3.4 pH 对酶稳定性的影响
(1)分别向200 μL 粗酶液中加入800 μL 不同pH 的缓冲液(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5),在37 ℃下保温10 min 后再加入pH8.0 的缓冲液3 800 μL 和200 μL 底物,测定脂肪酶的酶活。
(2)分别向200 μL 粗酶液中加入800 μL pH 为5.5、6.0 的缓冲液,在37 ℃下保温90 min,期间每10 min 加入pH8.0 的缓冲液3 800 μL 和200 μL 底物,测定脂肪酶的酶活。
1.3.3.5 金属离子对脂肪酶稳定性的研究
分别向酶液中加入金属离子(Cu2+、Ca2+、Mn2+、Fe3+、Al3+、Mg2+、Ba2+、Fe2+)和EDTA 的储备液,使金属离子的终浓度达到2 mmoL/L,将酶液在37 ℃保温10 min 后,在最适温度及pH 值下测定脂肪酶的酶活。
1.3.3.6 小麦芽不同部位脂肪酶的测定
将干燥好的成品麦芽置于铁丝筛网中,轻轻揉动,将麦芽的根收集,测定胚根的酶活;待根完全去除后,加大揉动力度,使胚芽分离,收集用于测定胚芽的酶活;剩余部分为籽粒的酶活。
1.3.3.7 EBC 糖化麦汁酶液的提取
用一次性注射器在不同时间点(55 min 内每隔5 min 取样)从糖化醪中取出2 mL 糖化液,冰水浴冷却,10 000 r/min 离心5 min,上清液即为粗酶液。
1.3.4 数据处理
文中实验结果为3 次平行试验的平均值。采用dps7.05 数据处理软件进行数据分析。差异性采用Turkey 法进行多重比较,置信水平95%(P=0.05)。具有相同字母表示两者无显著差异(P>0.05),没有相同字母表示两者存在显著性差异(P<0.05),字母顺序按均值大小排列。
2 结果与分析
2.1 脂肪酶最适反应温度的确定
从图1 可以看出,脂肪酶在25 ~37 ℃,随着温度的上升酶活变高,到37℃时,酶活达到最大;37 ~45℃,随着温度的上升酶活变低;37℃的酶活与其他温度下的有显著性差异。因此,37℃为其最适反应温度。

图1 酶反应温度曲线Fig.1 Enzyme reaction temperature curve
2.2 脂肪酶最适反应pH 的确定
从图2 可以看出,脂肪酶在pH6.0 ~8.0 时,随着pH 的增大酶活增大,在pH 为8.0 时,达到最大酶活。在pH8.0 ~9.0 时,随着pH 的增大酶活变小,pH8.0 时的酶活与其他pH 下的有显著性差异。因此,pH8.0 是最适反应pH。

图2 酶反应pH 曲线Fig.2 Enzyme reaction pH curve
2.3 温度对脂肪酶稳定性的影响
2.3.1 不同温度对脂肪酶稳定性的影响
从图3 可以看出,随着保温温度的上升,酶活在逐渐降低,30 ℃与空白(4 ℃)并无明显差异,说明脂肪酶在10 min 内,30 ℃以下,随温度的上升酶的失活并无明显变化,35℃以上随着温度的上升,除45、50℃2 点无明显差异外,酶的失活明显,在60 ℃时10 min 后酶活仅仅为空白的21.00%,65 ℃下保温10 min 后,酶已经失活,这说明脂肪酶并不耐高温。
2.3.2 保温时间对脂肪酶稳定性的影响
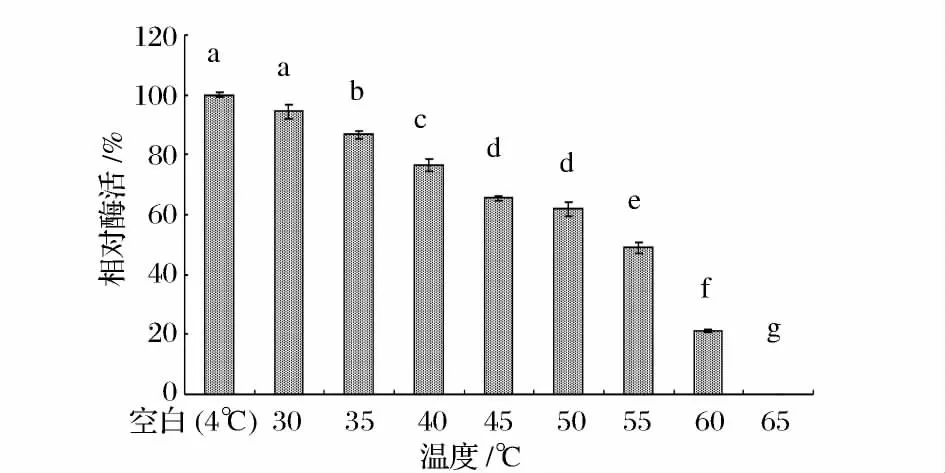
图3 不同保温温度条件下酶活变化Fig.3 Enzyme activity change under different temperature condition
从图4 可以看出,35 ℃下保温1 h 酶的失活并不大,降为原来的88.37%。如果麦汁糖化在35 ℃下停留,对于啤酒是不利的,停留时间越长,脂肪酶酶解脂类产生的不饱和脂肪酸如亚油酸、亚麻酸的含量就会越多,麦汁中的脂肪氧化酶会将这些具有顺顺1,4戊二烯结构的不饱和脂肪酸降解产生三羟基十八碳烯酸,三羟基十八碳烯酸又会进一步分解成反-2-壬烯醛,反-2-壬烯醛被认为是导致啤酒产生纸板味的老化物质。脂肪酶在45 ℃下酶活下降比较明显,保温60 min 后酶活只占空白的46.81%;55 ℃下,脂肪酶的失活非常迅速,并且不同时间点的酶活有显著性差异,在60 min 时,酶活降为0u/g;65 ℃与70 ℃下,脂肪酶失活更为迅速,65 ℃下,1 min 后酶活就降至12.61%,6 min 左右就已经失活;70 ℃下,1 min 后酶活就降至9.09%,5 min 左右就已经失活。
2.4 pH 值对脂肪酶稳定性的影响
2.4.1 不同pH 值对脂肪酶稳定性的影响
从图5 可以看出,脂肪酶在不同的pH 环境中稳定性不同。以在不同pH 条件下保存后,酶活最高点为100%作图,脂肪酶在pH 5.5 以及6.0 下,酶活没有显著性差异。因此,脂肪酶在pH 5.5 和6.0 下最为稳定;在pH 8.5 条件下最不稳定。
2.4.2 pH 值随时间对脂肪酶稳定性的影响
从图6 可以看出,在pH 值5.5 和6.0 条件下,酶在37℃下保存60 min,酶活分别下降至初始值的95.11%和91.11%,失活并不严重,由于麦芽在糖化过程中,麦汁的pH 处在5.5 ~6.0,此pH 下对脂肪酶的破坏力较小,因此,糖化过程的pH 条件对脂肪酶稳定性影响不大。
2.5 金属离子对脂肪酶的影响
从表1 可以看出,Fe3+对脂肪酶有强烈的抑制作用,可以使脂肪酶的酶活降至54.95%;Cu2+、Mn2+、Al3+对脂肪酶的抑制作用较小,分别降为80.68%、92.77%和89.74%;Fe2+、Mg2+、Ba2+对脂肪酶的抑制作用无显著性差异;Ca2+、EDTA 对脂肪酶有强烈的激活作用,分别上升至106.41%和110.53%。

图4 温度对酶活的影响Fig.4 Influence of temperature with enzyme activity

图5 pH 对酶活的影响Fig.5 Influence of pH with enzyme activity

表1 金属离子对酶活的影响Table 1 Influence of metal ion with enzyme activity

金属离子(2 mmoL/L) 脂肪酶的相对酶活/%Mg2+ 104.21 ±0.84 bc Al3+ 89.74 ±0.79d Ca2+ 106.41 ±0.32ab Ba2+ 102.38 ±0.69bc EDTA 110.53 ±2.46 a
2.6 发芽过程中脂肪酶酶活的变化
从图7 可以看出,原麦中的脂肪酶酶活为2.17 u/g,小麦在浸麦结束后,麦芽的脂肪酶变化没有明显差异,但在发芽开始后酶活明显增加,从第1 ~4 天,酶活逐渐上升,到第4 天达到最大值,分别为1.77、3.00、4.15、6.15 和8.52 u/g。第5 天酶活开始下降,第5 ~6 天的酶活下降并不明显,分别为6.50 u/g 和6.39 u/g。干麦芽的酶活下降主要是高温干燥导致麦芽中部分脂肪酶变性失活,失活率为27.06%,酶活降为4.66 u/g。
2.7 小麦芽中不同部位的脂肪酶酶活变化

图6 pH5.5 和6.0 对酶活的影响Fig.6 Influence of pH 5.5 and pH 6.0 with enzyme activity
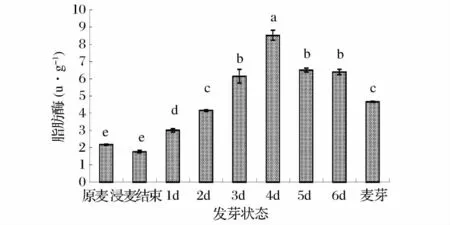
图7 发芽过程中的酶活变化Fig.7 Enzyme activity change in the process of germination
从图8 可以看出,小麦芽不同部位脂肪酶的酶活有显著性差异,麦芽籽粒的酶活最大为8.01 u/g,其次胚芽为7.55 u/g,最后胚根为6.83 u/g。胚根在绿麦芽干燥之后去除,对麦芽的糖化不会产生任何影响,麦芽中籽粒和胚芽的存在会由于其含有脂肪酶而对麦芽的糖化产生不利的影响。

图8 小麦芽不同部位的酶活变化Fig.8 Enzyme activity change in different parts of wheat malt
2.8 协定糖化过程中脂肪酶酶活的变化
从图9 可以看出,对去除和未去除胚芽的小麦芽进行糖化,比较糖化过程中麦汁脂肪酶的酶活,发现去除胚芽的小麦芽在糖化过程中,脂肪酶的酶活一直比有胚芽的高。不管有没有去除胚芽,在糖化开始不久,酶活都有一个先上升后下降的过程,这主要是因为刚开始脂肪酶没有完全溶出,随着糖化时间的延长,脂肪酶逐渐溶出,酶量逐渐增加,其增加量大于失活量,因此,酶活不断增加;随后出现下降是因为酶量已经不再增加或者增加量小于失活量。没有去除胚芽的小麦芽在糖化过程中,麦汁中的脂肪酶的酶活在45 min(60℃)前下降比较缓慢,45 min 时脂肪酶的失活率仅仅为25.58%;从45 min 到55 min(70℃),脂肪酶失活比较明显,失活率为89.99%。去除胚芽的小麦芽在糖化过程中,麦汁中的脂肪酶下降比较明显,到55 min 时,酶活已经降为0 u/mL。

图9 协定糖化过程中的酶活变化Fig.9 Enzyme activity change in the process of standard saccharification
3 结论
(1)小麦芽脂肪酶最适温度为37℃;最适pH 为8.0;4 ~35 ℃脂肪酶的热稳定性较好,35 ℃、45 ℃下保温60 min 其活力仍保持率分别为88.37% 和46.81%,55 ℃保温60 min 酶失活;pH 5.5 和6.0 对脂肪酶的破坏力相对较小,保温60 min 其活力仍可分别保持在95.11%和91.11%;Fe3+对脂肪酶有较强的抑制作用;Cu2+、Mn2+、Al3+对脂肪酶的抑制作用较小;Fe2+、Mg2+、Ba2+对脂肪酶的抑制作用无显著性差异;Ca2+、EDTA 对脂肪酶有较强的激活作用。
(2)小麦芽在发芽的第4 天酶活达到最大值,为8.52 u/g,随后酶活下降,干燥会破坏部分脂肪酶的酶活,损失为27.06%。小麦芽不同部位脂肪酶的酶活有显著性差异,麦芽籽粒的酶活最大为8.01 u/g,其次胚芽为7.55 u/g,最后胚根为6.83 u/g。
(3)EBC 麦汁糖化过程中无胚芽麦芽的脂肪酶酶活比含胚芽的低,并且酶的失活速度也比较大,在55 min(70 ℃)时,脂肪酶会完全失活。
[1] 夏小乐,杨博,王永华,等. 小麦胚芽脂肪酶的研究进展[J]. 现代食品科技,2008,24(10):1 068 -1 070.
[2] Kishore J Patil,Manojkumar Z Chopda,Raghunath T.Mahajan. Lipase biodiversity[J]. Indian Journal of Science and Technology,2011,4(8):971 -982.
[3] Drapron R,N’Guyen Xuan Anh,Launay B,et al. Development and Distribution of wheat Lipase activity during the course of germination[J]. Cereal Chemistry,1969,46:647-655.
[4] Devin J R,Oscar A P. A simple method to measure lipase activity in wheat and wheat bran as an estimation of storage quality[J]. J. Am. Oil Chem. Soc,2006,83(5):415 -419.
[5] Hirota N,Kuroda H,Takoi K,et al. Brewing performance of malted lipoxygen ase-1 null barley and effect on the flavor stability of beer[J]. Cereal chem,2006,83(3):250 -254.
[6] Naoyuki kobayashi,Hirotaka kaneda,Hisao,et al. Behavior of mono-,di-,and trihy drox yoctadecenoic acids during mashing and methods of controlling their production[J].Journal of Bioscience and Bioenflineering,2000,90(1):69-73.
[7] Delphine Callemien,Sebastien Dasnoy,Sonia Collin.Identification of a stale-Beer-like odorant in extracts of naturally aged beer[J]. J. Agric. Food Chem,2006,54(4):1 409-1 413.
[8] Bart Vanderhaegen,Hedwig Neven,Hubert Verachter,et al. The chemistry of beer aging-critical review[J]. Food Chemistry,2006,95:357 -381.
[9] Jin Y H,Zhang K L,Du J H. Effects of wheat protein content on endosperm comp osites and malt quality[J]. J Inst Brew,2008,114(4):289 -293.
[10] Sovrano S,Buiatti S,Anese M. Influence of malt browning degree on lipoxygenase activity[J]. Food Chemistry,2006,99(4):711 -717.
[11] Jin X l,Harasymow S,Bonnardeaux Y,et al. QTLs for malting flavour component associated with pre-harvest sprouting susceptibility in barley (Hordeum vulgareL. )[J]. Journal of Cereal Science,2011,53(2):149 -153.
[12] Ejaz Ahmad,Sadaf Fatima ,Mohd Moin Khan,et al.More stable structure of wheat germ Lipase at low pH than its native state[J]. Biochimie,2010,92(7):885 -893.
