微波辅助提取梵净山阳荷多糖的工艺优化*
2013-10-30陈仕学沈家国陈波王大忠张廷海
陈仕学,沈家国,陈波,王大忠,张廷海
(铜仁学院生物科学与化学系,贵州 铜仁,554300)
阳荷(Zingiber strioatum),又名洋姜、山姜、野山姜等,属于姜科姜属多年生草本植物。阳荷是一种营养价值很高、食药同源的膳食纤维蔬菜,富含蛋白质、氨基酸和丰富的膳食纤维多糖类物质[1]。其多糖具有极其重要的生理功能,如降血脂、延缓衰老、抗肿瘤等功效。目前对阳荷的研究主要有色素和蛋白质的提取研究,而对阳荷多糖的提取研究未见报道,原因是多糖的结构组成非常复杂,提取分离十分困难,所以选择一种合适的提取分离方法对阳荷多糖的研究具有重大意义[2]。本研究采用微波法辅助提取阳荷多糖,为进一步开发利用本地野生阳荷及后续研究提供依据。
1 材料与方法
1.1 材料、试剂与仪器
材料:野生阳荷,将采于梵净山附近林中的野生阳荷,洗净,切碎,晒干,置于60℃烘箱干燥,室温密封保存备用。
试剂:NaOH 固体,天津市大茂化学试剂厂;Cu-SO4,广东汕头市西陇化工厂;无水乙醇、95%乙醇,天津市富宇精细化工有限公司;蒽酮 国药集团化学试剂有限公司;葡萄糖 天津市恒兴化学试剂制造有限公司;盐酸、浓硫酸、遵义师范学院化工试剂厂,以上试剂均为国产分析纯;水为二重蒸馏水。
仪器:T6 新世纪型紫外分光光度计,北京普析通用仪器有限责任公司;MM823EC8-PS(X)型美的微波炉,佛山市顺德区美的微波电器制造有限公司;101-3 型电热鼓风干燥箱,北京科伟永兴仪器有限公司;SHZ-D(Ⅲ)型循环水式真空泵,巩义市予华仪器有限责任公司;AR124CN 型电子天平,奥豪斯仪器上海有限公司;80-2 型离心沉淀机,江苏金坛市中大仪器厂。
1.2 实验方法[3-4]
选材→烘干→脱脂→烘干→粉碎→过筛→加浸提剂搅匀→微波处理→过滤→滤液浓缩→除蛋白→离心取滤液→脱色→无水乙醇沉淀→静置12h→过滤→干燥
将已烘干的阳荷干品在常温下用5 倍体积的乙酸乙酯浸泡3h,用蒸馏水清洗残留的有机溶剂至样品无味,将其置于60℃的烘箱内烘干,得脱脂样品。在脱脂样品中加入浸提剂,适当条件下微波处理,将样品过滤,取滤液水浴浓缩至1/2 体积。用Sevag[V(三氯甲烷)∶V(正丁醇)=4∶1]试剂除蛋白,离心去沉淀,向滤液加入4%H2O2溶液除色素。并加入4倍体积无水乙醇室温静置12h,将沉淀物置于70℃干燥箱中干燥,平行实验3 次,求平均值,计算多糖的提取率。
数据处理和图表绘制用Microsoft Excel2003 和SPSS16.0 进行进行,平行实验3 次,取平均值。
1.2.1 样品溶液的制备
准确称取经过干燥的阳荷(粉碎后过20 目筛)1.000 0 g,置于100 mL 锥形瓶中,加入一定量的蒸馏水,用微波法对其进行多糖提取,在常温下过滤,取滤液1 mL,加入5 mL 无水乙醇,摇匀,静置24 h,3 000 r/min 离心20 min,去上清液,滤渣用2 mol/L H2SO4溶液溶解后,加水定容至10 mL,摇匀,备用。
1.2.2 葡萄糖标准溶液和蒽酮-硫酸试剂的配制
葡萄糖标准溶液配制:精密称取105℃下干燥至恒重的葡萄糖标准品10 mg,置于100 mL 容量瓶中,加蒸馏水溶解并定容至刻度,摇匀,得0.1 mg/mL 的葡萄糖样品溶液,备用。
2 mol/L H2SO4溶液:准确移取111.11 mL 浓H2SO4溶液,定容至1 L,用于溶解多糖。
蒽酮-硫酸溶液配制:精确称取蒽酮粉末0.100 0 g 加入100 mL 的锥形瓶中,加入浓度为80% 的H2SO4,定容至100 mL,备用。
1.2.3 浸提剂的确定
分别用蒸馏水、不同浓度的乙醇溶液作为阳荷多糖的浸提剂,用紫外分光光度计测出吸光度,得出最佳浸提剂。
1.2.4 微波提取条件的优化[5-6]
分别以最佳浸提剂为溶剂,对不同料液比、浸提时间和功率进行单因素试验,并对料液比、时间和功率采用L9(33)进行正交试验,通过正交分析,得出微波提取阳荷多糖的最佳提取工艺参数。
2 结果与分析[7 -10]
2.1 葡萄糖标准曲线的绘制
分别从葡萄糖样品溶液中精密移取0.2、0.4、0.6、0.8、1.0、1.2 mL 置于试管中,加蒸馏水定容至2 mL,精密加入蒽酮-硫酸溶液6 mL。置于沸水中加热15 min 后取出,放入冰浴中冷却,以相应的空白试剂作对照,在波长为625 nm 下,以吸光度A 为纵坐标,葡萄糖含量c(μg/mL)为横坐标,绘制标准曲线(见图1),得回归方程为:A=0.0364C+0.0624,R2=0.9992。

图1 葡萄糖标准曲线Fig.1 Glucose standard curve
由此可以得出多糖提取率的计算公式:
提取率/% =[(A-0.062 4)/0.036 4 ×10 ×V/m/1000]×100
式中:A为吸光度;m为称取阳荷质量,g;V为浸提液体积,mL。
2.2 浸提剂的确定
用不同体积分数的乙醇和蒸馏水为浸提剂提取阳荷多糖,结果见表1。
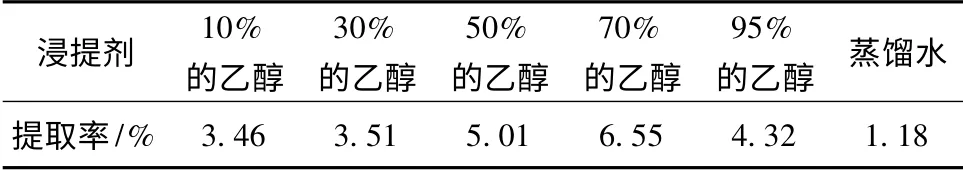
表1 不同浸提剂对提取率的影响Table 1 Influence of different extracting agent on the extraction ratio
由表1 可知,本实验用70%的乙醇作为提取阳荷多糖的最佳浸提剂。
2.3 单因素实验
2.3.1 提取时间的影响
准确称取过20 目筛干燥阳荷粉1.000 0 g,料液比为1∶20(g∶mL),中火(440 W)下分别提取1、2、3、4、5 min。按1.2.1 中样品溶液的制备及2.1 中标准曲线制作的方法分别实验,测其吸光度,并代入回归方程中求其多糖提取率,实验结果见图2。
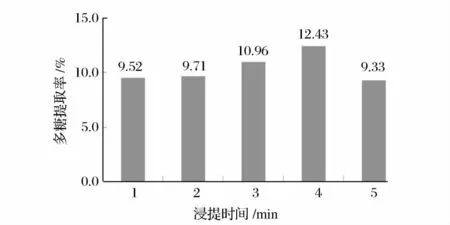
图2 作用时间对提取率的影响Fig.2 Influence of different acting time on the extraction ratio
由图2 可知,随着提取时间的延长,阳荷中多糖的提取率逐渐增加,在4 min 时多糖的提取率达到最大,超过4 min 后,多糖提取率随时间的延长逐渐下降。可能是多糖的浸出率达到了动态平衡,多糖氧化分解速度逐渐增加所致,故选择4 min 作为进一步优化提取条件的浸提时间。
2.3.2 料液比的影响
准确称取1.000 0 g 阳荷粉,料液比分别为1∶10、1∶20、1∶30、1∶40、1∶50(g∶mL),中火(440 W)作用下浸提4 min,按1.2.1 中样品溶液的制备及2.1 中标准曲线的制作方法分别实验,测其吸光度,并代入回归方程中求其多糖提取率,实验结果见图3。
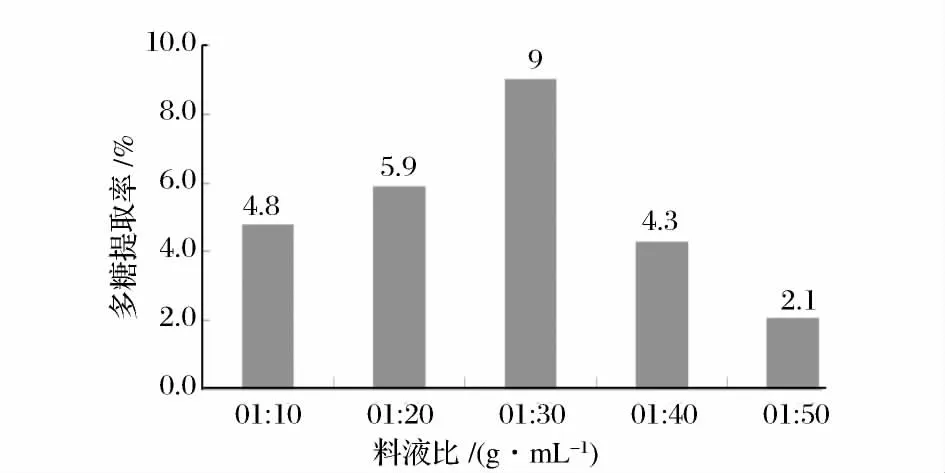
图3 料液比对提取率的影响Fig.3 Influence of different solid-liquid ratio on the extraction ratio
由图3 可知,料液比为1∶30(g∶mL)之内时,多糖提取率逐渐增加,料液比超过1∶30(g/mL)后,提取率逐渐下降,这可能是多糖的溶出率已达到平衡,过多的溶剂造成多糖的损失。故选择1∶30(g∶mL)作为进一步优化提取条件的最佳料液比。
2.3.3 微波功率的影响
准确称取1.000 0 g 阳荷粉,料液比1 ∶30(g/mL),微波功率分别为低火(136 W)、中低火(264 W)、中火(440 W)、中高火(616 W)、高火(800 W)下浸提4 min。按1.2.1 中样品溶液的制备及2.1 中标准曲线的制作方法分别实验,测其吸光度,并代入回归方程中求其多糖提取率,结果见图4。
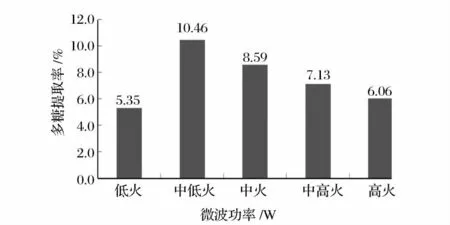
图4 微波功率对提取率的影响Fig.4 Influence of different microwave power on the extraction ratio
由图4 可知,随着提取功率的增加,阳荷多糖的提取率随之增加,当提取功率为中低火时达到最大,之后随提取功率的增加而逐渐下降。可能是由于功率的增加造成多糖氧化分解所致,故选择提取功率为中低火作为进一步优化提取条件的最佳功率。
2.4 正交试验
为了确定在提取过程中各因素的影响大小,本研究对微波法提取阳荷多糖的3 个单因素即提取时间(A)、料液比(B)、微波功率(C)进行正交试验,并以多糖提取率作为提取工艺的判断依据。根据设置选用L9(33)正交表,试验方案设计及结果见表2 和表3。
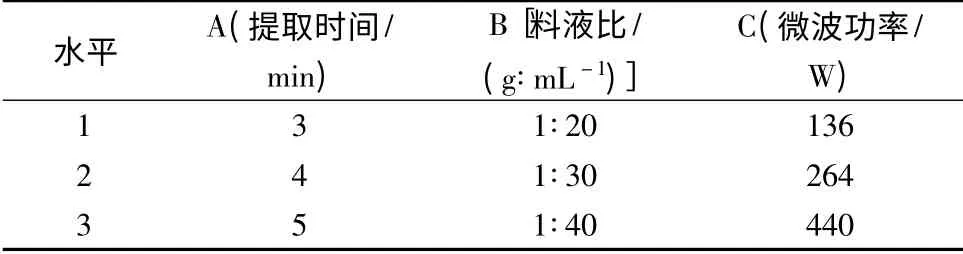
表2 正交试验因素水平表Table 2 The factor levels of the orthogonal test
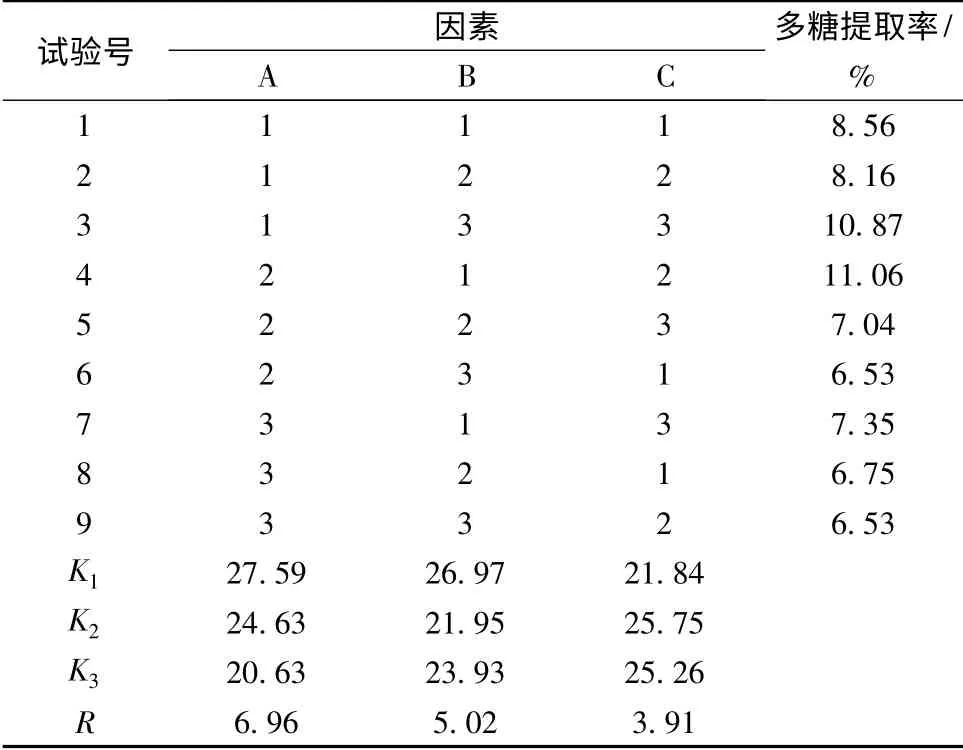
表3 正交试验结果及极差分析Table 3 The results of orthogonal test and range analysis
由表3 极差分析结果显示,3 个因素对阳荷多糖提取率的影响依次为:提取时间>微波功率>料液比。正交优化条件为A1B1C2,即提取时间为3 min,料液比为1∶20(g∶mL),微波功率为中火(264 W)。
2.5 验证性实验[11]
为了考察上述工艺的稳定性,按微波法提取阳荷多糖的最佳工艺条件A1B1C2,即提取时间为3 min,料液比为1∶20(g∶mL),提取功率为中火的条件下分别进行重复性试验5 次,分别测定其多糖提取率,计算其RSD ,结果见表4。
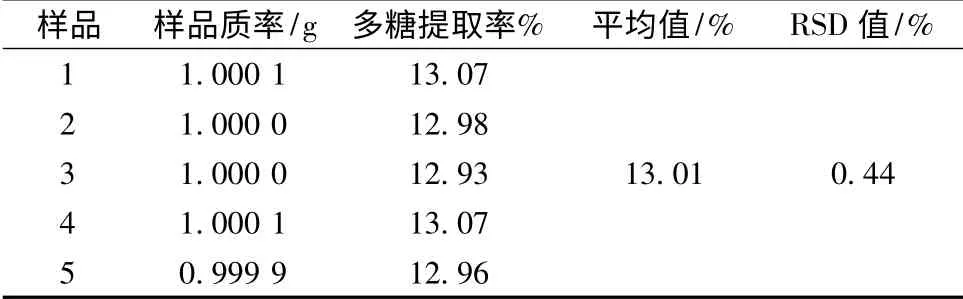
表4 验证实验结果Table 4 The verification testing results
由表4 可知,在此工艺条件下,多糖平均提取率为13.01%,优于正交实验中任何一组,RSD 为0.44%,说明该工艺稳定。
2.7 三种提取方法比较[12]
同法采用常规浸提法得出阳荷多糖的最佳提取条件为:料液比为1∶40(g∶mL),提取时间为80 min,提取温度为90℃,阳荷多糖的提取率平均值为5.05%;超声波辅助法最佳提取条件料液比为1∶30(g∶mL),提取时间为30 min,提取温度为70℃,在此条件下阳荷多糖的提取率平均值为8.18%。3 种提取方法比较见表5。

表5 常规提取、超声波与微波提取法效率比较Table 5 The comparation of the extraction efficiency among the conventional method,ultrasonic method and the microwave-assisted method
由表5 可知,微波辅助提取法具有提取时间短、耗材少、提取效率高等优点,故可用于工业上大规模生产。
3 结论
本试验采用微波法、常温浸提和超声波法提取阳荷多糖,对阳荷多糖的提取工艺进行了优化。微波辅助提取的最佳工艺条件为:浸提时间3 min,料液比1∶20(g∶mL),微波功率为中火,多糖的提取率为13.01%,且稳定性高;采用常规浸提法的最佳提取工艺条件为:料液比1∶40(g∶mL),浸提时间80 min,浸提温度90℃,多糖的提取率平均值为5.05%;超声提取的工艺条件:料液比1∶30(g∶mL),浸提温度70℃,浸提时间30 min,超声功率100 W,多糖提取率为8.18%。采用微波法辅助提取阳荷多糖具有操作简单,时间短,提取率高,能耗低等优点,可以广泛用于工业上多糖的生产。
[1] 易凤英,刘素纯,李佳莲,等. 茶多糖的提取方法及其生理功能研究进展[J]. 安徽农业科学,2010,38(6):2 911 -2 913.
[2] 陈仕学,郁建平. 梵净山野生阳荷红色素的提取及理化性质研究[J],山地农业生物学报,2010,29(5):432 -439.
[3] 李德海,孙常雁,孙莉洁,等. 微波辅助提取滑菇多糖的工艺研究[J]. 食品工业科技,2008(4):226 -228.
[4] 许本波,张世俊,江洪波. 微波辅助法提取山药多糖的研究[J]. 安徽农学通报,2007,13(12):34 -35,60.
[5] 刘小丽,黄晋杰. 微波辅助法提取香菇多糖的工艺[J]. 食品研究与开发,2010,31(3):14 -16.
[6] 吴萃云,汪河滨,李万福,等. 黑果枸杞叶片中多糖提取工艺研究[J]. 食品研究与开发,2009,30(12):1 -4.
[7] 王振宇,孙芳,刘荣. 微波辅助提取松仁多糖的工艺研究[J]. 食品工业科技,2006,(9):133 -135,139.
[8] 吴琼英,戴伟. 微波辅助提取条斑紫菜多糖及其抗氧化性研究[J]. 食品科技,2007,32(3):96 -99.
[9] 董周永,池建伟,杨公明,等. 荔枝多糖微波提取工艺研究[J]. 食品工业科技,2006(3):118 -120.
[10] 高梦祥,刘恒蔚,宗明远. 采用微波技术提取海带多糖的工艺研究[J]. 食品研究与开发,2006,27(8):69-71.
[11] 刘旭辉,姚丽,覃勇荣. 等. 豆梨多糖提取工艺条件的初步研究[J],食品科技,2011,36(3):159 -163.
[12] 胡爱军,郑捷. 食品工业中的超声波提取技术[J]. 食品与机械,2004,20(8):57 -60.
