波纹巴非蛤蛋白分离及其性质研究*
2013-10-30何小庆曹文红赵子科章超桦
何小庆,曹文红,赵子科,章超桦
(广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,国家贝类加工技术研发分中心(湛江),广东海洋大学食品科技学院,广东 湛江,524088)
波纹巴非蛤(Paphia undulata)俗称“花甲螺”、“花蚶”,系辩鳃纲帘蛤目帘蛤科,在我国广泛分布于福建、广东、广西等沿海地区,福建省云霄县东山湾是波纹巴非蛤主产区,年产量近4 万t[1]。但以带壳鲜销为主,部分去壳取肉冷冻加工出口或加工成干制品、罐头、蛤油,其利用价值和经济效益均不高,是一种尚未得到充分利用的海洋贝类资源。
研究表明波纹巴非蛤肉蛋白质含量高,是良好的贝类蛋白质资源[2]。关于水产尤其是贝类蛋白的分离与纯化及性质问题,目前研究还较少[5-7],而对波纹巴非蛤的研究主要集中于养殖[3]、净化[4]等方面,对其蛋白组分及性质研究尚未见报道。本研究参照日本学者Saito[8]的方法,将波纹巴非蛤蛋白分为肌浆蛋白、肌原纤维蛋白、基质蛋白,并对各蛋白组分的含氮量、分子量分布及其溶解性和浊度等进行了测定和分析,旨在为波纹巴非蛤蛋白资源的深加工和综合利用提供基础理论依据。
1 材料与方法
1.1 原料
新鲜的波纹巴非蛤开壳取肉,去内脏,用蒸馏水洗净,分装(每份约50g),置于超低温冰箱中。
1.2 主要仪器设备及试剂
数显pH 25C 酸度计,上海康仪仪器有限公司;Sigma 3K3 高速冷冻离心机,贝朗国际生物工程公司;FA2104A 电子分析天平,上海天平仪器厂;T18 baisc 高速组织捣碎机,德国IKA 集团公司;VULCAN.3 -550 PD. 马福炉,美国VULCAN 公司;SB-5200 超声波清洗机,海新芝生物技术研究所;UV-2102 紫外/可见分光光度计,尤尼柯仪器有限公公司;DYCZ-24EN 电泳槽,北京六一仪器厂;DYY-2C 电泳仪,北京六一仪器厂;Tanon GIS-2008 凝胶成像仪,上海天能科技有限公司,电泳蛋白分子量标准品购自Takara 大连宝生物工程有限公司。其他试剂均为国产分析纯。
1.3 实验方法
1.3.1 基本营养成分的测定
水分的测定:常压干燥法(GB/T5009.3 -2010);粗蛋白的测定:微量凯氏定氮法(GB/T5009.3 -2003);灰分的测定:高温灼烧法(GB/T5009.4 -2010);粗脂肪的测定:索氏提取法(GB/T5009.6 -2003);总糖含量的测定:蒽酮比色法。
1.3.2 蛋白质分离方法
提取温度除非特别说明均为0 ~4℃。参照Saito等[8]的方法,将波纹巴非蛤肉分散于3 倍体积预冷的0.05 mol/L,pH7.0 的PBS 缓冲液中,高速组织匀浆机匀浆5min,4℃条件下浸提90 min(不时搅拌),离心(10 000 r/min,15 min,4℃),收集上清液,将沉淀分散于3 倍体积预冷的0.05 mol/L,pH7.0 的PBS 缓冲液中,重复上述操作,得上清液和沉淀S1。收集两次离心后的上清液,按1∶1 的比例加入10%的TCA,离心(10 000 r/min,15 min,4℃),上清液即非蛋白氮组分,沉淀S2 用丙酮漂洗3 次,除去TCA,然后挥发掉丙酮,用冰水溶解即得肌浆蛋白组分。将沉淀S1分散于3 倍体积的0.1 mol/L,pH 7.0,含1.0 mol/L NaCl 的磷酸盐缓冲液中,高速组织匀浆机匀浆5 min,4℃下浸提18 h(不时搅拌),离心(10 000 r/min,15min,4℃),收集上清液,将沉淀分散于3 倍体积的0.1 mol/L,pH 7.0,含1.0 mol/L NaCl 的磷酸盐缓冲液中,重复上述操作,收集两次离心后的上清液,即为肌原纤维蛋白组分,所得沉淀部分即为基质蛋白组分。肌原纤维蛋白透析脱盐,可得脱盐的肌原纤维蛋白。
1.3.3 蛋白组分含量测定
所有蛋白质组分和非蛋白氮含量测定均采用微量凯氏定氮法。
1.3.4 蛋白质分子量分布测定
采用5%浓缩,12%分离胶对分离后的波纹巴非蛤蛋白质组分进行SDS-PAGE 电泳分析。考马斯亮蓝R-250 染色2 h,用脱色液(乙醇∶冰醋酸∶蒸馏∶水=25∶8∶67)脱色2 h。用Alphalmager HP 凝胶成像系统拍照。
1.3.5 浊度测定
取一定量2 mg/mL 的蛋白质溶液经不同条件处理后,室温(25℃)静置20 min,测定吸光度(A340)。
1.3.6 溶解度测定
测定浊度后的蛋白溶液在4℃、5 000 r/min 下离心15 min,取上清液测定蛋白溶解度。溶解度计算:

2 结果与讨论
2.1 波纹巴非蛤基本营养组成
波纹巴非蛤与其他贝类的基本营养组成比较见表1。新鲜波纹巴非蛤肉含水量占82.07%,除水分之外含量最高的是粗蛋白,占原料12.33%,总糖占原料1.63%、粗脂肪占0.72%、灰分占0.83%。与关志强等[9]测得波纹巴非蛤粗蛋白含量(12.15%)相比,在误差范围之内,这可能是由实验条件及不同季节波纹巴非蛤本身营养组成存在差异所引起的误差。以干基计,波纹巴非蛤粗蛋白含量占68.77%,均高于 同 属 的 文 蛤 (51.53%)[10]、美 洲 帘 蛤(60.69%)[11]、菲律宾蛤仔(61.28%)[12],与近江牡蛎、马氏珠母贝相比,略低于马氏珠母贝(74.9%)[13],比 近 江 牡 蛎(50.63%)[14]高 出18.14%,粗脂肪含量均低于以上这5 种常见的双壳贝。由此可知,波纹巴非蛤具有高蛋白低脂肪的特点,是一种值得重视的蛋白质资源。
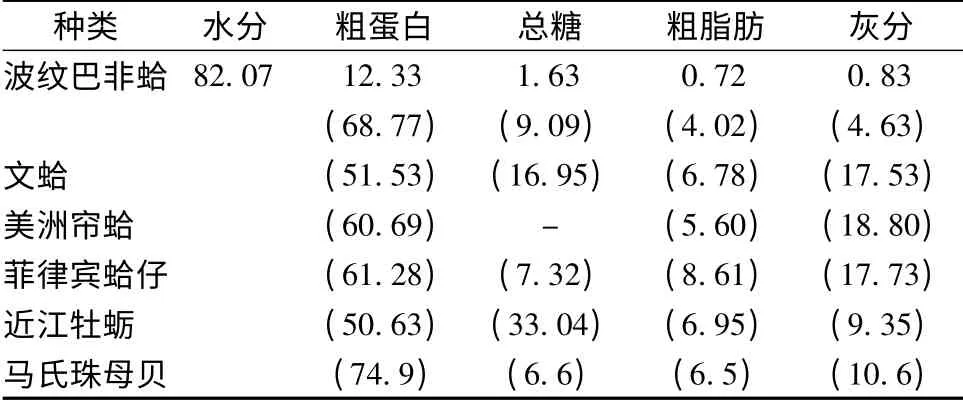
表1 波纹巴非蛤与其他贝类基本营养组成比较 %Table 1 Nutrition composition of Paphia undulata compared with other shellfishes %
2.2 波纹巴非蛤蛋白质组成
本文根据1.3.2 描述的方法对波纹巴非蛤肉蛋白质进行分离,除非蛋白氮外,得到3 个蛋白质组分:肌浆蛋白组分、肌原纤维蛋白组分和基质蛋白组分,各蛋白质组分占波纹巴非蛤肉总蛋白比例见图1。

图1 波纹巴非蛤肉蛋白质组成Fig.1 Protein compositions of Paphia undulata
从图1 可以看出,波纹巴非蛤肌原纤维蛋白组分占原料总蛋白比例最大,达45.42%,依次是肌浆蛋白(31.2%)、基质蛋白(20.69%)、非蛋白氮含量占1.67%,非蛋白氮中主要成分为游离氨基酸、小肽及核苷酸等物质,这可能与波纹巴非蛤味道鲜美有着极密切的关系。与其他水产动物不同,贝类的软体部分(可食部分)没有骨骼组织,其组织与结构主要由蛋白质、多糖等大分子物质组成,特别是肌原纤维蛋白和基质蛋白。肌原纤维蛋白在肉的加工和贮存中起到非常重要的作用,不仅与肌肉收缩有关,还与肉制品的流变学特性如黏结性、保水性、弹性、质地等有密切的关系,在糜类肉制品和重组肉制品的质构特性中起主要作用。因此,若将波纹巴非蛤肉添加到其他肉制品中,可以获得具有贝类风味肉制品新品种。
波纹巴非蛤在冻藏过程中易发生冷冻变性,这可能与其肌原纤维蛋白所占的比例有关。在贝肉蛋白质变性中,肌原纤维蛋白变性比Ca2+-ATPase 活性变化幅度要大,说明贝肉的肌球蛋白杆部比头部更容易发生变性,这与对鱼类的研究结论一致[15]。
2.3 波纹巴非蛤蛋白质分子量分布
文本采用12%的分离胶,5%的浓缩胶对波纹巴非蛤各蛋白分离组分进行SDS-PAGE 电泳分析,用Alphalmager HP 凝胶成像系统拍照得到的电泳图谱如图2 所示。
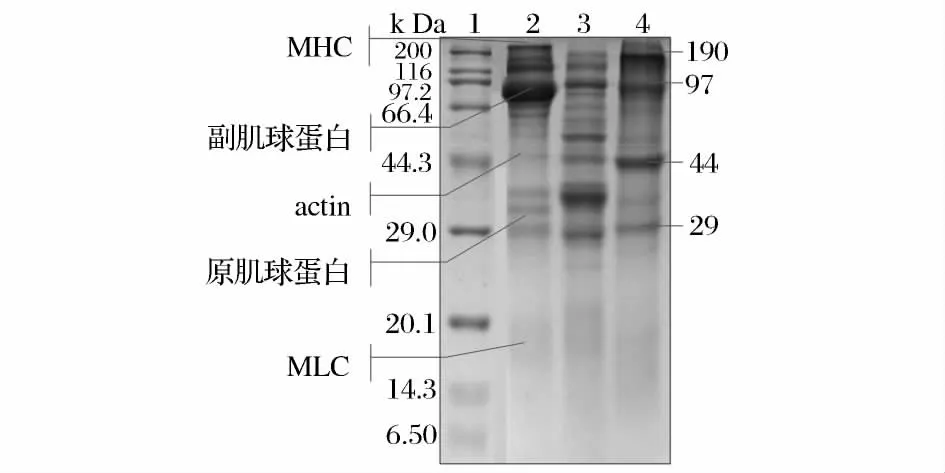
图2 蛋白质组分SDS-PAGE 电泳图谱Fig.2 SDS-PAGE of protein components
SDS-PAGE 电泳分析图谱显示,3 种蛋白质组分亚基分子量主要位于200 ~29.0 kDa;其中肌浆蛋白条带较多、亚基分子量分布比较广泛;肌原纤维蛋白组分分子量大多介于66.4 ~200 kDa 和29.0 ~38.0 kDa,200 kDa 处为肌球蛋白重链谱带(MHC),45 kDa附近处为肌动蛋白谱带,原肌球蛋白分布在35 kDa附近,小于20 kDa 为肌球蛋白轻链(MLC),分布在100 kDa 附近的蛋白质条带则为副肌球蛋白,条带颜色较深,说明其所占比例较大。副肌球蛋白是无脊椎动物特有的肌原纤维蛋白质,与双壳贝闭壳肌的特殊运动有关,在双壳贝的闭壳肌中含量特别多,研究表明扇贝贝柱中副肌球蛋白占肌原纤维蛋白质的50%以上[16];基质蛋白组分在190、97、44、29 kDa 有明显的蛋白条带。本次研究中,分离所得的基质蛋白没有作进一步分离处理,所得基质蛋白中含有少量的碱溶性蛋白组分,因此在低分子量范围内也出现了蛋白条带。
2.4 温度对肌浆蛋白和肌原纤维蛋白浊度和溶解度的影响
在室温、pH7.0 下考察温度对肌浆蛋白和肌原纤维蛋白浊度和溶解度的影响。考察温度点为25、35、45、55、65、75 和85℃,当温度达到相应值时立即取出试管于冰水中冷却,测定浊度和溶解度。
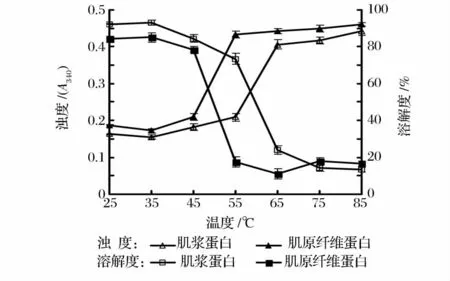
图3 温度对肌浆蛋白、肌原纤维蛋白溶液浊度和溶解度的影响Fig.3 Effect of heating temperature on turbidity and solubility of myosinogen and myofibril protein solution
由图3 可知:肌浆蛋白与肌原纤维蛋白受温度的影响变化趋势相似。在25 ~45℃时,肌浆蛋白与肌原纤维蛋白溶解度变化不显著,说明在此温度范围内蛋白质未发生明显变性,而浊度在此温度范围内变化不明显也可进一步反映出蛋白质变性情况;肌浆蛋白在55 ~65℃内,肌原纤维蛋白在45 ~55℃变化区间内溶解度均显著降低(P<0.05),说明此时蛋白质发生了明显的变性聚集,浊度在此温度范围内显著增大(P<0.05),这是由于加热促使蛋白质空间结构发生变化,蛋白质单体损失,疏水基团暴露后发生聚集导致[17];当加热温度超过55℃,肌原纤维蛋白溶解度先缓慢下降后又逐渐上升,浊度缓慢增加,变化不显著,当加热温度超过65℃后,肌浆蛋白溶解度缓慢减小、浊度缓慢增大,变化都不显著。此外,Paredi等[18]报道扇贝肌球蛋白的变性温度为41.7 ~55.0℃。由此可以初步推测,波纹巴非蛤肌浆蛋白的热变性温度可能在55℃附近,肌原纤维蛋白的热变性温度可能在45℃附近。
2.5 pH 值对肌浆蛋白和肌原纤维蛋白浊度和溶解度的影响
在室温(20 ~25℃)下考察pH 对肌浆蛋白和肌原纤维蛋白浊度和溶解性的影响。取浓度为2 mg/mL 的蛋白溶液,用0.5 mol/L 的HCl 或NaOH 溶液调pH 分别至3.5、4.5、5.5、6.5、7.5、8.5 和9.5,缓慢搅拌30 min,测浊度,离心(4℃,5 000 g,15 min),所得上清液用于测定蛋白质溶解度,结果见图4。
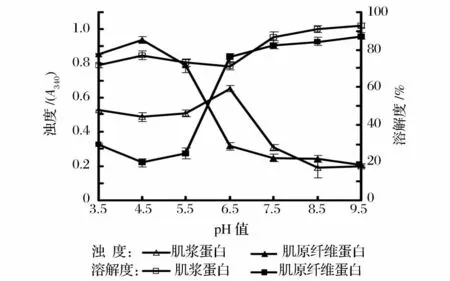
图4 pH 值对肌浆蛋白、肌原纤维蛋白溶液浊度和溶解度的影响Fig.4 Effect of pH on turbidity and solubility of myosinogen and myofibril protein solution
由图4 可知:(1)在实验范围内,肌浆蛋白的溶解性都较好,溶解度均大于71%,pH5.5 ~6.5 溶解性较低;在pH6.5 附近浊度达到最大,随后随pH 值增加而下降;(2)pH 对肌原纤维蛋白溶解度影响较大,在中性或碱性条件下肌原纤维蛋白的溶解性较好,在酸性条件下,肌原纤维蛋白的溶解性较差,当pH <4.5 时,溶解度随pH 值增大而降低,在pH4.5时降至最小,随后显著增大(P<0.05);蛋白溶液浊度变化情况则相反。当pH >6.5 时,溶解度和浊度增大或减少到一个稳定范围,变化不显著。这与王耀耀等[19]对鲍鱼腹足肌原纤维蛋白的溶解度和浊度研究所得变化趋势有相似性。这可能是由于蛋白质属于两性分子,当环境pH 高于或低于等电点时,蛋白质带负电荷或正电荷,水分子同这些电荷相互作用并起稳定作用,从而增加了蛋白质的溶解性,对浊度的影响较小;当pH 值接近等电点时,蛋白质分子同水的作用较弱,使肽键能相互靠拢,有时能形成聚集体而导致蛋白质沉淀,从而使得溶解度降低,浊度升高。另外pH 对猪肉[20]、鱼肉[21]的肌球蛋白二级结构变化有不同程度的影响,因此当溶液的pH 从6.5 降低到4.5 时,肌原纤维蛋白所带净电荷和空间结构发生变化,导致溶解度降低,浊度升高。
2.6 离子强度对肌原纤维蛋白浊度和溶解度的影响
由于肌原纤维蛋白是用盐溶液提取的,而肌浆蛋白是用离子强度很低的磷酸缓冲液提取的,故本次实验未考虑离子强度对肌浆蛋白浊度和溶解度的影响。
由图5 可知,离子强度从0.2 mol/L 增大到0.6 mol/L 的过程中,波纹巴非蛤肌原纤维蛋白的浊度显著下降(P<0.05),溶解度显著升高(P<0.05);当离子强度大于0.6 mol/L 时,随离子强度增加,浊度和溶解度变化不显著。这可能是因为离子强度能够改变氨基酸侧链电荷分布,降低或增加蛋白质之间的相互作用,改变肌原纤维蛋白的状态,从而影响其理化性质。肌原纤维蛋白不溶于水而溶于盐溶液,在低离子强度下(<0.4)形成均一的纤丝,所以浊度大而溶解度小,而在高离子强度下(>0.4)形成分散的单体,处于可溶状态,因此浊度小而溶解度大。

图5 离子强度对肌原纤维蛋白溶液浊度和溶解度的影响Fig.5 Effect of ionic strength on turbidity and solubility of myosinogen and myofibril protein solution
3 结论
(1)新鲜波纹巴非蛤肉含水量为82.07%,粗蛋白12.33%,粗脂肪0.72%,灰分0.83%,总糖1.63%。对其蛋白组分分析结果表明,波纹巴非蛤蛋白中肌原纤维组分占原料粗蛋白的45.42%,肌浆蛋白蛋白组分占31.2%,基质蛋白组分占20.69%,非蛋白氮占1.67%。
(2)波纹巴非蛤蛋白组分分子量分布范围宽,但各组分之间又存在较大差异。肌浆蛋白组分亚基分子量分布比较广泛,在200 ~29.0 kDa 之间;肌原纤维蛋白组分分子量大多介于66.4 ~200 kDa 和29.0~38.0 kDa 之间;基质蛋白组分在190 kDa、97 kDa、44 kDa、29 kDa 有明显的条带。
(3)肌浆蛋白与肌原纤维蛋白浊度和溶解度受温度影响的变化趋势相似;pH 值对肌浆蛋白浊度和溶解度影响较小,对肌原纤维蛋白溶液浊度和溶解度影响较大;在实验范围内,离子强度下降,肌原纤维蛋白溶液的浊度上升,溶解度下降。
[1] 王万东. 福建省东山湾云霄海区波纹巴非蛤养殖状况监测[J]. 养殖与饲料,2009(6):17 -21.
[2] 章超桦,洪鹏志,雷晓凌,等. 波纹巴非蛤肉的食品化学特性及其在鱼糜制品中的应用[J]. 湛江海洋大学学报,2000,20(1):28 -31.
[3] 郭昱嵩,谢子强,邓岳文,等. 利用FIASCO 技术进行波纹巴非蛤微卫星DNA 标记分离与筛选的研究[J]. 中国农学通报,2012,28(17):160 -164.
[4] 陈嘉文,秦小明,林华娟,等. 波纹巴非蛤净化中试研究[J]. 现代食品科技,2009,25(7):764 -766.
[5] 丁玉庭. 鲢鳙鳊鲫鱼肉的蛋白质组成及分离研究[J].水产科学,1999,18(3):21 -25.
[6] 蔡扬鹏,张农,刘光明,等. 两种织纹螺肌肉蛋白的电泳鉴别[J]. 食品科学,2006,27(12):631 - 634.
[7] 郑惠娜,章超桦,刘书成,等. 马氏珠母贝蛋白质的分离及分子量分布研究[J]. 水产科学,2008,27(9):447-451.
[8] Saito T,Iso N,Mizuno H,et al. Effect of thermal treatment on extraction of proteins from meats[J]. Bulletin of the Japanese Society of Scientific Fisheries,1983,49(10):1 569 -1 572.
[9] 关志强,李敏,宋小勇,等. 冻藏条件对文蛤和波纹巴非蛤营养成分影响的实验研究[J]. 食品科技,2007,32(4):214 -218.
[10] 张安国,李太武,苏秀榕,等. 同地理群体种群文蛤的营养成分研究[J]. 水产科学,2006,25(2):79 -81.
[11] 杨建敏,邱盛尧,郑小东,等. 美洲帘蛤软体部营养成分分析及评价[J]. 水产学报,2003,27(5):495 -498.
[12] 吴云霞,梁健,闫喜武,等. 菲律宾蛤仔营养成分分析与评价[J]. 营养学报,2012,34(4):409 -413.
[13] 汪何雅,杨瑞金,王璋. 牡蛎的营养成分及蛋白质的酶法水解[J]. 水产学报,2003,27(2):163 -168.
[14] 章超桦,吴红棉,洪鹏志,等. 马氏珠母贝肉的营养成分及其游离氨基酸组成[J]. 水产学报,2000,24(2):180 -184.
[15] 关志强,蒋小强,李敏,等. 冷冻对波纹巴非蛤蛋白质变性的影响[J]. 水产学报,2005,29(6):837 -841.
[16] 鸿巢章二,桥本周久著,郭晓风,邹胜祥译. 水产利用化学[M]. 北京:中国农业出版社,1994:50 -64,271-276.
[17] Lefevre F,Fauconneau B,Thompson J W,et al. Thermal denaturation and aggregation properties of atlantic salmon myofibrils and myosin from white and red muscles[J]. Journal of Agricultural and Food Chemistry,2007,55(12):4 761 -4 770.
[18] Paredi M E,Tomas M C,Crupkin M. Thermal denaturation of myofibrillar proteins of striated and smooth adductor muscles of scallop(Zygochlamys patagonica).A differential scanning calorimetric study[J]. Journal of Agricultural and Food Chemistry,2002,50(4):830 -834.
[19] 王耀耀,朱蓓薇,董秀萍,等. 鲍鱼腹足肌原纤维蛋白的组成及其性质[J]. 大连工业大学学报,2011,30(3):183 -186.
[20] Liu R,Zhao S,Xiong S B,et al. Role of secondary structures in the gelation of porcine myosin at different pH values[J]. Meat Science,2008,80(3):632 -329.
[21] Liu R,Zhao S,Xiong S B,et al. Effect of pH on the gel properties and secondary structure of fish myosin[J].Food Chemistry,2010,121(1):196 -202.
