光学溶氧电极在工业发酵过程监测及优化中的应用
2013-10-30张鑫王泽建
张鑫,王泽建
(华东理工大学,上海,200237)
生物医药、食品等工业发酵中,溶氧一直被视为重要的操作参数。发酵液中溶氧水平能反映出该发酵体系中供氧与耗氧之间的关系。目前广泛使用极谱氧电极是基于电化学原理的电极,电极膜和电极电解液均为高耗耗材,而且成本很高。此外,电极经过高温灭菌和长期发酵使用后,漂移大。梅特勒托利多公司新开发的光学溶氧电极则克服了这些缺点。
氧是难溶于水的气体,在室温及常压条件下,空气中氧的溶解度仅为7.5 ~8 mg/L。当水中溶有糖或其他盐类时,氧的溶解度则更低。发酵过程中,氧参与菌体的生长、产物的形成和维持细胞的代谢,供氧水平的高低严重影响着产物的合成。因此,氧传递速率的控制对好氧微生物发酵过程非常关键。尤其在大规模反应器发酵放大过程中,供氧能力的差异是导致发酵结果不能重复的一个重要原因。
在耗氧发酵中,溶氧起着至关重要的作用。各种耗氧微生物发酵过程中,溶氧水平影响微生物生理代谢从而影响细胞的生长、产物的合成[1]。研究证实,低溶氧会对微生物NAD(P)H、FADH 氧化产生ATP过程产生抑制[2]。据文献报道,供氧在很多产品,例如有机酸[3]、氨基酸[4]、多糖[5]等的发酵过程中微生物的代谢调控中作为一个非常关键的因素。然而,过高的氧供给会直接将底物氧化而没有产物表达,提高了发酵成本。
在工业过程放大中,氧传递速率是一个非常值得注意的参数[6]。随着溶氧传感器技术的发展,基于氧传递和溶氧水平的放大方法被建立,并且在发酵工业中越来越广泛的被应用[1]。影响溶氧的因素有氧传质系数(kLa)和氧消耗速率(OUR)。在一些高耗氧或高密度发酵过程中,溶氧水平经常会处于临界氧浓度以下,此时溶氧就很难反应出设备的供氧能力[7]。
1 材料与方法
发酵罐,上海国强生化装备有限公司的30L 和50L 自动发酵罐;电极,梅特勒-托利多pH 和光学溶氧电极InPro6860i;尾气测量采用Extral Max300-LG过程质谱仪;数据采集分析采用华东理工大学开发的Biostar5.1。
在线检测参数由传感器获取后发送到发酵罐工控机上,再由上位机Biostar 采集,在线计算参数由Biostar 根据在线测量参数自动计算[8]。
2 光学溶氧电极的原理和特点
光学溶氧电极是基于荧光消减原理:通过荧光信号与一个参比信号对比,根据这两个信号的时间差来计算出氧浓度。此外,梅特勒-托利多的光学溶氧电极采用了ISM(智能电极管理系统)模块。通过这个模块,溶氧电极可以将获取到的溶氧值直接以数字信号的形式传递给配备的M400 变送器。与传统的极谱氧电极相比,梅特勒-托利多的光学溶氧电极主要有以下优点:
(1)漂移小、响应快。传统极谱氧电极每一次使用都要进行标定,光学溶氧电极可以连续使用多批而不需标定,而且响应速度也是明显优于传统电极,尤其是对低溶氧条件下。光学溶氧电极连续使用近半年后,对空气中氧气显示仍在100% ±10%,90%相应时间在30s 内。由于其原理和数字信号传输,光学溶氧电极的噪音波动非常小,信号比较平稳,测量精度1%或8 ppb,显示精度4 位有效数字,对低溶氧有更灵敏、更精确的响应。
(2)便于管理。具有ISM 的电极,每一支电极都具有独一无二的电子编号,并且在电极上而不是变送器上保存着标定信息、灭菌次数、剩余寿命数据等信息。使用任何一个兼容的变送器都可以将所有的信息读出,标定过的电极可以插在任何一个变送器上立即开始使用。
(3)寿命长,耗材少。对于传统的极谱氧电极,膜和电解液都是高耗值耗材。在5L 罐上,曾出现过新电极使用两个月后膜就出现可见磨损。相对比的是光学溶氧电极没有电解液,不需要定期维护。此外,根据ISM 可以计算出剩余寿命供参考。
(4)受温度影响小。图1 中展示了在常压下极谱氧电极电流信号强度和温度之间关系,通过研究我们发现:在没有温度补偿的情况下,溶氧值显示受温度影响是很大的。其原因是电极膜对氧的通透性与温度有关,且温度会影响电化学反应的速率。光学溶氧电极InPro6860i 本身是光学技术工作原理,且内置温度探头做了改进,M400 变送器获取探头温度数据直接进行自动补偿,因此受温度影响更小,精度更高。

图1 极谱氧电极受温度影响Fig.1 Influenc of temperature on polarographic oxygen sensor
(5)数字信号传输。具有ISM 的电极都是采用数字信号传输:电极获取到信号后,直接由自身芯片(ISM)转化为数字信号,通过电缆线传给变送器,抗干扰能力大大高于nA 信号。M400 变送器可以直接以数字形式向工控机输出,除此之外也提供了4 ~20mA 模拟输出,对于旧设备的改造也是有很好的兼容性。
3 光学溶氧电极在工业发酵过程优化中的应用
3.1 工作原理
工业发酵中,氧气可以看作是微生物代谢的一种底物,同样可以作为限制性底物,同时溶氧一直被作为一个非常重要的操作变量。溶氧水平反应了发酵过程中供养与耗氧之间的关系,可用以下公式表示:

其中,c为溶氧浓度,OTR为供氧速率,OUR为耗氧速率。根据溶氧的变化,可以在一定程度上推测出微生物的耗氧状态。结合尾气质谱分析,我们可以进一步计算出氧消耗速率(OUR)、二氧化碳生成速率(CER)、呼吸商(RQ)以及氧传质系数(KLa)。KLa 可用以下公式计算[8]:
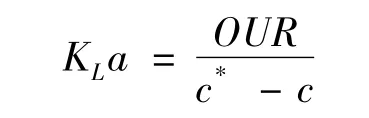
其中,OUR为氧气消耗速率,c*是氧气饱和浓度,c为发酵液实测浓度。KLa的在线计算可以实时反应出发酵液状态,设备的状态等等。
不同微生物,不同的发酵过程都具有不同的限制性氧浓度(图2)。发酵液中氧浓度低于这个值,微生物就进入氧限制状态,即供氧速率(OTR)达不到正常代谢所需的耗氧速率(OUR),一般会伴随代谢通路迁移,结果就是产量降低,副产物增多。

图2 临界氧浓度和OUR 的关系Fig.2 The relationship between critical oxygen concentration and OUR
3.2 溶氧电极在发酵应用实例
3.2.1 发酵液溶氧—转速联动控制
毕赤酵母是一种高耗氧微生物,OUR 水平可达150 ~200mmol/(L·h),发酵前期需要控制一个合适的溶氧水平,保证菌浓的快速增长。与复旦大学合作的毕赤酵母表达的项目中,采用了上海国强生化公司的30L 自动发酵罐。在发酵初期,采用了溶氧水平反馈调节搅拌转速的策略,通过计算机的自动控制使溶氧水平一直保持在25%以上,满足了微生物迅速繁殖的要求,菌浓在较短时间内达到诱导水平(图3)。
3.2.2 溶氧-补料控制

图3 溶氧-搅拌联动控制Fig.3 DO-agitation linkage control
发酵过程中,溶氧的突然回升一般是由于菌体裂解或者底物不足引起的。对于底物不足引起的溶氧回升,补加底物溶氧会迅速下降。因此,可以通过溶氧来反馈控制底物补加,使补加速率在一个合适的水平上。图4 为另一毕赤酵母发酵曲线,采用分批补料策略,每当溶氧迅速回升,就意味着发酵液中碳源不足,此时补入一定量碳源,溶氧快速下降。诱导阶段,停止甘油的补加,溶氧回升后经过1 h 左右以后补入一定量的甲醇,溶氧开始缓慢下降,表明微生物已经开始利用甲醇。待溶氧再次快速回升,表明甲醇消耗殆尽,而后开始根据溶氧控制甲醇的流加速率在一个合适的范围。
3.2.3 溶氧控制发酵过程节能减排
图5 是另一个产品的发酵曲线。原工艺由于没有溶氧电极的监测,搅拌电机一直高速开到最终放罐。后来经过实验发现,后期由于发酵液黏度下降,使得KLa 上升,供氧能力提高,最终导致溶氧上升。降低搅拌转速,OUR、CER、RQ均没有明显变化,目标产物浓度上升和原工艺对照无明显差别。因此,新工艺中到发酵后期采取降转速策略,节省了电能。
4 结论

图5 根据溶氧控制搅拌Fig.5 Control of agitation based on DO
溶氧早已成为现代工业发酵中不可缺少的操作参数之一,新型溶氧电极的出现不仅弥补了老式电极的缺陷,还带有功能强大的智能功能,为工艺开发放大到生产提供了便利,同时也为工厂生产过程中分析仪表的维护和管理提供了可靠的保障。在发酵过程监测、优化放大中,参数相关分析更加离不开溶氧的数据。控制合适的溶氧,既能保证菌体的正常生长,又能尽可能降低搅拌和通气的成本。
[1] Yegneswaran PK,Gray MR,Thompson BG. Effect of dissolved oxygen control on growth and antibiotic production inStreptomyces clavuligerusfermentations[J]. Biotechnology Progress,2008(7):246 -250.
[2] Huang WC,Chen SJ,Chen TL. The role of dissolved oxygen and function of agitation in hyaluronic acid fermentation[J]. Biochemical Engineering Journal,2006,32:239 -243.
[3] Hua Q,Shimizu K. Effect of dissolved oxygen concentration on the intracellular flux distribution for pyruvate fermentation[J]. J Biotechnol,1999,68:135 -147.
[4] Xu H,Dou WF,Xu HY. A two - stage oxygen supply strategy for enhanced l-arginine production byCorynebacteriumcrenatumbased on metabolic fluxes analysis[J]. Biochemical Engineering Journal,2009,43:41 -51.
[5] Tang YJ,Zhong JJ. Role of oxygen supply in submerged fermentation of Ganodermalucidum for production of Ganoderma polysaccharide and ganoderi acid[J]. Enzyme Microb Technol,2003,32:478 -484.
[6] Meltem U Demirtas,AratiKolhatkar,John J Kilbane. Effect of aeration and agitation on growth rate ofThermusthermophilusin batch mode[J]. Journal of Bioscence and Bioengineering,2003,95:113 -117.
[7] García OF,Gómez Castro E,Santos VE. Oxygen transfer and uptake rates during xanthan gum production[J]. Enzyme and Microbial Technology,2000,27:680 -690.
[8] 张嗣良,储炬.多尺度微生物过程优化[M].北京:化学工业出版社,2003.
