头孢克肟胶囊微生物限度检查法方法学验证
2013-10-19北京市丰台区药品检验所100071吕峥峥
北京市丰台区药品检验所(100071)吕峥峥
头孢克肟适用于敏感菌所致的咽炎、扁桃体炎、急性支气管炎和慢性支气管炎急性发作、中耳炎、尿路感染、单纯性淋病(宫颈炎或尿道炎)等。头孢克肟为第三代口服头孢菌素,通过抑制细菌细胞壁合成而起杀菌作用,对多数β内酰胺酶稳定,许多产青霉素酶和头孢菌素酶菌株仍对本品敏感。本品对葡萄菌抗菌作用差,对铜绿假单胞菌、肠杆菌属、脆弱拟杆菌、梭菌属等无抗菌作用。
按照《中国药典》2010年版二部附录微生物限度检查法中常规法进行预检验[1],5种验证菌的回收率均小于70%。采用培养基稀释法(0.2mL/皿),白色念珠菌、黑曲霉回收率大于70%。由于本品为抗生素,对细菌具有很强的抑菌作用,试用离心沉淀法与薄膜过滤法联用,同时将稀释液改为含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液,离心沉淀后取1∶100的供试液1mL采用薄膜过滤法,细菌类验证菌的回收率仍小于70%。因本品为脂溶性抗生素,经试验发现,以pH 7.0无菌氯化钠-蛋白胨缓冲液作为稀释液配制供试品储备液,离心沉淀后加入十四烷酸异丙酯,充分振摇,以500r/min离心3min,使水油完全分离,弃去油层,将水层混匀,作为1∶10的供试液,最终以1∶100的稀释液为最低稀释级,采用薄膜过滤法,以含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液作为冲洗液。当冲洗量为500mL时,细菌类验证菌的回收率均大于70%。用常规法和培养基稀释法(培养基的量为500mL)对本品进行大肠埃希菌检查,阳性菌未生长,说明本品在该条件下对大肠埃希菌有抑菌作用,采用细菌计数项下供试液,取供试液5mL薄膜过滤,阳性对照菌生长正常。经验证,此法适用于本品的微生物限度检查,效果良好。
1 实验用品
1.1 供试品 头孢克肟胶囊(批号:091001;规格:0.25g)。
1.2 培养基 营养肉汤培养基、改良马丁培养基、营养琼脂培养基、玫瑰红钠琼脂培养基、胆盐乳糖培养基、4-甲基伞形酮葡糖苷酸培养基(MUG)。均按照《中国药典》2010年版二部附录要求配制。
1.3 稀释液 pH 7.0无菌氯化钠-蛋白胨缓冲液;十四烷酸异丙酯。
1.4 冲洗液 含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液(注:含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液的配制方法:按照《中国药典》2010年版二部附录要求配制pH 7.0无菌氯化钠-蛋白胨缓冲液,将3g的蛋黄卵磷脂用30g的聚山梨酯80溶解后,加入上述缓冲液1000mL中,混匀、分装、灭菌。)。
1.5 菌种 枯草芽孢杆菌[CMCC(B)63501];金黄色葡萄球菌[CMCC(B)26003];大肠埃希菌[CMCC(B)44102];白色念珠菌[CMCC(F)98001];黑曲霉[CMCC(F)98003]。均符合《中国药典》2010年版二部附录要求。
2 微生物限度检查法草案
取本品10g,加pH 7.0无菌氯化钠-蛋白胨缓冲液至100mL,振摇至供试品分散均匀,制成1∶10的供试品储备液,取供试品储备液50mL,以500r/min离心3min,取上清液,加入十四烷酸异丙酯30mL,充分振摇,再以500r/min离心3min,弃去油层,取水层振摇混匀,制成1∶10的供试液,取1∶10的供试液 1mL加入含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液9mL中,制成1∶100的供试液。细菌计数,取1∶100的供试液1mL,置含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液100mL中,用薄膜过滤法处理,以含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液为冲洗液,每次100mL,共冲洗5次,取滤膜,依法检查(中国药典2010年版二部附录ⅩⅠJ)。霉菌和酵母菌计数,取1∶10的供试品储备液1mL,注入5个平皿中,每皿0.2mL,依法检查(《中国药典》2010年版二部附录ⅩⅠJ)。大肠埃希菌检查,取1∶10的供试液5mL,置含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液100mL中,用薄膜过滤法处理,冲洗方式同细菌计数项下,取滤膜,加至胆盐乳糖培养基100mL中,共制备2份,依法检查(《中国药典》2010年版二部附录ⅩⅠJ)。
3 方法学验证
按照《中国药典》2010年版二部附录中要求对上述拟定方法草案进行验证。
3.1 细菌、霉菌及酵母菌计数方法的验证[2][3]
3.1.1 菌液制备 ①接种金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌的新鲜培养物至10mL营养肉汤中,33℃培养24h;接种白色念珠菌的新鲜培养物至10mL改良马丁培养基中,25℃培养24h。上述培养物用0.9%无菌氯化钠溶液制成每1mL含菌数为50cfu~100cfu的菌悬液。②接种黑曲霉的新鲜培养物至改良马丁琼脂斜面培养基上,25℃培养7天,加入3mL含0.05%(mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱。过滤菌丝吸出孢子悬液至无菌试管内,用含0.05%(mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液制成每1mL含孢子数50cfu~100cfu的孢子悬液。
3.1.2 培养基适用性检查 取上述制备好的大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌菌液各1mL(50cfu~100cfu),分别注入无菌平皿中,立即倾注营养琼脂培养基,每株试验菌平行制备2个平皿,混匀,凝固,置33℃培养48h,计数;取上述制备好的白色念珠菌、黑曲霉菌液各1mL(50cfu~100cfu),分别注入无菌平皿中,立即倾注玫瑰红钠琼脂培养基,每株试验菌平行制备2个平皿,混匀,凝固,置25℃培养72h,计数;同时,用相应的对照培养基替代被检培养基进行上述试验。若被检培养基上的菌落平均数不小于对照培养基上的菌落平均数的70%,且菌落形态大小与对照培养基的菌落一致,判该培养基的适用性检查符合规定,见附表1。
3.1.3 供试液的制备 取本品10g,加pH 7.0无菌氯化钠-蛋白胨缓冲液至100mL,振摇至供试品分散均匀,制成1∶10的供试品储备液,取供试品储备液50mL,以500r/min离心3min,取上清液,加入十四烷酸异丙酯30mL,充分振摇,再以500r/min离心3min,弃去油层,取水层振摇混匀,制成1∶10的供试液,取1∶10的供试液 1mL加入含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液9mL中,制成1∶100的供试液。
3.1.4 验证试验
3.1.4.1 菌液组 分别取菌液1mL,采用平皿计数法,测定上述制备好的菌液中每毫升的活菌数,测定结果见附表2。
3.1.4.2 供试品对照组 取1∶100的供试液1mL,置含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液100mL中,采用薄膜过滤法,冲洗液为含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液,每次100mL,冲洗5次,测定供试品本底的细菌数,见附表3。取1∶10的供试品储备液1mL,注入5个平皿中,每皿0.2mL,测定供试品本底的霉菌和酵母菌数,结果见附表3。
3.1.4.3 试验组 取1∶100的供试液1mL,按供试品对照组同法操作,在第5次冲洗液中加入上述细菌菌液1mL(50cfu~100cfu试验菌),进行细菌计数,测定结果见附表4。计算回收率见附表5。取1∶10的供试品储备液0.2mL和上述真菌菌液1mL(50cfu~100cfu试验菌),分别注入同一平皿中,进行霉菌和酵母菌计数,测定结果见附表4,计算回收率见附表5。
3.1.4.4 稀释剂对照组 取上述细菌菌液50mL(2500cfu~5000cfu试验菌),500r/min离心3min,取上清液,加入十四烷酸异丙酯30mL,充分振摇,再以500r/min离心3min,弃去油层,取水层振摇混匀,即为稀释剂对照液,取1mL,置含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液100mL中,采用薄膜过滤法,冲洗液为含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液,每次100mL,冲洗5次,测定细菌菌数,测定结果见附表6,计算回收率见附表7。霉菌和酵母菌数未采用特殊的方法处理,故稀释剂对照组可不进行验证。
将上述用于细菌计数的滤膜,贴于营养琼脂培养基平板上,置33℃培养3天,逐日观察结果,霉菌和酵母菌计数倾注玫瑰红钠琼脂培养基,待凝固后,置25℃培养5天,逐日观察结果。
经上述实验验证,采用拟定草案中的方法,可消除本品对细菌的抑菌作用,使细菌类验证菌的回收率能够达到要求;采用培养基稀释法即可使真菌类验证菌的回收率达到要求,方法可行。
3.2 控制菌检查方法的验证
3.2.1 菌液制备 接种大肠埃希菌、金黄色葡萄球菌的新鲜培养物至 10mL营养肉汤中, 33℃培养24h。用0.9%无菌氯化钠溶液9mL制成每1mL含菌数为10cfu~100cfu菌悬液。
3.2.2 控制菌(大肠埃希菌)检查用培养基适用性检查
3.2.2.1 胆盐乳糖培养基促生长能力和抑制能力检查 接种不大于100cfu的大肠埃希菌于被检培养基和对照培养基中,在33℃培养24h,结果显示,与对照培养基管比较,被检培养基管试验菌生长良好,符合规定。接种不少于100cfu的金黄色葡萄球菌于胆盐乳糖培养基中,在33℃培养24h,结果显示,未有菌生长,符合规定。
3.2.2.2 4-甲基伞形酮葡糖苷酸培养基(MUG)促生长能力和指示能力检查 接种不大于100cfu的大肠埃希菌于被检培养基和对照培养基中,在33℃培养5h,结果显示,与对照培养基管比较,被检培养基管试验菌生长良好,符合规定。与对照培养基管比较,被检培养基管荧光及指示剂反应一致,符合规定。
3.2.3 供试液的制备 取本品10g,加pH 7.0无菌氯化钠-蛋白胨缓冲液至100mL,振摇至供试品分散均匀,制成1∶10的供试品储备液,取供试品储备液50mL,以500r/min离心3min,取上清液,加入十四烷酸异丙酯30mL,充分振摇,再以500r/min离心3min,弃去油层,取水层振摇混匀,制成1∶10的供试液。
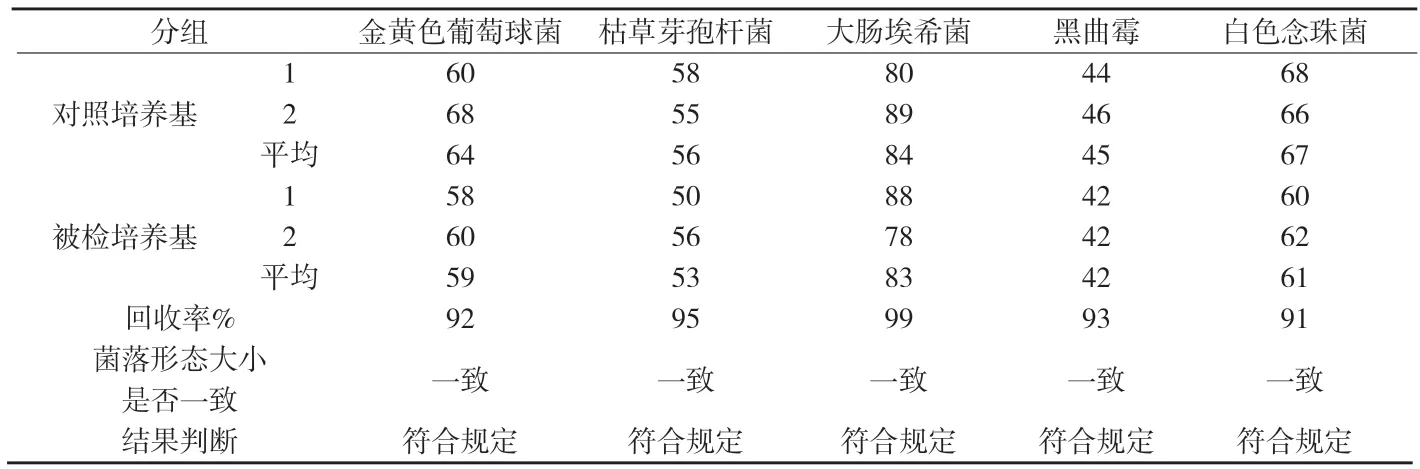
附表1 培养基适用性检查结果

附表2 菌液组菌落计数(cfu)

附表3 供试品组菌落计数(cfu/皿)

附表4 试验组菌落计数(cfu/皿)
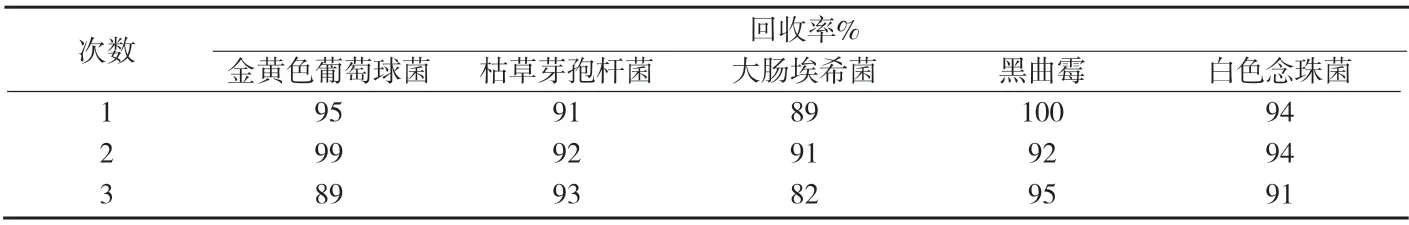
附表5 试验组回收率测定结果

附表6 稀释剂对照组菌落计数(cfu)

附表7 稀释剂组回收率测定结果表
3.2.4 大肠埃希菌检查方法的验证
3.2.4.1 供试品组 取供试液5mL加至含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液100mL中,用薄膜过滤器过滤,以含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液为冲洗液,每次100mL,共冲洗5次,取滤膜,加至胆盐乳糖培养基100mL中,置 33℃培养24h,共制备2份。
3.2.4.2 阴性对照组 取稀释液10mL,加至含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液100mL中,用薄膜过滤器过滤,以含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液为冲洗液,每次100mL,共冲洗5次,取滤膜,加至胆盐乳糖培养基100mL中,置 33℃培养24h。
3.2.4.3 阳性对照组 取供试液5mL,加至含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液100mL中,用薄膜过滤器过滤,以含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液为冲洗液,每次100mL,共冲洗5次,取滤膜,加至胆盐乳糖培养基100mL中,加入上述大肠埃希菌菌液1mL(10cfu~100cfu),置33℃培养24h。
取上述培养物各0.2mL,分别加入含5mL的4-甲基伞形酮葡糖苷酸培养基(MUG)试管中,置33℃培养24h,观察结果,见附表8。结果显示,阳性对照菌生长良好,表明本品在该条件下对大肠埃希菌无抑菌作用或其抑菌作用可以忽略不计。说明采用该法进行本品的大肠埃希菌检查可行。
总之,前述拟定的方法草案可行。
4 方法学验证结论
微生物限度:取本品10g,加pH 7.0无菌氯化钠-蛋白胨缓冲液至100mL,振摇至供试品分散均匀,制成1∶10的供试品储备液,取供试品储备液50mL,以500r/min离心3min,取上清液,加入十四烷酸异丙酯30mL,充分振摇,再以500r/min离心3min,弃去油层,取水层振摇混匀,制成1∶10的供试液,取1∶10的供试液 1mL加入含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液9mL中,制成1∶100的供试液。细菌计数,取1∶100的供试液1mL,置含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液100mL中,用薄膜过滤法处理,以含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液为冲洗液,每次100mL,共冲洗5次,取滤膜,依法检查(《中国药典》2010年版二部附录ⅩⅠJ)。霉菌和酵母菌计数,取1∶10的供试品储备液1mL,注入5个平皿中,每皿0.2mL,依法检查(《中国药典》2010年版二部附录ⅩⅠJ)。大肠埃希菌检查,取1∶10的供试液5mL,置含3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液100mL中,用薄膜过滤法处理,冲洗方式同细菌计数项下,取滤膜,加至胆盐乳糖培养基100mL中,共制备2份,依法检查(《中国药典》2010年版二部附录ⅩⅠJ)。但1g供试品中,细菌数不得过1000cfu,霉菌和酵母菌数不得过100cfu,大肠埃希菌不得检出。

附表8 大肠埃希菌检查结果

附表9 供试品微生物限度检查结果
5 供试品的检查
按照上述确定的微生物限度检查方法检验供试品,结果符合规定,见附表9。
6 讨论
头孢克肟是具有较强抑菌活性的药物,在微生物限度检验中应采用适当方法消除其抑菌作用。本法采用3%聚山梨酯80和0.3%蛋黄卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液作为稀释液,离心沉淀后,加入十四烷酸异丙酯,充分振摇,以500r/min离心3min,使水油完全分离,弃去油层,将水层混匀,作为1∶10的供试液,最终以1∶100的稀释液为最低稀释级,分别运用培养基稀释法和薄膜过滤法制得供试品溶液,经验证,验证菌株均生长良好,适用本品的微生物限度检查。
