罗格列酮对急性高脂血症性胰腺炎大鼠干预研究
2013-10-19黄晓丽王国品王平汤玉蓉滕晓琨葛建新
黄晓丽 王国品 王平 汤玉蓉 滕晓琨 葛建新
罗格列酮对急性高脂血症性胰腺炎大鼠干预研究
黄晓丽 王国品 王平 汤玉蓉 滕晓琨 葛建新
随着人们生活水平的提高、饮食结构和生活习惯的改变,高脂血症性胰腺炎(hyperlipidemic pancreatitis,HLP)的发病率逐年升高,且HLP患者较非HLP患者的症状重、并发症多、预后差。高脂血症患者往往伴有体内脂肪组织增多,脂肪组织可释放脂肪细胞因子。肿瘤坏死因子-α(TNF-α)作为重要的脂肪因子之一,在HLP 中发挥重要作用。罗格列酮为选择性过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor,PPAR-γ)激动剂,具有增强细胞对胰岛素敏感性,减轻胰岛素抵抗等药理作用,在炎症调控中也起到一定作用 。本研究应用罗格列酮干预HLP和非HLP大鼠,观察胰腺组织TNF-α表达的变化,探讨罗格列酮保护HLP大鼠的作用机制。
一、材料和方法
1.实验动物与分组:雄性SD大鼠48只,体重200~250 g,购自浙江省实验动物中心,许可证号:SCXK(浙)2008-0033。按数字表法随机分为6组,每组8只。对照组大鼠用普通饲料喂养4周,开腹轻轻翻动十二指肠和胰腺后即关腹。高脂血症(HL)组大鼠用高脂饲料(77%普通饲料+20%猪油+3%胆固醇)喂养4周,术中亦仅轻轻翻动十二指肠和胰腺。非HLP(NHLP)组大鼠用普通饲料喂养4周,采用5%牛黄胆酸溶液(Sigma公司)逆行注入胰胆管方法制备急性坏死性胰腺炎(ANP)模型。HLP组大鼠用高脂饲料喂养4周后同法制备ANP模型。NHLP及HLP治疗组在NHLP及HLP大鼠造模后经股静脉注射10%DMSO溶解的罗格列酮(成都恒瑞制药有限公司)6 mg/kg体重。其他4组在术后经股静脉注射等容积生理盐水。术后12 h处死动物,取胰腺组织和血标本。
2.胰腺组织病理学检查:取部分胰腺组织常规固定、石蜡包埋、制片、HE染色,由2名病理医师读片,每片选取4个视野,根据Schmidt等[1]的标准从水肿、炎细胞浸润、出血、坏死4个方面评分,取均值,各单项平均分之和为病理总分。
3.血清TNF-α、三酰甘油(TG)和淀粉酶活性测定:ELISA法测定血清TNF-α水平,采用全自动生化分析仪检测血清TG水平及淀粉酶活性。
4.胰腺组织TNF-α mRNA表达检测:取100 mg新鲜胰腺组织,加入1 ml Trizol(Invitrogen公司)抽提总RNA,先应用逆转录酶M-MLV和Oligo(dT)引物(Promega公司)合成第一链cDNA。再取1 μl cDNA为模板,用PCR试剂盒(TaKaRa公司)进行扩增。引物序列:TNF-α(210 bp)上游5′-TAGCAAACCACCAAGCAG-3,下游:5′-GGTATGAAATGGCAAATCG-3′,内参GAPDH(470 bp)上游5′-TCAACGGCACAGTCAAGG-3′,下游5′-ACCAGTGGATGCAGGGAT-3′。PCR反应条件: 95℃ 5 min,94℃ 30 s、54℃ 35 s、72℃ 45 s,35个循环,72℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳分离、溴化乙啶染色,在凝胶影像分析仪(Bio-Rad ChemiDoc XRS)上成像并扫描,以TNF-α与GAPDH吸光度比值表示mRNA的表达水平。

二、结果
1.胰腺组织病理学改变:对照组胰腺组织无明显改变。HL组胰腺的部分细胞脂质空泡形成,中等量炎症细胞浸润,未见明显出血及坏死。NHLP组与HLP组胰腺实质大量坏死伴出血,间质显著充血、水肿,大量炎细胞浸润。NHLP治疗组与HLP治疗组胰腺实质坏死、出血、间质水肿、炎细胞浸润程度均较相应未治疗组减轻(图1)。NHLP组和HLP组胰腺病理评分显著高于对照组(P值均<0.01),HLP组评分又显著高于NHLP组及HL组(P<0.05、P<0.01),NHLP治疗组评分显著低于NHLP组(P<0.05),HLP治疗组显著低于HLP组(P<0.01,表1)。
2.血清TG及淀粉酶水平的变化:HL组及HLP组血TG浓度显著高于对照组(P值均<0.01),但罗格列酮治疗不降低血TG的水平。HL组与对照组的血淀粉酶活性比较差异无统计学意义,但NHLP组、NHLP治疗组、HLP组、HLP治疗组血淀粉酶活性均显著高于对照组(P值均<0.01),且HLP组亦显著高于HL组(P<0.05,表1)。罗格列酮治疗能显著降低HLP组的血淀粉酶活性,但不降低NHLP组血淀粉酶活性。

图1对照组(a)、HL组(b)、NHLP组(c)、NHLP治疗组(d)、HLP组(e)、HLP治疗组(f)的胰腺病理改变(HE ×100)
3.血清TNF-α浓度的变化:HL组、NHLP组、HLP组、NHLP治疗组、HLP治疗组血TNF-α浓度均显著高于对照组(P<0.05或<0.01),且NHLP组、HLP组、NHLP治疗组、HLP治疗组血TNF-α浓度均显著高于HL组(P值均<0.01,表1)。罗格列酮治疗能显著降低NHLP组及HLP组的血TNF-α浓度。
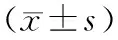
表1 各组大鼠血清TG、淀粉酶、TNF-α水平及胰腺组织病理学评分
注:与对照组比较,aP<0.05,bP<0.01;与HL组比较,cP<0.05,dP<0.01;与NHLP组比较,eP<0.05,fP<0.01;与HLP组比较,gP<0.05,hP<0.01
4.胰腺组织TNF-α mRNA表达水平的变化:对照组、HL组、NHLP组、HLP组、NHLP治疗组、HLP治疗组胰腺组织TNF-α mRNA表达水平分别为0.72±0.13、1.00±0.19、1.22±0.08、1.66±0.11、1.06±0.15、1.38±0.07(图2)。HL组、NHLP组、HLP组、NHLP治疗组、HLP治疗组TNF-α mRNA表达水平均显著高于对照组,且HLP组亦显著高于HL组(P值均<0.05),罗格列酮治疗能显著下调HLP组胰腺组织TNF-α mRNA表达(P<0.05),但NHLP治疗组与NHLP组胰腺组织TNF-α mRNA表达水平的差异无统计学意义。

图2对照组(1)、NHLP治疗组(2)、NHLP组(3)、HL组(4)、HLP治疗组(5)、HLP组(6)大鼠胰腺组织TNF-α mRNA表达
讨论TNF-α来源广泛,主要由单核细胞、巨噬细胞和T细胞产生,另外脂肪组织亦高表达TNF-α。文献报道[2-3],TNF-α与急性胰腺炎的发病密切相关。刘梅芳等[4]研究显示,TNF-α能够上调脂肪细胞内脂肪分化相关蛋白,并增加其磷酸化水平,促进脂肪细胞分解,释放大量脂肪酸(FFA),加重胰腺损伤。Suganami等[5]体外实验证实,FFA又可以刺激巨噬细胞产生TNF-α。因此,HLP大鼠体内形成FFA和TNF-α之间的恶性循环,导致脂肪酸和TNF-α大量释放,而两者均可加重胰腺损伤。本研究结果显示,NHLP组和HLP组胰腺病理组织学评分、血清淀粉酶活性明显高于对照组及HL组,HLP组和HL组血TG水平明显高于对照组,提示制模成功。HL组大鼠血TNF-α浓度及胰腺组织TNF-α mRNA表达均高于对照组大鼠,HLP组大鼠胰腺病理损伤较NHLP组重,血清TNF-α浓度及胰腺组织TNF-α mRNA表达均显著高于NHLP组,提示HLP大鼠胰腺组织TNF-α高表达及血清TNF-α水平升高是HLP时胰腺损伤加重的重要原因之一。
罗格列酮是高选择性PPAR-γ激动剂。有研究发现,激活PPAR-γ可以阻止脂多糖引起的单核细胞、HL60细胞与人体动脉内皮细胞结合,从而抑制TNF-α等致炎细胞因子表达,抑制炎症反应[6]。Hao等[7]报道,罗格列酮通过活化PPAR-γ,抑制了JAK-STAT信号通路的活化,进而抑制TNF-α mRNA的表达,减轻胰腺的病变损伤。Pini等[8]认为,罗格列酮能通过降低伴急性胰腺炎的肥胖大鼠内脏脂肪皂化和减轻红细胞生成抑制而提高大鼠的生存率、促进胰腺炎症恢复,但能促进伴急性胰腺炎的非肥胖大鼠胰腺腺泡和脂肪组织的坏死。本研究结果显示,HLP大鼠经罗格列酮治疗后胰腺病理学评分、血清TNF-α浓度、胰腺组织TNF-α mRNA表达均显著降低,而NHLP大鼠经罗格列酮治疗后血清TNF-α浓度显著降低,但胰腺病理组织学评分及胰腺组织TNF-α mRNA表达的下降不明显,提示罗格列酮对HLP的治疗效果较NHLP强,为临床应用此药提供一定的帮助。
[1] Schmidt J, Lewandrowsi K, Fernander-Del Castill C, et al. Histopathologic correlates of serum amylase activity in acute experimental pancreatitis. Dig Dis Sci,1992,37:1426.
[2] Bishehsari F, Sharma A, Stello K,et al. TNF-alpha gene (TNFA) variants increase risk for multi-organ dysfunction syndrome (MODS) in acute pancreatitis. Pancreatology, 2012,12:113-118.
[3] 郝云龙,闻勤生.急性坏死性胰腺炎与TNFA,IL-6,IL-8的关系及奥曲肽的作用.中国现代医学杂志,2002,12:29-30.
[4] 刘梅芳,俎鲁霞,徐冲,等.肿瘤坏死因子-α上调大鼠分化脂肪细胞脂肪分化相关蛋白水平及其机制.北京大学学报(医学版),2008,40:578-582.
[5] Suganami T,Nishida J,Ogawa Y.A panracrine loop between adipocytes and macrophages aggravates inflammatory changes:role of free fatty acids and tumor necrosis factor alpha.Arteriosecler Thromb Vasc Biol,2005,25:2062-2068.
[6] Jiang C,Ting AT,Seed B.PPAR-gamma agonists inhibit production of monocyte inflammatory cytokines.Nature,1998,391:82-86.
[7] Hao SX, Wang WX, Chen C,et al.The effect of rosiglitazone on the activity of STAT1 in rats with severe acute pancreatitis. Zhonghua Wai Ke Za Zhi, 2009, 47:218-221.
[8] Pini M, Rhodes DH, Castellanos KJ,et al.Rosiglitazone improves survival and hastens recovery from pancreatic inflammation in obese mice. PLoS One, 2012,7:e40944.
2013-01-14)
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2013.04.020
南通大学自然科学研究项目(10Z12)
210048 南京,南通大学附属南京江北人民医院消化内科
黄晓丽,Email:h_xiaoli2012@163.com
