胰腺癌组织Shh、Gli1、Sufu、TAK1、p-TAK1蛋白的表达及其临床意义
2013-10-19马丹满晓华高军李兆申
马丹 满晓华 高军 李兆申
·论著·
胰腺癌组织Shh、Gli1、Sufu、TAK1、p-TAK1蛋白的表达及其临床意义
马丹 满晓华 高军 李兆申
目的探讨Hedgehog信号通路重要成员Shh、Gli1、Sufu以及TAK1和磷酸化TAK1(p-TAK1)在胰腺癌组织中的表达及其与临床病理参数的相关性。方法应用免疫组化法检测38例手术切除的胰腺癌组织及其配对的癌旁胰腺组织中Shh、Gli1、Sufu、TAK1、p-TAK1蛋白的表达,分析它们与临床病理参数间的关系及它们相互间的关系。结果胰腺癌组织Shh、Gli1、Sufu、TAK1、p-TAK1蛋白的表达率分别为86.8%(33/38)、52.6%(20/38)、68.4%(26/38)、55.3%(21/38)、52.6%(20/38),而癌旁胰腺组织中的表达均为阴性。Gli1表达与肿瘤远处转移及临床分期呈正相关(r值分别为0.524、0.361,P值均<0.05);Sufu表达与患者性别相关(r=-0.378,P<0.05);TAK1表达与胰腺癌临床分期呈正相关(r=0.468,P<0.05);p-TAK1表达与临床分期、肿瘤远处转移呈正相关(r值分别为0.418、0.361,P值均<0.05)。胰腺癌组织中Gli1的表达水平与TAK1及p-TAK1呈正相关(P<0.05)。结论Hedgehog信号通路及TAK1途径在胰腺癌的发生、发展中具有一定作用,且两条途径可能存在一定的相互作用。
胰腺肿瘤; 免疫组织化学; Hedgehog信号通路; 丝裂原激活蛋白激酶激酶类
Hedgehog信号通路与胰腺癌的发生、发展密切相关[1]。丝裂原活化蛋白质激酶激酶激酶(MAPKKK)家族成员之一TGF-β激活激酶-1(TAK1)是炎症免疫、应激反应及肿瘤发生等过程中许多信号转导连锁反应的关键调控因子。近年文献报道,TAK1诱导的NF-κB激活与胰腺癌中Hedgehog通路的活化有关[2-3]。因此,本研究检测Hedgehog通路重要成员Shh、Gli1、Sufu以及TAK1和其活化形式磷酸化TAK1(p-TAK1)在胰腺导管腺癌及相应癌旁胰腺组织中的表达,分析Hedgehog信号通路与TAK1途径之间的关系及其与临床病理参数的相关性,探讨它们在胰腺癌发生中的作用。
材料与方法
一、标本来源
收集2010年9月1日至2012年9月11日第二军医大学附属长海医院胰腺外科手术切除的38例胰腺癌组织和配对的癌旁组织,同时收集相应病例的临床资料。所有患者术前均未行化疗和放疗。术后均经病理学检查诊断为胰腺导管腺癌。38例患者中男性23例,女性15例,年龄35~82岁,平均(60±11)岁。
二、Shh、Gli1、Sufu、TAK1、p-TAK1蛋白检测
手术切除标本常规固定、脱水、石蜡包埋、连续切片(厚度为4 μm),采用免疫组化EnVision染色法(二步法)检测Shh、Gli1、Sufu、TAK1、p-TAK1蛋白的表达。兔抗人Shh单抗、Gli1多抗、Sufu单抗、TAK1多抗、p-TAK1多抗均购自Abcam公司。Shh定位于细胞膜和细胞质,Gli1、Sufu、TAK1及p-TAK1定位于细胞核和细胞质。出现棕黄色或棕褐色颗粒为阳性染色。结果判断根据阳性细胞占总细胞数百分比以及阳性细胞染色强度。阳性细胞数≤5%为0分,>5%~≤25%为1分,>25%~≤50%为2分,>50%为3分;无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。将两分值相乘得到最终分值,0分为-,1~2分为+,3~4分为++,6~9分为+++。++或+++定义为表达阳性, -或+定义为表达阴性。
三、统计学处理
应用SPSS18.0软件进行统计分析。采用χ2检验及Fisher精确概率法分析胰腺癌组织中Shh、Gli1、Sufu、TAK1及p-TAK1表达水平之间的相关性及它们与临床病理参数的相关性,均采用双侧检验,P<0.05认为差异有统计学意义。
结 果
一、胰腺癌组织Shh、Gli1、Sufu的表达
Shh阳性表达于胰腺导管腺癌癌细胞的胞膜和胞质(图1),阳性表达率为86.8%(33/38),其中++ 26例,+++ 7例。Gli1、Sufu阳性表达于胰腺导管腺癌癌细胞的胞核和胞质(图1)。Gli1阳性表达率为52.6%(20/38),其中++ 15例,+++ 5例。Sufu阳性表达率为68.4%(26/38),其中++ 12例,+++ 14例。癌旁胰腺组织的导管、腺泡和胰岛中Shh、Gli1、Sufu的表达水平均阴性,胰腺癌组织此3种蛋白的表达均显著高于癌旁胰腺组织(P值均<0.05)。
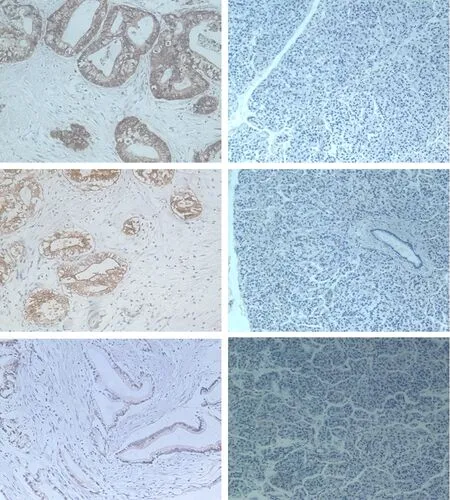
图1胰腺癌组织(左)和癌旁组织(右)Shh(上)、Gli1(中)、Sufu(下)蛋白的表达(免疫组化 ×200)
二、胰腺癌组织TAK1及p-TAK1的表达
TAK1及p-TAK1阳性表达于胰腺导管腺癌癌细胞的胞核和胞质,肿瘤细胞周围炎性细胞亦有不同程度的表达(图2)。TAK1阳性表达率为55.3%(21/38),其中++ 15例,+++ 6例。p-TAK1阳性表达率为52.6%(20/38),其中++ 18例,+++ 2例。癌旁胰腺组织导管、腺泡和胰岛中TAK1和p-TAK1表达阴性,胰腺癌组织TAK1及p-TAK1的表达均显著高于癌旁胰腺组织(P值均<0.05)。
三、胰腺癌组织Shh、Gli1、Sufu、TAK1、p-TAK1表达与肿瘤临床病理参数的关系
肿瘤临床病理参数包括患者年龄、性别、肿瘤部位、肿瘤最大径、淋巴结转移、远处转移、临床分期等。Shh表达与所有的临床病理参数均无关;Gli1表达仅与肿瘤远处转移及临床分期呈正相关(r值分别为0.524,0.361,P值均<0.05);Sufu表达只与患者性别相关(r=-0.378,P<0.05);TAK1表达只与胰腺癌临床分期呈正相关(r=0.468,P<0.05);p-TAK1表达与临床分期、肿瘤远处转移呈正相关(r值分别为0.418、0.361,P<0.05,表1)。

图2胰腺癌组织(左)和癌旁组织(右)TAK1(上)、p-TAK1(下)的表达(免疫组化 ×200)
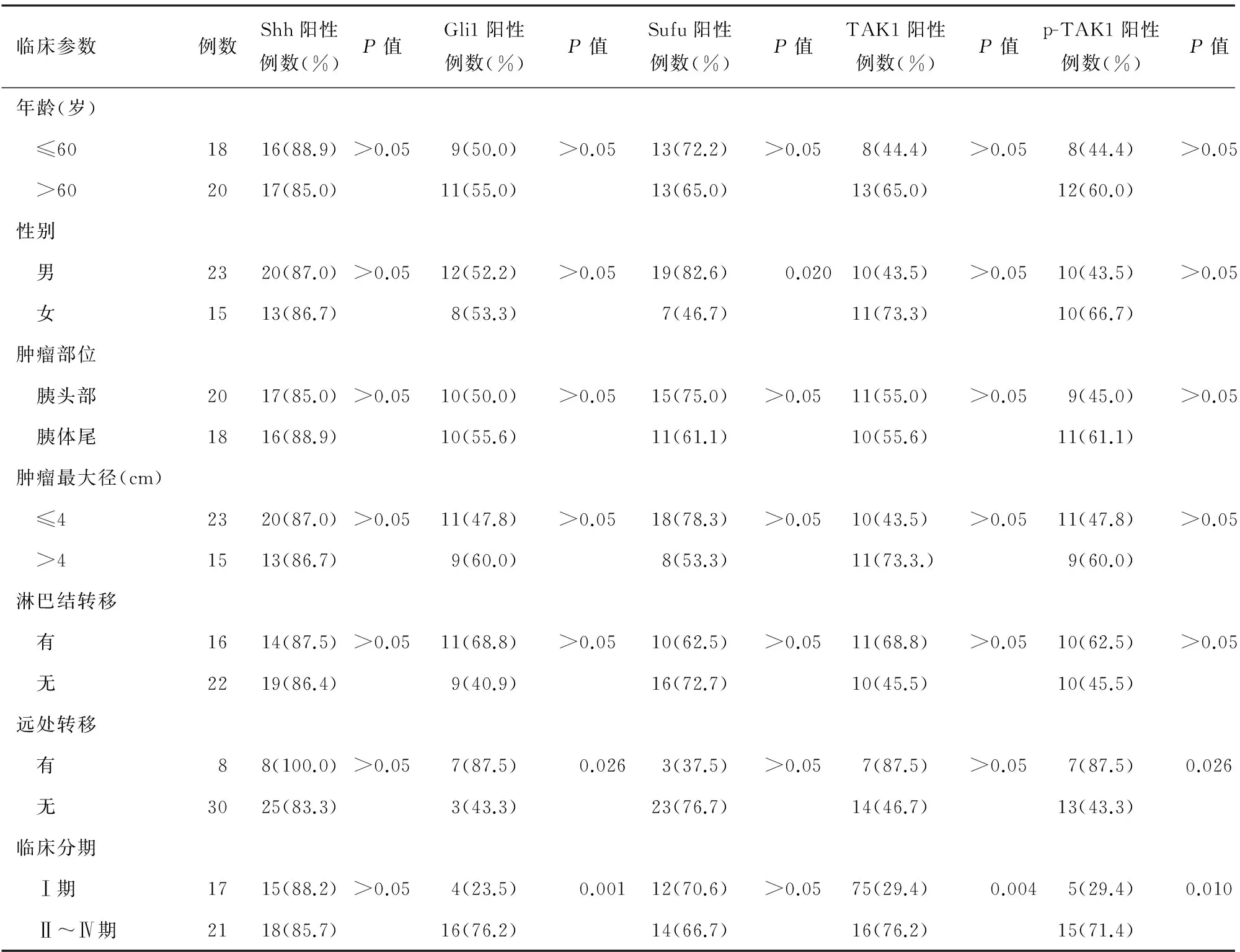
表1 胰腺癌组织中Shh、Gli1、Sufu、TAK1及p-TAK1表达与临床病理参数的关系
胰腺癌组织中Gli1的表达水平与TAK1及p-TAK1呈正相关(P<0.05),而Shh、Sufu的表达水平与TAK1、p-TAK1无相关性。此外,Shh、Gli1、Sufu三者间的表达水平均无相关性。
讨 论
Hedgehog(Hh)信号通路是胚胎发育的主要调控子,其产物控制细胞分化、增殖和组织成形。Hh信号通路由配体Hh、膜受体Ptch及Smo、Sufu、COS2、核转录因子Gli和下游靶基因组成。成人正常组织中Hh信号通路无活化或低活化,但在胰腺癌中Hh信号通路异常激活[1]。在小鼠的发育过程中,Shh的异常表达可引起类似于人胰腺癌的早期病变[4]。在胰腺癌早期及癌前病变阶段即可检测到Hh信号通路的激活。对不同时期的胰腺上皮内瘤变及胰腺癌进行分析,发现随着上皮内瘤变向胰腺癌的逐步发展,病变组织中Hh信号通路成员的表达水平也急剧上升。Shh、Ptch和Glil蛋白在胰腺癌组织中呈低到中度表达[5]。Sufu蛋白在胰腺癌组织中阳性表达,而在癌旁胰腺组织及正常胰腺组织中均未见表达[6]。本研究结果显示,胰腺癌组织中Shh、Gli1、Sufu呈高表达,与文献研究结果一致。通过与肿瘤临床病理参数关系的分析,胰腺癌组织中Gli1的表达与肿瘤远处转移及临床分期呈正相关,更进一步突出了Gli1在胰腺癌发生、发展中的作用。
TAK1是炎症免疫、应激反应及肿瘤发生等过程中重要的信号转导连锁反应的关键调控因子。有文献报道,TAK1通过活化NF-κB和激活蛋白-1(AP-1)参与胰腺癌对化疗药物的耐受性,沉默或抑制TAK1基因表达是逆转胰腺癌内在耐药性的有效方法[7]。本研究结果显示,胰腺癌组织中TAK1及其活化形式p-TAK1均高表达,而且TAK1的表达与胰腺癌临床分期呈正相关,p-TAK1的表达与临床分期及胰腺癌远处转移均呈正相关,证实TAK1途径亦在胰腺癌发生中起作用。TAK1通过多种形式广泛参与NF-κB的活化。而NF-κB的直接转录靶点之一便是Hh通路的配体Shh[8]。某些炎性因子(如IL-1β、TNF-α等)可通过激活NF-κB导致Shh的过度表达,进而激活Hh信号通路,促进胰腺癌细胞的增殖。本研究结果显示,胰腺癌组织中TAK1及p-TAK1的表达水平与Gli1存在相关性,亦提示在胰腺癌发展过程中两条途径可能存在协同作用,但其机制有待于进一步研究。
[1] Jones S, Zhang X, Parsons DW,et al. Core signaling pathways in human pancreatic cancers revealed by global genomic analyses. Science, 2008,321: 1801-1806.
[2] Nakashima H,Nakamura M,Yamaguehi H,et al.Nuclear factor-kappaB contributes to hedgehog signaling pathway activation through sonic hedgehog induction in pancreatic cancer. Cancer Res,2006,66:7041-7049.
[3] Yamasaki A, Kameda C, Xu R,et al. Nuclear factor kappaB-activated monocytes contribute to pancreatic cancer progression through the production of Shh. Cancer Immunol Immunother,2010, 59:675-686.
[4] Thayer SP,di Magliano MP,Heiser PW,et al.Hedgehog is an early and late mediator of pancreatic cancer tumorigenesis.Nature,2003,425:851-856.
[5] Quint K,Stintzing S,Alinger B,et al.The expression pattern of PDX-1,SHH, Patched and Gli-1 is associated with pathological and clinical features in human pancreatic cancer. Pancreatology,2009,9:116-126.
[6] 王云锋,满晓华,高军,等. SUFU在胰腺癌组织中的表达及其临床意义.中华胰腺病杂志,2010,6:418-420.
[7] Melisi D, Xia Q, Paradiso G,et al. Modulation of pancreatic cancer chemoresistance by inhibition of TAK1. J Natl Cancer Inst,2011,103: 1190-1204.
[8] Kasperczyk H, Baumann B, Debatin KM, et al. Characterization of sonic hedgehog as a novel NF-kappaB target gene that promotes NF-kappa B-mediated apoptosis resistance and tumor growth in vivo. FASEB J,2009,23:21-33.
ExpressionandclinicalsignificanceofShh,Gli1,Sufu,TAK1,p-TAK1proteininpancreaticcarcinoma
MADan,MANXiao-hua,GAOJun,LIZhao-shen.
DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
Correspondingauthor:LIZhao-shen.Email:Iizhaoshen111@yahoo.com.cn
ObjectiveTo investigate the expression of Hedgehog signaling pathway members, Shh, Gli1, Sufu and TAK1 as well as phosphorylation-TAK1(p-TAK1) protein in human pancreatic carcinoma tissues and to explore its relationship between the expression of proteins and the clinicopathologic parameters.MethodsThe expressions of Shh, Gli1, Sufu, TAK1, p-TAK1 proteins in 38 samples of pancreatic cancer tissues and pairing adjacent normal pancreatic tissues were detected by immunohistochemical method.The relationship among the proteins and the relationship between the expression of the proteins and the clinicopathologic parameters were examined.ResultsThe positive expression rates of Shh, Gli1, Sufu, TAK1, p-TAK1 protein in human pancreatic carcinoma were 86.8%(33/38), 52.6%(22/38), 68.4%(26/38), 55.3%(21/38), 52.6%(20/38), but they were not expressed in adjacent normal pancreatic tissues. Gli1 expression was positively related to distant metastasis and clinical staging (r=0.524, 0.361,P<0.05), Sufu expression was positively related to patient′s gender (r=-0.378,P<0.05), TAK1 expression was positively related to clinical staging (r=0.468,P<0.05), p-TAK1 expression was positively related to clinical staging and distant metastasis (r=0.418, 0.361,P<0.05). Gli1 expression was positively related to TAK1 and p-TAK1 expression in pancreatic cancer tissues (P<0.05).ConclusionsHedgehog signaling pathway and p-TAK1 may play a role in the pathogenesis of pancreatic cancer, and the two pathways may interact with each other.
Pancreatic neoplasm; Immunohistochemistry; Hedgehog signal pathway; Mitogen-activated protein kinase kinases
2013-03-18)
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2013.04.008
重大国际合作项目(30910103911)
200433 上海,第二军医大学长海医院消化内科
李兆申:Email:Iizhaoshen111@yahoo.com.cn
