稀碱-浓盐法提取硫酸软骨素工艺条件的研究
2013-10-18于童童徐丽萍
付 莹,王 鑫,于童童,徐丽萍
(1.哈尔滨商业大学食品工程学院省高校食品科学与工程重点实验室,哈尔滨150076;2.华中农业大学食品科技学院,武汉430070)
硫酸软骨素(Chondroitin Sulfate,简称CS)是一种酸性黏多糖,广泛存在于哺乳动物的软骨、喉骨、鼻骨和器官中,主要通过共价键与核心蛋白质相连,以蛋白聚糖的形式存在.具有多种同分异构体,根据硫酸基在半乳糖上的位置不同主要分为硫酸软骨素A(CSA)和硫酸软骨素B(CSC)[1].硫酸软骨素为白色或微黄色粉末,具有吸湿性,易溶于水而成黏度较大的溶液,难溶于甲醇、乙醇、丙酮等有机溶剂.硫酸软骨素遇热不稳定,具有降血脂、抗氧化、抗病毒、抗肿瘤及预防关节炎等重要生理功能[2-4].作为食品添加剂,硫酸软骨素可用于食品的乳化、保湿和祛除异味.在化妆品中添加硫酸软骨素,可调节皮肤的细胞代谢,促进营养的吸收,保持皮肤的水分和改善发质.因此,从低成本的猪软骨中提取开发硫酸软骨素食品及保健品具有十分广阔的前景[5-7].
1 材料与方法
1.1 实验材料
猪月牙骨,市售.
1.2 主要试剂与仪器
无水乙醇(天津市天博迪化工有限公司);氢氧化钠(黑龙江阿城化学试剂厂);盐酸(哈尔滨新达化工厂);氯化钠(天津市精细化工开发开发中心);FZ102机型微型植物粉碎机(天津市泰斯特仪器有限公司);TDL80-2B型低速台式离心机(上海安亭科学仪器厂);恒温水浴振荡器(上海一恒科学仪器有限公司);DK-98-1型电子恒温水浴箱(天津市泰斯特仪器有限公司);ALC-1100.2型电子分析天平(北京赛多利斯仪器系统有限公司);便携式pHS-3C型数字精密pH计(中国上海仪器厂);TU-1900型紫外可见分光光度计(北京普析通用仪器有限责任公司)
1.3 实验方法
1.3.1 浸取
称取5份3 g猪软骨,分别置于烧杯中,按照一定的料液比,加入一定体积分数的NaOH溶液,再根据总溶液的体积加入NaCl使溶液达到一定浓度,校正pH值为12~13,水浴振荡24 h(温度恒定)后过滤备用.
1.3.2 盐酸盐解
采用2 mol/L的HCl调节滤液pH值为7~8,升温至80~90℃,保持20 min,冷却静置后过滤,得盐解液.
1.3.3 除酸性蛋白
将盐解液调节pH值为2~3,搅拌10 min,静置.存放后过滤至澄清,调节pH值达到6.5,加2倍去离子水,使溶液的NaCl浓度为1 mol/L.
1.3.4 沉淀干燥
上述溶液加入95%的无水乙醇,使乙醇的体积分数达到50%~60%,存放至清,虹吸除上清液,沉淀抽干,并用无水乙醇洗3~4次,脱水干燥,即得硫酸软骨素成品[8].
1.3.5 稀碱-浓盐法提取硫酸软骨素单因素条件的选择
根据实验条件和相关资料确定几个对硫酸软骨素得率有影响的因素,即碱液浓度、提取温度、料液比和Na+浓度对硫酸软骨素得率的影响.以选定的方法进行单因素实验,即改变某一条件,固定其他条件,测定硫酸软骨素得率[9].其结果也为正交试验的进行奠定了基础.
1)碱液浓度单因素试验
称取5份3 g猪软骨,分别置于烧杯中,按照1∶6的料液比,分别加入1.5%,2%,2.5%,3%,3.5%的NaOH溶液,再根据总溶液的体积加NaCl使浓度达到3.5 mol/L,校正pH值为12~13,控温40℃,水浴振荡24 h(温度恒定)后过滤备用.按照1.3.2-1.3.4法进行盐酸盐解、除酸性蛋白、沉淀干燥等试验得成品.
2)料液比单因素试验
称取5份3 g猪软骨,分别置于烧杯中,分别按照1∶5,2∶11,1∶6,2∶13,1∶7的料液比,加入2%的NaOH溶液,再根据总溶液的体积加NaCl使浓度达到3.5 mol/L,校正pH值为12~13,控温40℃,水浴振荡24 h(温度恒定)后过滤备用.按照1.3.2及1.3.4法进行盐酸盐解、除酸性蛋白、沉淀干燥等试验得成品.
3)Na+浓度单因素试验
称取5份3 g猪软骨,分别置于烧杯中,按照1∶6的料液比,加入2%,的NaOH溶液,再根据总溶液的体积分加NaCl使浓度分别达到2、2.5、3、3.5、4 mol/L,校正pH值为12~13,控温40℃,水浴振荡24 h(温度恒定)后过滤备用.按照1.3.2及1.3.4法进行盐酸盐解、除酸性蛋白、沉淀干燥等试验得成品.
4)提取温度单因素试验
称取5份3g猪软骨,分别置于烧杯中,按照1∶6的料液比,加入2%的NaOH溶液,再根据总溶液的体积加NaCl使浓度达到3.5 mol/L,校正pH值为12~13,分别控温25、30、35、40、45℃,水浴振荡24 h(温度恒定)后过滤备用.按照1.3.2~1.3.4法进行盐酸盐解、除酸性蛋白、沉淀干燥等试验得成品.
1.3.6 硫酸软骨素最佳工艺条件的选择
根据单因素实验的结果与分析,选择影响稀碱-浓盐法提取硫酸软骨素的四个主要因素分别为:碱液体积分数(A)、料液比(B)、Na+浓度(C)和提取温度(D),采用正交设计表L9(34)安排正交实验.因素水平表见表1.

表1 正交实验的因素和水平
1.3.7 定性定量分析实验
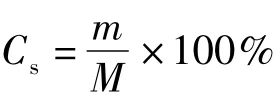
1)硫酸软骨素得率的计算其中:m为提取的硫酸软骨粗品的质量,g;M为猪软骨原料的质量,g.
2)紫外可见光谱检测
取一定体积硫酸软骨素标准或样品溶液,置于10 mL具塞试管中,准确加入蒸馏水使溶液体积至1.00 mL,置于冰水浴中冷却,然后分别加入6 mL浓硫酸,其间注意避免出现沸腾现象,盖塞振荡均匀后置于沸水中加热20 min,取出放于冰水浴中冷却.向水解后的溶液中加入0.20 mL咔唑溶液,摇匀后置于沸水中加热15 min,显色,取出迅速置于冰水浴中冷却至室温.采用无醛乙醇作空白溶液,用TU-1900型双光束紫外分光光度计在400~600 nm波长范围内扫描确定硫酸软骨素最大吸收波长.样品溶液采用此方法测定最大吸收波长与标准品对照.
2 结果与讨论
2.1 稀碱-浓盐法提取硫酸软骨素单因素结果与分析
选取影响稀碱-浓盐法提取硫酸软骨素效果的主要因素:碱液体积分数、料液比、Na+浓度、提取温度,分别进行单因素实验,以硫酸软骨素得率为指标,确定各因素对硫酸软骨素得率的影响,为正交试验提供依据.
2.1.1 碱液体积分数单因素实验结果与分析
实验结果显示,随着碱液体积分数的上升硫酸软骨素的得率先逐渐升高然后逐渐下降.在碱体积分数为2%时Cs得率最高,随着碱液体积分数大于2%时,硫酸软骨素的释出率逐渐降低,这可能是由于随着碱液体积分数的增大,处于糖链还原端的糖基在碱性条件下,逐渐生成间糖酸和异糖酸而脱落降解,是Cs得率降低.因此,选定碱液体积分数为2%为最佳.见图1.
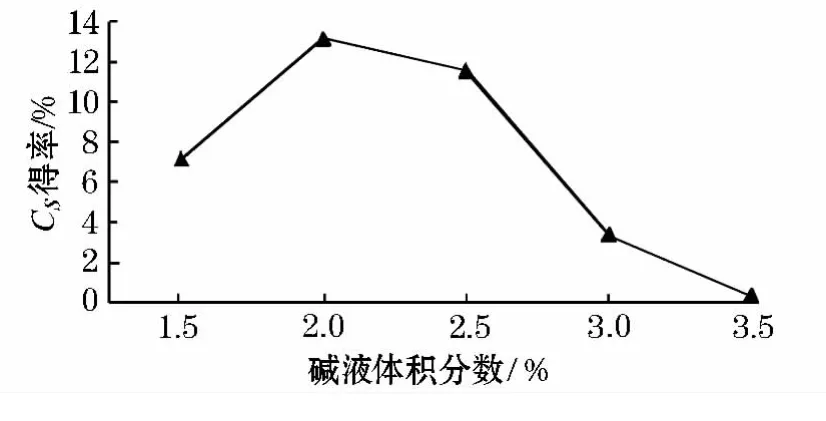
图1 碱液体积分数对硫酸软骨素得率的影响
2.1.2 料液比单因素实验结果与分析
实验结果显示,随着料液比的提高硫酸软骨素的得率先大幅上升然后逐渐下降.在料液比为1∶6时得率达到最高,但当料液比高于1∶6时,硫酸软骨素的得率逐渐下降,故最佳料液比为1∶6左右.由于实验是以3 g猪软骨为原料的,如果料液比过小,溶剂量就相应很少,导致溶液稠度较高,不利于多糖的浸出;所以在一定范围内,增大料液比可以使得原料与碱液充分发生反应,降解更彻底,进而提高得率,但过高的料液比会使得碱液体积分数下降,从而也不利于硫酸软骨素的浸提.见图2.

图2 料液比对硫酸软骨素得率的影响
2.1.3 Na+浓度单因素实验结果与分析
实验结果显示,随着Na+浓度的升高Cs的得率先大幅上升保持一段平稳后又大幅下降.Na+浓度在3 mol/L时硫酸软骨素的得率达到最大.故最佳Na+浓度为3 mol/L左右.高浓度的盐可使游离出的蛋白质沉淀完全,盐浓度不能过低,否则产品的澄清度就会下降,蛋白质清楚不完全,导致硫酸软骨素的得率减少.但过高浓度的盐不仅会造成浪费,而且也会降低硫酸软骨素的得率.见图3.

图3 Na+浓度对硫酸软骨素得率的影响
2.1.4 提取温度单因素实验结果与分析
实验结果显示,浸取时温度越高,胶原蛋白溶涨的速率越快,硫酸软骨素就越容易解离出来.在提取温度为40℃时,硫酸软骨素的得率达到最高点,振荡温度继续升高时,硫酸软骨素的得率就逐渐下降,如果提取温度大于50℃,溶液变为橙红色,说明硫酸软骨素分解,严重影响最终得率.故最佳浸取提取温度为40℃左右.见图4.
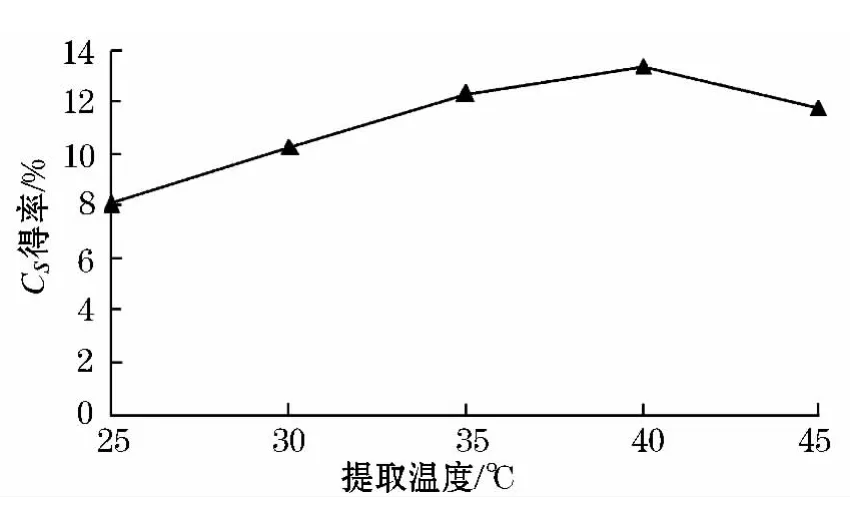
图4 提取温度对硫酸软骨素得率的影响
2.2 稀碱-浓盐法提取硫酸软骨素最佳条件结果与分析
通过正交实验确定最佳提取方法,考察指标为硫酸软骨素得率(%),其实验结果见表2.

表2 正交实验的结果表
2.3 直观分析
为了探索更好的实验条件的取值方向,以各因素的水平为横坐标,均值K为纵坐标绘制因素与水平直观图,结果见图5.

图5 直观分析图
通过比较正交试验表中各因素的极差值(R),由图5可以看出,影响硫酸软骨素得率因素顺序为A>D>B>C,最佳提取条件为A3B2C1D1,即2.5%NaOH溶液,料液比1∶6,Na+浓度2.5 mol/L,提取温度35℃.
2.4 方差分析
对正交试验做方差分析,分析出对实验影响显著的因素有哪几项,其结果见表3.由表3可知,其中的碱液体积分数影响效果显著.
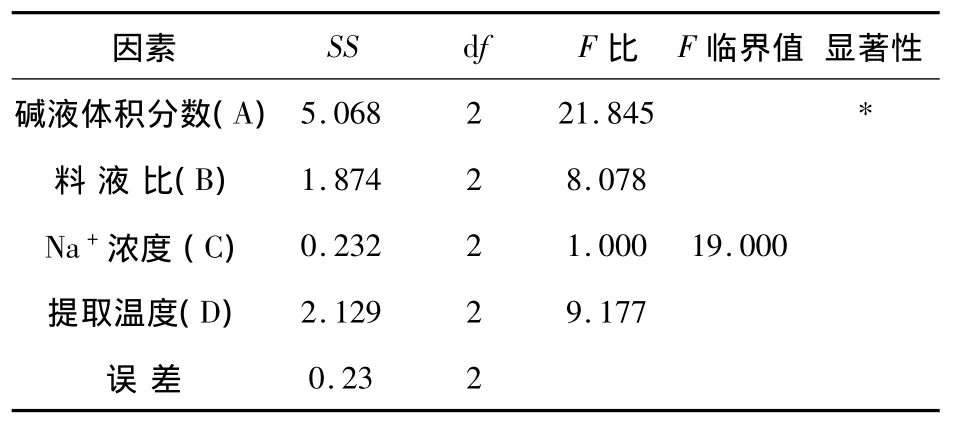
表3 方差分析表
由表3的方差分析可知,各因素对稀碱-浓盐法对硫酸软骨素得率影响的大小顺序为A>D>B>C,即碱液体积分数>提取温度>料液比>Na+浓度,最佳的因素水平组合为A3B2C1D1,即2.5%NaOH溶液,料液比1∶6,Na+浓度2.5 mol/L,提取温度35℃.经验证试验得稀碱-浓盐法提取硫酸软骨素的得率为14.54%.
2.5 定性试验结果与分析
如图6.硫酸软骨素标准溶液在400~600 nm波长范围扫描可见硫酸软骨素溶液在526 nm有最大吸收峰.样品与标准品出峰位置一致,证明提取物质为硫酸软骨素.
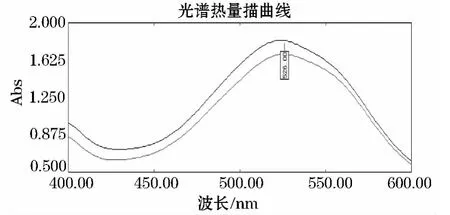
图6 硫酸软骨素标品与样品紫外扫描图谱
3 结语
采用稀碱-浓盐法提取猪软骨中的硫酸软骨素,考察不同因素(即碱液体积分数、料液比,提取温度、Na+浓度)对其提取效果的影响,采用正交试验确定最佳提取工艺并通过紫外光谱法对其进行检测,得出以下结论:硫酸软骨素的最佳提取工艺条件为:2.5%NaOH溶液,料液比1∶6,Na+浓度2.5 mol/L,提取温度35℃.经验证试验,硫酸软骨素的得率为14.54%,由方差分析证明,碱液体积分数对硫酸软骨素的得率影响效果显著.通过紫外光谱法检测,结果表明提取出物质与硫酸软骨素标准品峰形位置一致,进一步证明从猪软骨提出的物质是硫酸软骨素.
[1]李 鑫,姚 开,贾冬英,等.硫酸软骨素的提取和纯化分离技术[J].天然产物研究与开发,2004,16(6):597-600.
[2]SIMANEK V,KREN V,ULRICHOVA J,et al.The efficacy of glucosamine and chondroitin sulfate in the treatment of osteoarthritis:Are these saccharides drugs or nutraceuticals[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2005,149(1):51-56.
[3]武中会.碱液对牦牛软骨素提取硫酸软骨素工艺的影响[J].兽禽业,2008(6):28-31.
[4]赵培城,高红林,朱顺达.猪硫酸软骨素提取工艺研究[J].食品科学,2004(4):14-17.
[5]DESAIRE H,LEARY JA.Detection and quantification of the sulfated disaccharides in chondroitin sulfate by electrospray tandem mass spectrometry[J].JAm Soc Mass Spectrom,2000,11(10):916-920.
[6]李瑞国.硫酸软骨素不同生产工艺的考察[J].中国医药杂志,2003,34(5):221-222.
[7]卢京光,姬胜利,张尊建.硫酸软骨素及其衍生物的研究进展[J].中国海洋药物杂志,2006,25(1):59-63.
[8]奚 俊,张有森.对硫酸软骨素传统提取方法的改进[J].生物学杂志,2000,17(6):33-35.
[9]孙华云,张明晶,姜成忠.硫酸软骨素片含盐酸氨基葡萄糖量的测定[J].哈尔滨商业大学学报:自然科学版,2011,27(3):282-283.
