响应面法优化超声辅助提取紫洋葱花色苷
2013-10-18褚银玲代丽君
褚银玲,吴 春,代丽君
(1.哈尔滨商业大学食品工程学院,哈尔滨150076;2.哈尔滨商业大学 管理学院,哈尔滨150028)
花色苷(anthocyanins)是花青素与糖以糖苷键结合而成的一类化合物,属于类黄酮,广泛存在于植物的花、果实、茎、叶和根器官的细胞液中,是使其呈现由红、紫红到蓝等不同颜色的物质基础.花色苷类物质由于其各种药理活性及可作为天然色素的良好来源而备受关注[1].花色苷具有抗氧化、清除自由基、抗突变活性、减轻肝功能障碍、降血糖以及抗肿瘤的功能.紫洋葱(red onion)富含花色苷,其花色苷提取物具有很强的抗氧化活性及其他功能性质[2].
超声辅助提取方法具有方便、快速、易操作、安全等优点,因此本实验采用超声辅助提取花色苷,并对影响提取因素进行研究.同时,应用响应面法优化其提取工艺条件,旨在提高紫洋葱中花色苷的提取率[3].
1 材料与方法
1.1 实验材料及仪器
1.1.1 原料与试剂
原料:紫洋葱(购于家乐福超市).
试剂:无水乙醇(天津市天力化学试剂有限公司),36%~38%HCl(哈尔滨市新达化工厂),氢氧化钠(天津市天新精细化工开发中心),邻苯二甲酸氢钾缓冲剂、四硼酸钠缓冲剂(上海雷磁·创业仪器仪表有限公司).
1.1.2 仪器
KQ3200DE型数控超声波清洗器(昆山市超声仪器有限公司),PHS-25型酸度计(上海伟业仪器厂),721E型可见分光光度计(上海光谱仪器有限公司),R-205旋转蒸发器(上海申胜生物技术有限公司),W201D恒温水浴锅(上海申胜生物技术有限公司),SHB-III循环水式多用真空泵(郑州长城科工贸有限公司).
1.2 实验方法
1.2.1 预处理
将紫洋葱剥开,切成小块,60℃烘干,粉碎处理后过60目筛避光保存备用[4].
1.2.2 提取方法
准确称取1.000 g预处理好的洋葱粉,按一定的固液比,加入一定体积分数的的乙醇,用盐酸调至pH值为2,在一定的温度,一定的时间下超声提取.提取液抽滤,而后定容至100 mL,并在530 nm下测吸光度[5].
1.2.3 总花色苷含量计算
总花色苷含量(mg/100 g)=(吸光度值×稀释倍数×浸提溶液的体积×100)/(原料质量×98.2),其中98.2是消光系数[6].
1.3 单因素实验[7]
1.3.1 乙醇体积分数对紫洋葱中花色苷提取的影响
准确称取1.00 g紫洋葱粉至100 mL磨口瓶中,加入乙醇体积分数分别为40%,50%,60%,70%,80%,90%的乙醇溶液,料液比为1∶30,提取时间为50 min,提取温度为50℃.
1.3.2 料液比对紫洋葱中花色苷提取的影响
准确称取1.00 g紫洋葱粉至100 mL磨口瓶中,加入乙醇体积分数为70%的乙醇溶液,料液比分别为1∶10、1∶20、1∶30、1∶40、1∶50、1∶60,提取时间为50 min,提取温度为50℃.
1.3.3 提取时间对紫洋葱中花色苷提取的影响
准确称取1.00 g子洋葱粉值100 mL磨口瓶中,加入乙醇体积分数为70%的乙醇溶液,料液比为1∶30,提取时间分别为10、20、30、40、50、60 min,提取温度为50℃.
1.3.4 提取温度对紫洋葱中花色苷提取的影响
准确称取1.00 g紫洋葱粉至100 mL磨口瓶中,加入乙醇体积分数为70%的乙醇溶液,料液比为1∶30,提取时间为50 min,提取温度分别为10、20、30、40、50、60℃.
1.4 响应面分析实验
在单因素实验结果基础上,综合考虑各因素对花色苷含量的影响,根据Box-Benhnken中心组合试验设计原理,采用四因素三水平的响应面分析方法[8],实验因素水平设计见表1.

表1 响应面实验因素水平表
2 结果与讨论
2.1 花色苷提取的单因素实验结果
2.1.1 乙醇体积分数对花色苷提取的影响
从图1中可以看出,随着乙醇体积分数的增大吸光度值也逐渐增大当达到70%时达到最大值,当大于70%时吸光度值逐渐减小.当乙醇体积分数小时,洋葱中一些可溶水性物质溶出不利于花色苷的提取,当乙醇体积分数过高时极性低反而不利于花色苷提取.
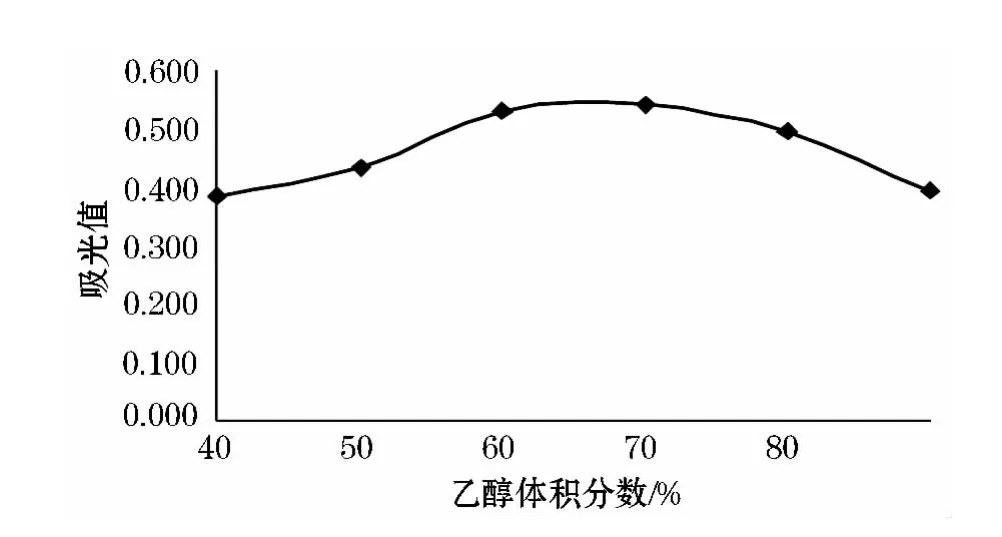
图1 乙醇体积分数对洋葱花色苷提取的影响
2.1.2 固液比对花色苷提取的影响
从图2中可以看出,随着固液比增加吸光度值也逐渐增大,当固液比为30 mL/g时达到最大值,当固液比再增大时吸光度值缓慢且趋于平稳,考虑到花色苷的提取率及原料等因素,固液比在20~40 mL/g时较为理想.
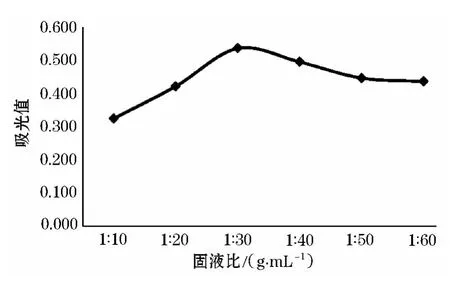
图2 固液比对洋葱花色苷提取的影响
2.1.3 提取温度对花色苷提取的影响
从图3中可以看出当温度增高时吸光度值明显增大.当温度达到50℃时达到最大值,高于50℃后吸光度值缓慢下降,从40℃后曲线变化平缓.由于随着温度升高有利于花色苷溶出和提取,当温度高于60℃时花色苷较不稳定.
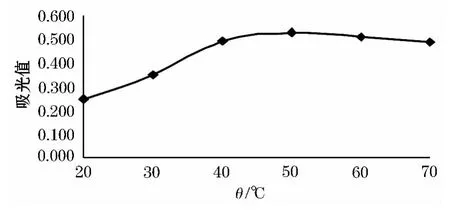
图3 温度对紫洋葱花色苷提取的影响
2.1.4 提取时间对花色苷提取的影响
从图4中可以看出,随着时间的增长,吸光度值逐渐增大,但当时间大于30 min后吸光度值缓慢增大且变化不明显.由于在提取时间为30 min时花色苷基本被提取出来.考虑节能因素时间在20~40 min较为理想.
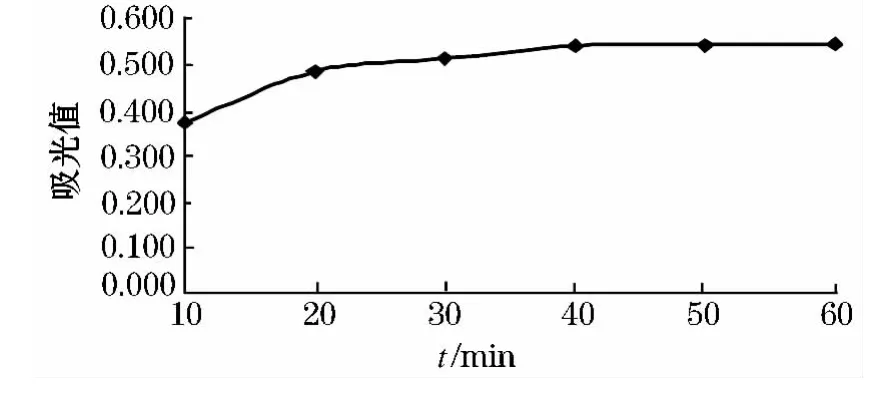
图4 时间对紫洋葱花色苷提取的影响
2.2 花色苷提取的响应面分析实验结果
2.2.1 花色苷提取响应面法实验方案和结果
由Box-Behnken设计实验方案及实验结果见表2,对表2实验结果进行拟合分析得到拟合方程模型为:Y=0.65+0.03A+0.01B-0.002 25C+0.007 916 667D-0.003 25AB+0.003 25AC-0.034 75AD-0.004BC+0.033BD-0.003 5CD-0.101 166 67A2-0.058 166 667B2-0.038 916 667C2-0.023 666 667D2.
2.2.2 显著性分析
由表3可知,模型效果显著回归模型(P<0.000 1),误差项不显著表明拟合方程与实际试验情况较为接近,因此可用该方程代替实验真实值进行实验分析.该方程表明一次项二次项对实验影响都较为显著.因此在一定范围内调整乙醇体积分数、固液比、时间、温度,可得到最佳提取条件[9-10].从表3中可知影响花色苷提取率的因素主次依次为乙醇体积分数(A)>固液比(B)>时间(D)>温度(C).
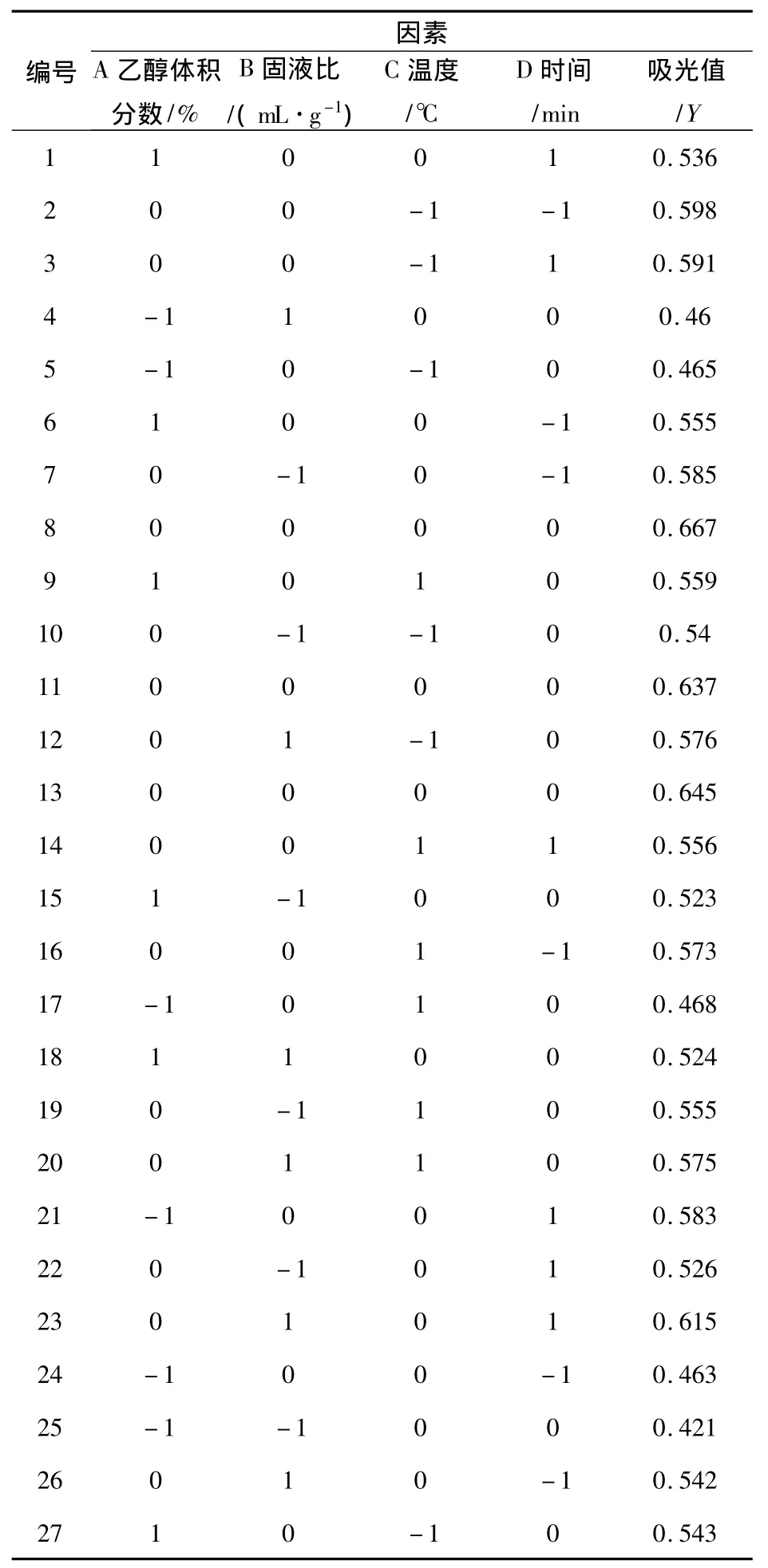
表2 实验方案和结果

表3 方差分析表
2.2.3 紫洋葱花色苷提取的响应面分析
从图5~10可知,乙醇体积分数和固液比交互作用显著,乙醇体积分数为50%~70%,固液比为20~40mL/g的交互范围内吸光度值有最高值,温度和乙醇体积分数交互作用以及乙醇体积分数和时间交互作用较为显著.固液比和时间的交互作用不明显,固液比和温度,时间和温度交互作用不明显.
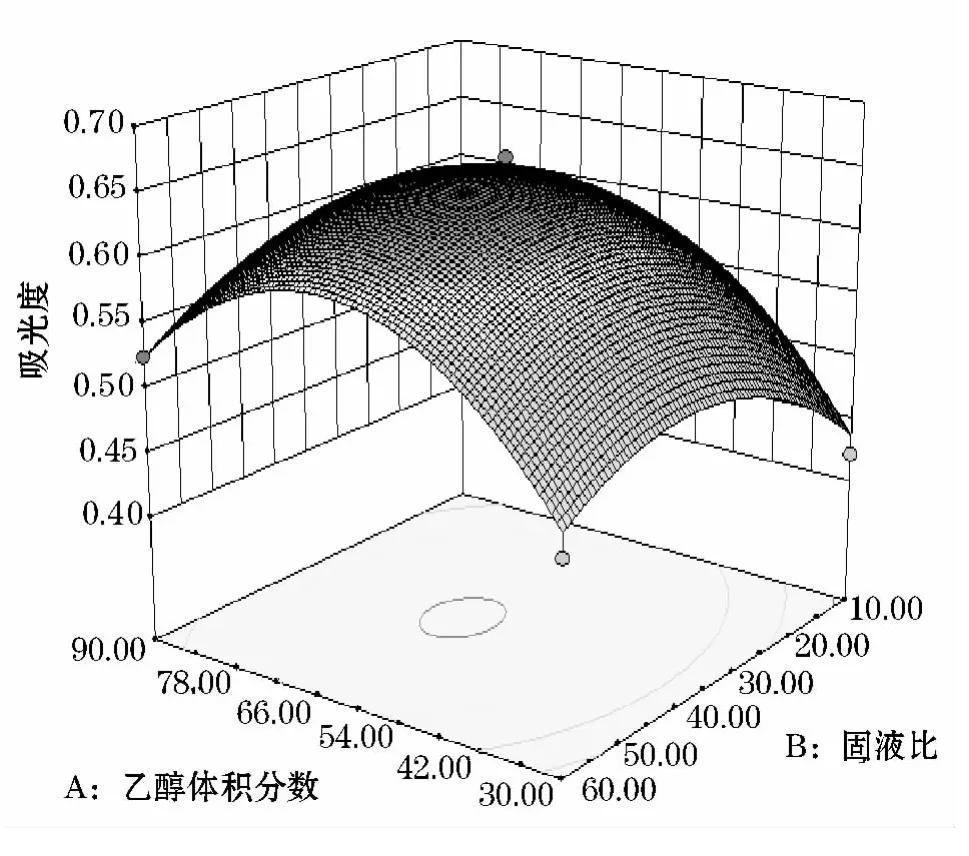
图5 乙醇体积分数固液比交互作用的曲面图
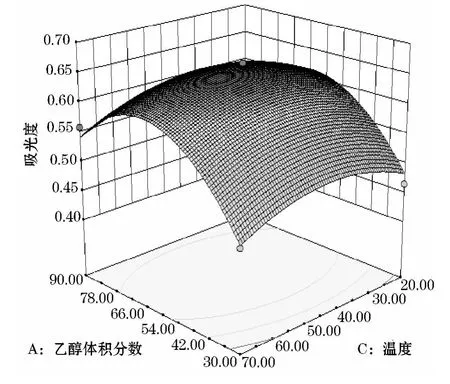
图6 温度和乙醇体积分数交互作用的曲面图

图7 乙醇体积分数和时间交互作用的曲面图

图8 固液比和温度交互作用的曲面图
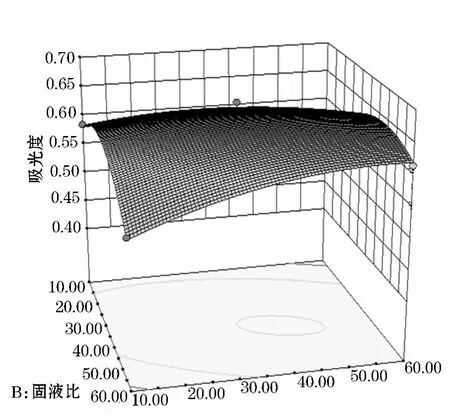
图9 固液比和时间交互作用的曲面图

图10 温度和时间交互作用的曲面图
为确定最大吸光度值即最优提取条件,通过对软件分析和拟合方程计算得到最优提取条件为:乙醇体积分数:72%,固液比:1∶30,温度:55℃,时间55 min.通过验证实验(采用最优条件并平行三次)得到吸光度值为0.674,此时花色苷得率为100.16 mg/g.
3 结语
通过响应面法分析实验,对紫洋葱花色苷最佳提取条件进行优化,并对实验结果进行分析得到拟合模拟方程.结果表明乙醇含量和固液比对紫洋葱花色苷提取显著,时间和温度对花色苷提取影响不明显.通过拟合方程得到最佳提取条件为:乙醇体积分数72%,固液比1∶30,温度55℃,时间55 min,此时花色苷得率为100.16 mg/g.
[1]张建霞,张 燕,孙志健,等.花色苷的资源分布以及定性定量分析方法研究进展[J].食品科学,2009,30(5):263-168.
[2]叶义全.夏枯草黄酮类成分提取与分离纯化技术研究[D].福州:福建农林大学,2010,10(4):123-138.
[3]章海燕,王 立,张 晖.基于响应面分析法优化的乌饭树树叶水溶性黄酮提取条件[J].食品工业科技,2010,23(6):232-243.
[4]贺 波.苎麻叶黄酮的提取、分离纯化、结构及抗氧化活性的研究[D].武汉:华中农业大学,2010,34(3):189-197.
[5]卢其能,杨 清.马铃薯花色苷研究进展[J].北方园艺,2007,33(9):54-57.
[6]王淑霞,李爱梅,张俊杰,等.响应面分析法优化龙眼核中多酚物质提取工艺[J].食品科学,2011,32(10):35-39.
[7]刘玉燕.超声波辅助提取菊苣根工艺优化及粗提物除草活性研究[D].杨 凌:西北农林科技大学,2011,34(7):256-270.
[8]王淑霞,李爱梅,张俊杰,等.响应面分析法优化龙眼核中多酚物质提取工艺[J].食品科学,2011,32(10):35-39.
[9]孟宪军,王冠群,宋德群,等.响应曲面法优化蓝莓花色苷提取工艺的研究[J].食品工业科技,2010,07(07):226-228.
[10]陆海莲,吴 春,刘 宁.AB-8大孔树脂对黑米花色苷的吸附性能研究[J].哈尔滨商业大学学报:自然科学版,2013,29(1):93-96.
