用6-溴吲唑合成阿西替尼的研究
2013-10-18彭国丽夏远亮
彭国丽,夏远亮
(1.南京金陵科技学院,南京210038;2.黑龙江八一农垦大学,黑龙江大庆163319)
阿西替尼(Axitinib),商品名为Inlyta,化学名为N-甲基-2-((3-((1E)-2-(吡啶-2-基)乙烯)-1H-吲唑-6-基)硫)苯甲酰胺(化合物1).由美国Pfizer公司开发的治疗对其他药物没有应答的晚期肾癌(肾细胞癌),2012年1月27日获美国FDA批准上市.阿西替尼是一种小分子酪氨酸激酶抑制剂,可阻止对肿瘤生长和转移起作用的某些被称为激酶的蛋白发挥作用,对多个靶点有效,包括血管内皮细胞生长因子受体(Vascular Endothelial Growth Factor Receptor,VEGFR)VEGFR1,VEGFR2,VEGFR3,血小板衍生生长因子受体(Platelet-derived growth factor receptor,PDGFR)和c-KIT.
1 合成方法
目前,阿西替尼合成方法主要有两种[1-4]方法,普遍使用的合成方法为:吲哚三位碘取代化合物和2-巯基-N-甲基苯甲酰胺成硫醚,然后吲哚六位转变成碘和2-乙烯基吡啶反应制备产物,流程如图1所示.

图1 阿西替尼合成路线
本研究参考相关文献[5-9]为基础,以6-溴吲唑和2-巯基-N-甲基苯甲酰胺[10~11]通过硫醚化、吲唑环溴化、Heck偶联制备阿西替尼(化合物1),此合成方法操作简单,后处理方便,反应温度温和,环境友好,收率较高,具体路线见图2.
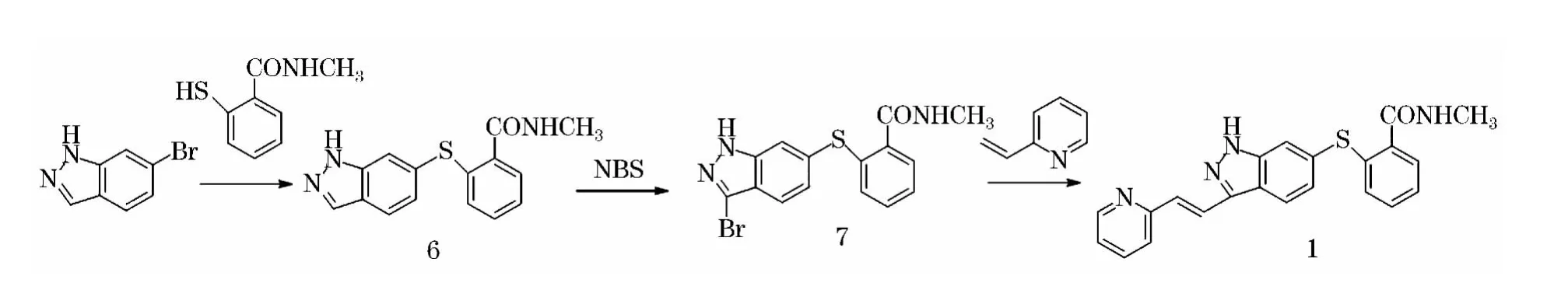
图2 阿西替尼合成路线
2 实验部分
2.1 仪器
1H NMR数据由JEOL-500MHz核磁共振仪(TMS为内标)测定;LCMS数据由HP5988A质谱仪测定;熔点由X-4型显微熔点测定仪(温度计未校正)测定.
2.2 合成
2.2.1 2-(1H-吲唑 -6-基硫烷基)-N-甲基苯甲酰胺(6)的合成
用氮气置换在2 000 mL四口烧瓶,在氮气保护下加入碘化亚铜(19.1 g,0.1 mol)、碳酸铯(293.2 g,1.0 mol)、2- 巯基 -N- 甲基苯甲酰胺[5](83.6 g,0.5 mol)、6- 溴吲唑(137.9 g,0.7 mol)、DMF(1 000 mL),避光在100℃搅拌、保温48 h,降温至室温,缓慢加入水(3 000 mL)中,用乙酸乙酯(3×800 mL)提取,用元明粉干燥,浓缩出约2/3溶剂,缓慢降温至0℃析晶,过滤,滤饼用冷乙酸乙酯洗涤.滤饼加入乙醇(360 mL)避光升温至回流,缓慢降温至0℃析晶,过滤,滤饼用冷乙醇-乙酸乙酯混合液洗涤.滤饼于60℃真空避光干燥8 h,得浅黄色固体6(96.3g,68%),LCMS:282.4[M-1],1H NMR(500MHz,CDCl3),10-6:13.35(1H,s),8.53(1H,s),7.56(1H,s),7.50~7.39(2H,m),7.36~7.24(3H,m),7.13(1H,dd),7.06~7.00(1H,m),2.77(3H,d).
2.2.2 2-(3-溴-1H-吲唑 -6-基硫烷基)-N-甲基苯甲酰胺(7)的合成
用氮气置换在1 000 mL四口烧瓶,在氮气保护下加入化合物2(70.8 g,0.25 mol)、二氯甲烷(600 mL),开启机械搅拌溶解底物,缓慢加入N-溴代丁二酰亚胺(48.1 g,0.27 mol),室温保温反应40 min,TLC(展开剂:V氯仿∶V甲醇=10∶1)检测反应完全.降温至0℃,缓慢滴加水(50 mL),加入二氯甲烷(200 mL),分层,用碳酸氢钠饱和溶液(100 mL)洗涤,用元明粉干燥,浓缩至干.残余物加入乙酸乙酯(500mL)避光升温至回流,缓慢降温至0℃析晶,过滤,滤饼用冷乙酸乙酯洗涤.滤饼加入乙醇(400 mL)避光升温至回流,缓慢降温至0℃析晶,过滤,滤饼用冷乙醇洗涤.滤饼于60℃真空避光干燥8 h,得淡黄色固体7(53.4g,59%),LCMS:363.5[M+1],1H NMR(500MHz,DMSO),10-6:13.35(1H,s),7.56(1H,s),7.50~7.39(2H,m),7.36~7.24(3H,m),7.13(1H,dd),7.06~7.00(1H,m),2.77(3H,d).2.2.3阿西替尼(1)的合成
用氮气置换在1 000 mL四口烧瓶,在氮气保护下加入化合物7(45.3 g,0.125 mol)、DMF(230 mL),开启机械搅拌溶解底物,加入2-乙烯基吡啶(20.0 g,0.19 mol)、N,N- 二异丙基乙胺(46 mL,36.0 g,0.28 mol)、三邻甲苯基膦(3.6 g,0.01 mol)、乙酸钯(1.0 g).升温至110℃避光反应40 h,TLC(展开剂:V氯仿︰V乙酸乙酯=3︰5)检测反应完全.降温至45℃,缓慢滴加异丙醇(380 mL),缓慢滴加水(1 500 mL),室温搅拌30 min,过滤,滤饼用水、异丙醇洗涤,滤饼于60℃真空避光干燥8 h.粗品用DMF(180 mL)溶解和活性炭(1.0 g)室温搅拌30min,过滤,再用有机滤膜(0.45μm)过滤1次.滤液在氮气保护下避光搅拌,缓慢升温至40℃,缓慢滴加异丙醇(140 mL),缓慢滴加水(1 000 mL),室温搅拌30 min,过滤,滤饼用水、异丙醇洗涤,滤饼于60℃真空避光干燥8 h,得类白色固体1(25.2g,52%),LCMS:387.8[M+1],1H NMR(500MHz,DMSO),10-6:13.35(1H,s),8.60(1H,d),8.38(1H,q),8.22(1H,d),7.96(1H,d),7.83(1H,m),7.66(1H,d),7.61(1H,s),7.58(1H,d),7.50(1H,dd),7.35~7.26(3H,m),7.20(1H,dd),7.05(1H,dd),2.77(3H,d).
3 结果与讨论
3.1 原料来源比较
本研究路线6-溴吲唑可以从市场上大规模的采购原料,价格低廉.文献[4]中以6-硝基吲唑通过碘化制备6-碘吲唑,而含碘化合物价格昂贵,一般适合实验室研发阶段的使用而难以工业化;化合物4再次碘化更使得合成原料成本增加很多,在成本上没有优势可言.
3.2 收率比较
本研究路线以6-溴吲唑为起始原料,通过三步反应合成,一次重结晶得到符合原料药要求的产物,总收率为20.86%;文献[4]中以6-硝基吲唑为起始原料,通过八步反应制备出粗品产物,合成总收率为9.21%.该合成方法相对参考文献有收率高、成本低、工业化占用设备少等优点.
3.3 后处理比较
本研究路线中合成方法仅通过常规的重结晶、真空干燥处理达到纯化中间体和成品的操作,该工艺能够适合工业化生产需要.而文献[1-2]中部分操作使用柱层析分离提纯产品,无法适合工业化生产.
总之,本研究工艺合成方法操作简单,反应温度温和,环境友好,收率较高.适合大规模工业化生产所需.
[1]EWANICKI B L,FLAHIVE E J,KASPARIAN A J,et al.Methods of preparing indazole compounds[P].US2006094881.
[2]BABU S,DAGNINOR J,OUELLETTEM A,etal.Methods of preparing indazole compounds[P].WO2006048745.
[3]ERIK F,BRIGITTE E,SHU Y,et al.A high-throughput methodology for screening solution-based chelating agents for efficient palladium removal[J].QSAR&Combinatorial Science,2007,26(5):679-685.
[4]ERIK JF,BRIGITTE L E,NEALW S,et al.Development of an Effective Palladium Removal Process for VEGFOncology Candidate AG13736 and a Simple,Efficient Screening Technique for Scavenger Reagent Identification[J].Organic Process Research&Development,2008(12):637-645.
[5]方 正.吲唑脲类化合物及其制法和药物用途[P].中国专利:2011100202989,2011-07-27.
[6]LIY M,LIX Y,WANG H F,et al.Efficient copper-catalyzed S-arylation of thiolswith aryl bromides and chloride[J].Synthesis,2010,(21):3602-3608.
[7]TAKAHIRO I,TOSHIAKIM.A general palladium-catalyzed coupling of aryl bromides/triflates and thiols[J].Organic Letters,2004,6(24):4587-4590.
[8]RAJSNER M,SVATEK E.Neurotropic and psychotropic agents.Part CXIII.Fluorinated tricyclic neuroleptics with prolonged effects;some new 8-chloro-3-fluoro-10-piperazino-10,11-dihydro dibenzo[b,f]thiepins[J].Collection of Czechoslovak Chemical Communications,1977,42(10):3079-3093.
[9]KOSRAT A,KENNETH G.Heterocyclic sulfonamide derivatives as inhibitors of Factor Xa[P].WO2007008145.
[10]ISHIZUMIK,ANTOKU F.Imide derivatives,their production and use[P].EP0196096.
[11]QIAN CG,CAIX.Vegfr Inhibitors Containing a Zinc Binding Moiety[P].WO2009036066.
