SORL1基因rs2070045单核苷酸多态性与遗忘型轻度认知功能障碍的关联分析
2013-10-18于会艳曾湘豫高芳堃
高 欣 于会艳 孙 亮 曾湘豫 刘 铭 杨 泽 高芳堃 秦 斌
阿尔茨海默病(Alzheimer’s disease,AD)是以进行性认知功能障碍和记忆损害为特征的神经系统变性性疾病。AD病因复杂,涉及到遗传、环境、代谢、病毒感染等多种因素。1991年,Goate A等发现早发家族性AD患者的21号染色体上淀粉样前体蛋白(amyloid precursor protein,APP)基因17号外显子发生了突变[1],由此人们对AD的研究进入了分子遗传学这一崭新的领域,对AD患者相关致病基因的筛查已成为近20年来研究的热点。轻度认知功能障碍(mild cognitive impairment,MCI)是介于正常老龄和痴呆的过渡阶段,相当一部分MCI患者会进展为AD。尤其是遗忘型 MCI(amnestic mild cognitive impairment,aMCI),其以记忆损害为主要表现,Mayo老年痴呆研究中随访一组患者,证明在第6年时大约80%的aMCI患者已转化为AD[2],而相应年龄的正常人群每年AD的发病率仅约1%~2%[3],因此越来越多的学者注重于aMCI的研究,尤其是aMCI向AD转化的相关因素和生物学标记。2007年Rogaeva等首次提出分 拣 蛋 白 相 关 受 体 1(sortilin-related receptor1,SORL1,又称SORLA或LR11)基因可能是AD患病的第二风险因子,研究发现遗传性或获得性的SORL1受体表达或功能改变[4],可能涉及AD发生的机制。目前对SORL1基因研究比较多的单核苷酸多态性(single nucleotide polymorphism,SNP)是SNP19(rs2070045),Meta分析表明rs2070045携带G等位基因的人群患AD的风险大于携带T等位基因的人群[5],但是SORL1基因rs2070045单核苷酸多态性在中国汉族aMCI人群中鲜有报道,本研究通过对aMCI患者SORL1基因rs2070045进行多态性检测,探讨该位点多态性与aMCI的相关性和风险。
1 对象与方法
1.1 研究对象 本研究样本人群来自国家自然科学基金“社区老年人轻度认知障碍综合筛查模式的研究”课题。于2011年1月~2011年6月在北京某社区经筛查得到aMCI患者139例,男41例,女98例,平均年龄(74.5±5.7)岁,作为aMCI组;体检正常者213例作为对照组,男82例,女131例,平均年龄(69.4±7.1)岁。对照组与aMCI组性别、文化程度、生活背景等相互匹配,并确定为无血缘关系的健康者。
1.2 方法
1.2.1 诊断标准 aMCI诊断标准参见文献[6]并略作修改:(1)记忆障碍是基本和主要的主诉;(2)有记忆减退的客观检查证据,记忆障碍的客观检查低于同年龄及教育程度1.5个标准差以上;(3)一般认知功能正常,精神状态简易速查表(mini-mental state examination,MMSE)总分≥24分;(4)日常生活能力保留,日常生活能力量表(activities of daily living scale,ADL)<26分(21项);(5)无痴呆,临床痴呆评定量表(Clinical Dementia Rating,CDR)为0.5分,没有足够的认知障碍诊断为痴呆,不符合美国神经病学、语言障碍和卒中-老年性痴呆和相关疾病学会(NINCDS-ADRDA)的有关痴呆的诊断标准;(6)排除其他神经系统疾病和其他躯体疾病导致的记忆力下降;(7)经汉密尔顿抑郁量表(hamilton depression scale,HAMD)筛查排除抑郁状态;(8)Hachinski缺血评分:以≤4分排除血管性认知障碍。每个病例根据病史体检量表测试成绩,结合CT或MRI进行反复讨论分析,最后作出诊断。对照组为同期入组相匹配的正常对照者,均符合(1)无记忆力减退主诉,无严重躯体疾病,检查合作;(2)MMSE总分≥26分;(3)CDR=0。排除标准:排除AD、血管性痴呆﹑帕金森氏性痴呆及脑器质性疾病所致的各种痴呆患者。排除正处于心血管、肺、肝、肾等重大躯体疾病急性期的患者,排除头部外伤史、特殊药物服用史等。两组间年龄性别差异不明显(P>0.05)。
采用的神经心理学量表:精神状态简易速查表(mini-mental state examination,MMSE)、临床记忆量表(clinical memory scale,CMS)、临床痴呆量表(Clinical Dementia Rating,CDR)、日常生活行为量表(activities of daily living scale,ADL)、Hachinski缺血积分表(hachinski ischaemic scale,HIS)及汉密尔顿抑郁量表(hamilton depression scale,HAMD)。
1.2.2 静脉血采集 在受检者知情同意情况下,清晨取空腹静脉血5 ml,血样加EDTA抗凝剂后保存于-80℃冰箱中,用于DNA提取。
1.2.3 基因组DNA提取及定量取EDTA抗凝的受试者静脉血0.5 ml,用全基因组DNA提取试剂盒抽提DNA,通过蛋白/核酸比色仪对提取的基因组DNA进行浓度和纯度的分析,根据测定结果将样本DNA稀释至20μg/μl的工作液置于4℃冰箱。
1.2.4 位点选择 SORL1基因rs2070045(G/T)SNP多态性位点。引物序列分别为上游引物:5’-AACGACTGGA CGGACTGGT-3’,下游引物5’-CGGATGAGTGCTGTCAACTGAG-3’,扩增产物长度为78 bp。
1.2.5 PCR反应 PCR反应体系10μl,其中包含DNA模板1μl,10×PCR Buffer 1μl,10mmol/L dNTP0.2μl,Taq DNA 聚合酶(5 U/μl)0.2μl,rs2070045上下游引物(10 pmol/μl)各0.2μl,1×LC-green PLUS饱和荧光染料1μl,寡核苷酸内参0.2μl(高温寡核苷酸内参与低温寡核苷酸内参4个片段各0.05μl),去离子水补充总体积至10μl。PCR反应条件为95℃预变性5 min后进入主循环,95℃ 变性30 s,55℃ 退火30 s,72℃延伸6 s,总共45个循环,完成后72℃延伸7 min,之后进行HRM分析之前的变性和复性处理,程序为95℃30 s,25℃2 min,94℃30 s,24℃4 min。

表1 HRM-PCR的引物序列、退火温度及其产物长度
1.2.6 HRM检测 将PCR产物移入HRM专用96孔板内,在 Lightscanner TMHR-I 96上进行HRM分析:从45℃开始,以0.3℃/s的斜率采集熔解曲线,到98℃结束,用Light-Scanner Call IT软件对采集后的曲线进行分析,判定基因型。
1.2.7 测序验证 根据HRM分析的不同曲线确定不同的基因型。从所得的不同基因型的个体中分别随机抽取5例样本进行测序验证。测序样本重新进 行 PCR 扩 增,上 游 引 物 为 5'-CCGGAGTGACGAGTACAA-3',下 游 引 物 为 5'-CTCGCTGATTTCTAAGGTCC-3',扩增片段长度为229bp。PCR反应体系30μl,包含 DNA 模板3μl,10×PCRBuffer 5μl,10mmol/L dNTP1μl,Taq DNA聚合酶(5 U/μl)1μl,上下游引物(10 pmol/μl)各0.6μl,去离子水补充总体积至30μl。PCR反应条件为95℃预变性5 min后进入主循环,95℃变性30 s,58.5℃退火30 s,72℃延伸45 s,总共35个循环,完成后72℃延伸7 min。PCR产物经8%聚丙烯酰胺凝胶电泳检测,凝胶成像系统观察合格后送华大基因测序部进行测序验证。
1.2.8 统计学处理 运用Hardy-Weinberg平衡检验研究样本的群体代表性。用比数比(OR)值及其95%置信区间(95%CI)来评价相对风险。实验数据中计量资料数据以±s表示,组间比较采用t检验,组间基因型频率及等位基因频率比较采用χ2检验,以P<0.05为差异显著性标准,采用SPSS 11.5软件。
2 结 果
2.1 SORL1基因rs2070045单核苷酸多态性的基因型分析 SORL1基因rs2070045单核苷酸多态性位点分为3种基因型:GG,GT,TT。通过HRM分型系统分析,可根据样本的熔解曲线差异,将所有样本分为3组基因型。3组之间的熔解曲线差异非常显著(图1)。每组中随机挑选5例样本进行测序验证,进行基因型的确定以及HRM分型结果准确性的评估。HRM分型的结果与测序的结果完全吻合,准确率为100%,测序图见图2。
2.2 SORL1基因rs2070045单核苷酸多态性的基因型与等位基因频率在aMCI患者和正常对照者中的分布 以Hardy-Weinberg平衡法检验aMCI组和正常对照组的基因型频率,等位基因的分布具有群体代表性(P>0.05)。
SORL1 rs2070045单核苷酸多态性基因型及等位基因频率分布见表2,三种基因型频率在aMCI组和对照组间的分布有显著差异(χ2=7.109,P=0.029),两种等位基因频率在两组间的分布也有显著差异(χ2=7.315,P=0.007)。G等位基因为危险等位基因(OR=1.528,95%CI为1.123~2.080),不同遗传模型下GG+GT基因型与对照组有显著差异(OR=1.873,95%CI为1.061~3.308),为危险基因型,GG纯合基因型与对照组也有显著差异(OR=1.658,95%CI为1.053~2.612),为危险基因型(表3)。
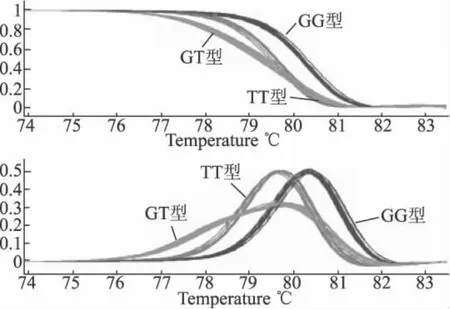
图1 SORL1基因rs2070045单核苷酸多态性HRM分型的熔解曲线 红色代表TT基因型,蓝色代表GG基因型,灰色代表GT基因型
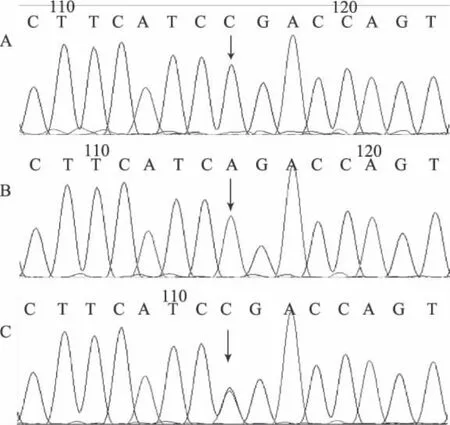
图2 SORL1基因rs668387单核苷酸多态性样本抽样测序图 (A图为GG型,B图为TT型,C图为GT型)

表2 SORL1基因rs2070045基因型和等位基因频率在aMCI组和对照组的分布[n(%)]
2.3 不同性别aMCI组与对照组SORL1 rs2070045基因型及等位基因频率比较 男性aMCI组与对照组SORL1基因型及等位基因频率分布无显著差异(表4),SORL1基因rs2070045不同遗传模型下基因型在男性aMCI组和正常对照组的分布无显著差异(表5),女性aMCI组与对照组基因型无显著差异但是等位基因频率分布有显著差异(表6),SORL1基因rs2070045不同遗传模型下基因型在女性aMCI组和正常对照组的分布无显著差异(表7)。
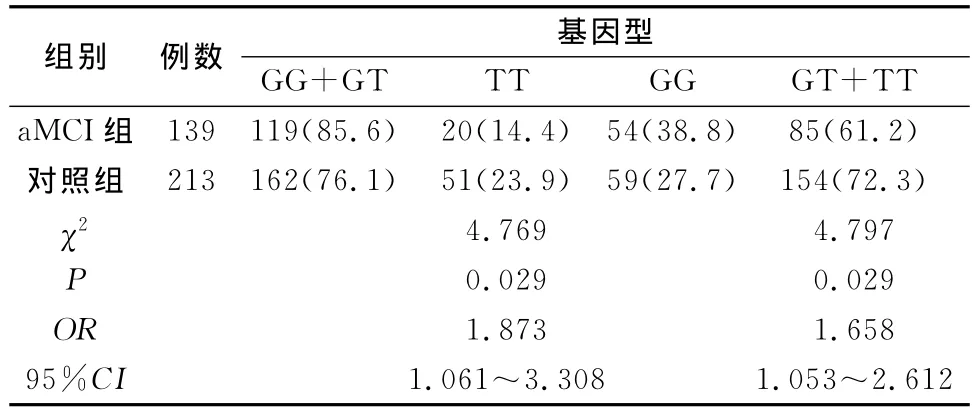
表3 SORL1基因rs2070045不同遗传模型下基因型在aMCI组和对照组的分布[n(%)]

表4 SORL1基因rs2070045基因型和等位基因频率在男性aMCI组和对照组的分布[n(%)]
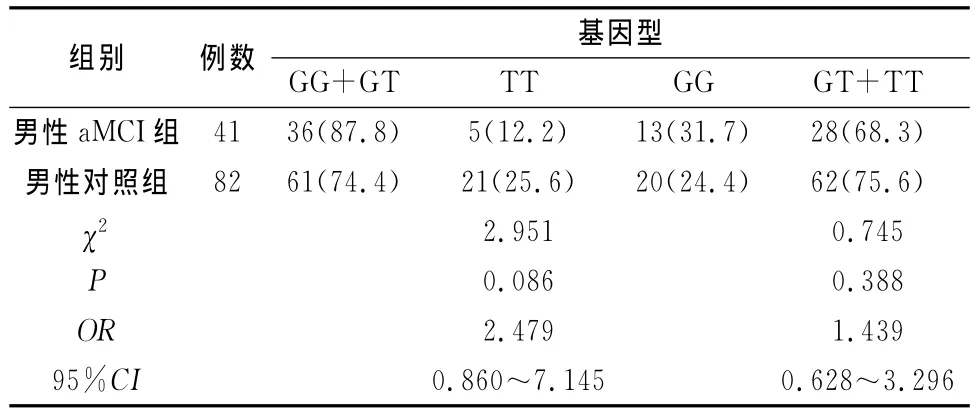
表5 SORL1基因rs2070045不同遗传模型下基因型在男性aMCI组和对照组的分布[n(%)]
3 讨 论
认知障碍的病因及致病机制目前仍不十分清楚,研究表明,除少数家族性AD外,绝大多数AD都呈散发性。散发AD由多因素及多基因导致,目前诸多等位基因中得到广泛证实是晚发型AD的风险因子的有APOEε4[7]。2007年Rogaeva等首次提出SORL1可能是AD患病的第二风险因子[4],但是对aMCI的遗传学研究仍然很局限,尤其是aMCI向AD转化的相关因素和生物学标记。由于缺乏aMCI有效的临床诊断方法,以及其发展的难以预测性,因此,以遗传学作为筛选aMCI易感人群的生物学标记物成为热点。如果能够发现与aMCI有关的致病基因,就有可能提高对aMCI的诊断,并作为预测aMCI病情发展的标记。从aMCI层面阐明和证实AD的易感基因,可以为AD患者的有效筛查、早期诊断、临床治疗和干预提供线索,具有重要的社会、经济和科学意义。
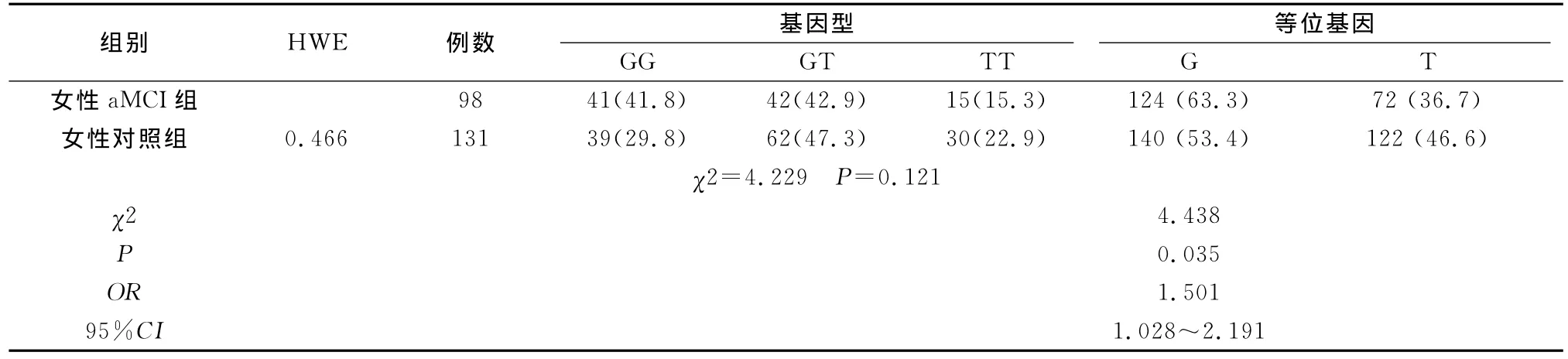
表6 SORL1基因rs2070045基因型和等位基因频率在女性aMCI组和对照组的分布[n(%)]
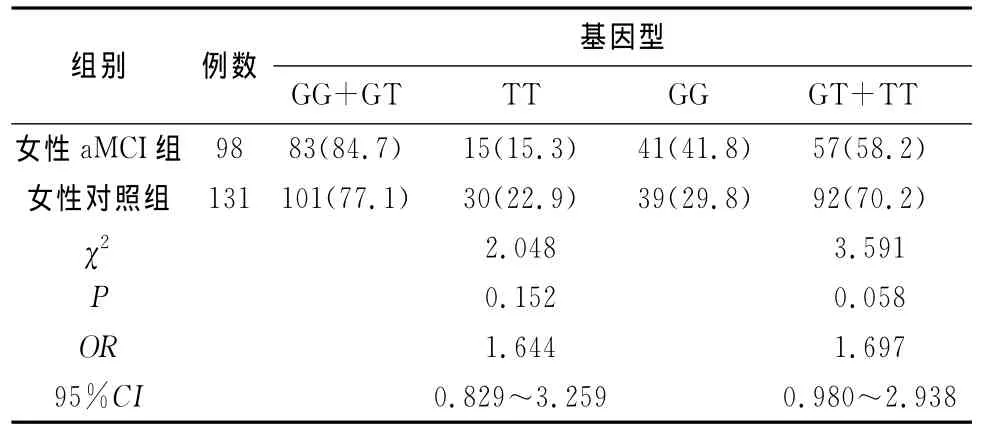
表7 SORL1基因rs2070045不同遗传模型下基因型在女性aMCI组和对照组的分布[n(%)]
SORL1基因位于人类11号染色体的长臂q 23.2-24.2区域,在神经细胞内表达,该基因编码的受体穿梭于质膜、内涵体和高尔基体,在神经元细胞中发挥转运作用。SORL1受体可以阻止APP形成Aβ,SORL1受体减少将导致脑内Aβ水平增高,从而导致AD的发生。自2007年Rogaeva等首先报道了对6个不同种群的SORL1基因序列中的单核苷酸多态性研究,关联分析表明SORL1基因的SNP与散发AD相关联,但也表现出不同种群的差异性[4]。在此之后,陆续有研究证实SORL1基因多态性与AD相关[8,9],但也有部分研究显示无明显关联[10,11]。与AD相关的SNPs位于SORL1基因的两个区域,靠近SORL1基因5’端的SNPs 8-10和3’端的SNPs 19-25。我们选取了SORL1基因5’端 的 SNP 8(rs668387)和 3’端 的 SNP19(rs2070045)、SNP23 (rs3824968)和 SNP24(rs2282649)4个位点进行了研究,除了rs2070045位点的基因型和等位基因频率在aMCI人群和正常对照人群中有显著差异外,其余3个位点未见差异(结果未显示)。
SORL1基因rs2070045位点野生型基因型为TT,存在GG和GT两种变异基因型。SORL1基因多态性与aMCI的关联尚未见报道,本研究发现,aMCI人群GG,GT,TT三种基因型与正常对照人群三种基因型分布频率有显著性差异(P<0.05),G等位基因频率在aMCI和正常对照有显著性差异(P<0.01),为危险等位基因(OR=1.528,95%CI为1.123~2.080),该位点G等位基因在女性中也是危险等位基因(OR=1.501,95%CI为1.028~2.191)。本研究结果提示北京汉族人群SORL1基因rs2070045位点的G/T SNP多态性与aMCI关联,G等位基因是危险等位基因,并且该等位基因在女性人群也是危险等位基因。该位点在西方人群中研究发现,携带G等位基因的人群患AD的风险大于携带T等位基因的人群[5];亚洲人群中日本人Kimura在晚发型AD人群研究中发现rs2070045位点G等位基因为风险等位基因[12],上海晚发型AD人群中发现rs2070045位点的G等位基因为风险等位基因[13],与本研究在aMCI人群中的发现一致,也就是说aMCI与AD具有相同的遗传背景,由于aMCI是AD的高危人群,说明从aMCI阶段预测其进展是可行的,可能对aMCI诊断和预测有帮助。
综上所述,本研究结果显示SORL1基因rs2070045位点G/T SNP多态性与aMCI相关联,并且在女性中得到了同样的结果,说明SORL1基因rs2070045位点单核苷酸多态性与aMCI相关,该位点G等位基因可能是aMCI的危险因素之一。但是在男性中没有看到相同结果,考虑可能与病例样本量少,分性别后导致样本量更少,或者是该危险因素与性别相关。由于aMCI人群具有向AD极高的转化率,因此从aMCI阶段寻找与患病相关的遗传因素,具有非常重要的意义。但是SORL1基因存在多个位点的SNP,并且有人群特异性,要明确该基因与aMCI的关系,还应选择更多位点进行更大规模人群的研究。
1 Goate A,Chartie2 Harlin M C,Mullan M,et al.Segregation of a missense mutation in the amyloid precursor protein gene with familial Alzheimer's disease.Nature,1991,349(6311):704-706.
2 Petersen RC,Parisi JE,Dickson DW,et al.Neuropathologic features of amnestic mild cognitive impairment.Arch Neurol,2006,63(5):665-672.
3 Petersen RC.Mild cognitive impairment:transition between ageing Alzheimer's disease.Neurologia,2000,15(3):93-101.
4 Rogaeva E,Meng Y,Lee JH,et al.The neuronal sortilin-related receptor SORL1 is genetically associated with Alzheimer's disease.Nat Genet,2007,39(2):168-177.
5 Reitz C,Cheng R,Rogaeva E,et al.Meta-analysis of the Association Between Variants in SORL1 and Alzheimer Disease.Arch Neurol,2011,68(1):99-106.
6 Winblad B,Palmer K,Kivipelto M,et al.Mild cognitive impair-ment-beyond controversies,towards a consensus:report of the International Working Group on Mild Cognitive Impairment.J Intern Med,2004,256(3):240-246.
7 Gatz M,Reynolds CA,Fratiglioni L,et al.Role of genes and environments for explaining Alzheimer disease.Arch Gen Psychiatry,2006,63(2):168-174.
8 Kölsch H,Jessen F,Wiltfang J,et al.Association of SORL1 gene variants with Alzheimer's disease.Brain Res,2009,1264:1-6.
9 Feulner TM,Laws SM,Friedrich P,et al.Examination of the current top candidate genes for AD in a genome-wide association study.Mol Psychiatry,2010,15(7):756-766.
10 Li H,Wetten S,Li L,et al.Candidate single-nucleotide polymorphisms from a genomewide association study of Alzheimer disease.Arch Neurol,2008,65(1):45-53.
11 Liu F,Ikram MA,Janssens AC,et al.A study of the SORL1 gene in Alzheimer's disease and cognitive function.J Alzheimers Dis,2009,18(1):51-64.
12 Kimura R,Yamamoto M,Morihara T,et al.SORL1is genetically associated with Alzheimer disease in a Japanese population.Neurosci Lett,2009,461(2):177-180.
13 Ning M,Yang Y,Zhang Z,et al.Amyloid-beta-Related Genes SORL1 and ACE are Genetically Associated With Risk for Lateonset Alzheimer Disease in the Chinese Population.Alzheimer Dis Assoc Disord,2010,24(4):390-396.
