丙肝核心抗原-CD40L胞外段真核表达载体的构建及其免疫原性分析
2013-09-26陈佳玉戚永孝金晓燕张丽荣
陈佳玉,戚永孝,陈 洁,金晓燕,张丽荣
(1.台州学院医学院,浙江 台州318000;2.台州市立医院,浙江 台州318000;3.长春市中日联谊医院,长春130033)
丙肝病毒感染严重威胁人类健康,疫苗可能是治疗该感染的有效方法之一。目前,丙肝治疗性疫苗的研究多是在丙肝结构蛋白基础上进行改造,融合适当的免疫调节因子是提高蛋白免疫原性的有效方法之一。CD40L胞外段能与树突状细胞表面CD40分子结合,促进树突状细胞成熟,促进特异性免疫反应,与HCV core融合后有望提高其免疫原性。本实验在原有质粒的基础上,构建了带有HCV core和CD40L胞外段融合蛋白的真核表达载体pcDNA3.1-core-CD40L,并探讨了其免疫原性。
1 材料与方法
1.1 实验材料
带有丙肝核心抗原的真核表达质粒pcDNA3.1-HCV core及带有人CD40L胞外段基因序列(GeneralBank编号NM_000074)的真核表达质粒pcDNA3.1CD40L均为本室保存。内切酶和连接酶均购自于TaKaRa,CD4和CD8荧光标记抗体为BD公司的产品。5周龄雄性ICR小鼠来源于浙江省实验动物中心。丙肝病毒抗体ELISA检测试剂盒购自于健仑。所得实验数据经SPSS17.0软件进行统计学分析,组间差异性进行t检验。
1.2 实验方法
1.2.1 质粒构建
利用基因重组技术在原有质粒pcDNA3.1-HCV core和pcDNA3.1-CD40L的基础上构建真核表达质粒pcDNA3.1-core-CD40L,并经酶切鉴定。质粒构建流程如图1。
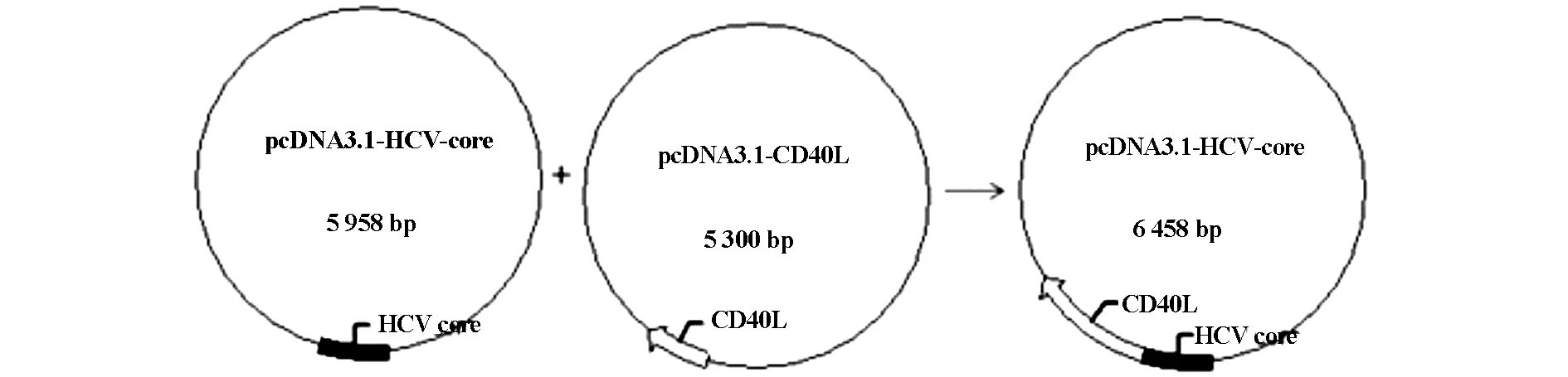
图1 质粒pcDNA3.1-core-CD40L构建流程图
1.2.2 免疫原性检测
超纯质粒大提试剂盒提取质粒,100μg/只大腿肌肉内注射免疫5周龄雄性ICR小鼠,每周免疫一次,共两次,二次免疫后七天杀鼠取外周血和脾,分离血清及淋巴细胞(密度梯度离心)。ELISA检测试剂盒检测血清中抗丙肝核心抗体;取外周血单个核细胞,荧光标记的抗CD4、CD8抗体染色后,利用流式细胞仪检测T细胞亚型;取所得脾淋巴细胞,利用T细胞富集柱分离T细胞,经PE标记的CD3抗体进行标记后,通过流式细胞仪检测T细胞纯度;并用佛波醇酯(Phorbol-12-myristate13-acetate,PMA)和离子霉素(Ionomycin,Ion)刺激 T细胞,6小时后用Real time PCR法检测T细胞内IL-2 mRNA、IFN-γmRNA 及 IL-4mRNA 的 水 平。PCR引物序列如表1。同时以本实验室制备的HCV体外感染细胞模型为靶细胞,以上述脾淋巴细胞为效应细胞,效靶比5∶1来进行细胞杀伤实验,并通过流式细胞仪检测细胞凋亡情况。

表1 细胞因子PCR引物序列
2 结果
2.1 HCV核心抗体效价的检测
免疫后小鼠外周血经ELISA检测试剂盒检测,结果显示,质粒pcDNA3.1-core-CD40L免疫小鼠,可诱使小鼠产生高滴度的抗丙肝核心抗原抗体(4266±328),P<0.01。
2.2 外周血淋巴细胞亚型的检测
流式细胞仪检测结果显示:质粒pcDNA3.1-core-CD40L免疫组小鼠外周血中CD4+和CD8+细胞比例明显增加,且以CD8+细胞增高更为显著,P<0.01。如表2。

表2 小鼠外周血T淋巴细胞亚型流式细胞仪检测结果
2.3 T细胞内细胞因子检测
Real time PCR检测结果显示:pcDNA3.1-core-CD40L免疫组小鼠T细胞内细胞Th1型和Th2型细胞因子分泌均明显高于对于照组,P<0.01。同时Th1型细胞因子分泌水平的增高明显高于 Th2 型。检 测结果提示,pcDNA3.1-core-CD40L免疫组更易诱发T0细胞向Th1型细胞转换。如表3。

表3 T细胞内细胞因子Real time PCR检测结果
2.4 CTL杀伤活性检测
以感染有HCV的Hela细胞为靶细胞,按效靶比5∶1加入效应细胞,37℃5%CO2条件下孵育18-24h。经清洗后,流式细胞仪检测细胞凋亡结果如图2。结果显示:pcDNA3.1-core-CD40L组细胞凋亡比例(54.1%)明显高于对照组(30.9%),即诱发了较强的CTL杀伤活性,P<0.01。

图2 CTL杀伤活性检测结果
3 讨论
HCV感染目前在世界范围内流行广泛且已严重影响着人类的健康,虽然众多科学工作者对HCV感染的防治作了多次尝试,但目前尚无很好的办法将其彻底治愈[1,2]。为了制备有效的丙肝治疗性疫苗,本实验选取基因比较稳定的HCV核心区基因[3],并将此基因与CD40基因的胞外段进行重组,构建成真核表达载体。CD40L是一个Ⅱ型跨膜糖蛋白,为TNF超家族成员之一,它是参与机体特异性细胞免疫和体液免疫的重要免疫共刺激分子,能与表达于树突细胞表面的CD40分子作用,调节免疫反应。经CD40L刺激后的DC具有如下特性:①抗原递呈能力增强;②具有较强的T淋巴细胞趋化能力;③体外刺激T淋巴细胞增殖反应能力增强;④表面CD80、CD86等共刺激分子明显上调,并能够产生大量的IFN-γ、IL-12、TNF-α等细胞因子,促进T细胞由Th0向Th1转化[4]。因此,本实验小组以基因重组的方式构建了真核表达载体pcDNA3.1-core-CD40L,并对其免疫原性进行了检测。结果揭示,该疫苗肌肉内注射免疫小鼠,能诱发其产生抗HCV核心抗原的高水平抗体。T细胞亚型流式细胞仪检测结果及T细胞内细胞因子Realtime PCR检测结果证实该疫苗能诱使T0细胞向Th1细胞转换。特异性CTL杀伤实验结果提示该疫苗能够诱发小鼠产生强的细胞免疫反应,可能对HCV感染一定的防治作用。
[1]Cohen J.The scientific challenge of hepatitis C[J].Science,1999,285:26.
[2]Popescu C,Gliga S and Arama V.Trends in hepatitis C virus infection therapy:protease inhibitors a step forward in the era of direct acting antivirals[J].Rom J Intern Med,2013,50(2):117.
[3]Dawson GJ.The potential role of HCV core antigen testing in diagnosing HCV infection[J].Antivir Ther,2012,17(7Pt B):1431.
[4]林贤凡,吴金明,陈 瑾,等.乙肝表面抗原-CD40L胞外段融合蛋白的设计和生物活性预测[J].温州医学院学报,2009,3:205.
