沉默缺氧诱导因子-1α对卵巢癌化疗敏感性的影响
2013-09-26刘爱民马晓艳
孟 迪,刘爱民,马晓艳,卢 玮
(吉林大学第二医院 妇产科,吉林 长春130041)
卵巢癌是最常见的妇科恶性肿瘤之一,死亡率高达70%,严重威胁着妇女的健康和生命安全。随着肿瘤细胞的失控性生长,缺氧已经广泛存在于恶性肿瘤的微环境之中。肿瘤细胞适应缺氧环境的途径往往是通过提高糖酵解的速率及形成多血管体系,而缺氧诱导因子-1α(HIF-1α)是促进糖酵解和血管生成的重要因子,因此HIF-1α在恶性肿瘤血管生成、侵袭及转移的过程中起到重要作用[1]。目前,卵巢癌的化疗疗效并不十分理想,致使卵巢癌患者的5年生存率一直徘徊不前,因此,如何提高卵巢癌化疗的敏感性成为治疗卵巢癌的关键,也成为临床上迫切需要解决的问题。本研究应用RNA干扰(RNAi)技术,选择 HIF-1α基因作为靶点,抑制人卵巢癌细胞HIF-1α的基因表达,为增加卵巢癌化疗的敏感性提供了新的治疗思路。
1 材料与方法
1.1 材料 SKOV3(人卵巢浆液性囊腺癌细胞株)购自上海研晶生物公司,由吉大二院中心实验室传代培养。质粒pSilencer2.1-U6-neo和 MTT 试剂购自Sigma公司,cDNA逆转录试剂盒购自科克美(北京)生物医学科技有限公司,HIF-1α单克隆抗体购自上海博古生物公司,工具酶购自百奇生物,胎牛血清购自Hyclone公司,质粒小提取试剂盒和凝胶回收试剂盒购自Qiagen公司,顺铂为江苏豪森药业产品,DH5α购自克劳宁北京生物公司,凋亡试剂盒购自南京百奥生物科技有限公司,所需寡核苷酸序列由上海生工合成。
1.2 方法
1.2.1 HIF-1αsiRNA 载体构建 针对 HIF-1α基因mRNA,选择一段特异性碱基序列作为干扰靶点,编码发卡RNA的双链双链寡核普酸序列:Forward 5’-GATGAGAACATGTCACCTTTT CAAGTTCCTTGTCAGTGAGATTGGAAGTCCAGATTGCTCTGACA-3’,Rreverse 3’-GTAGGTCTCAGTGACCTTGAAAGTTTCTCTTCAAGGTCACTGAGACCTAAAAAAACAGCTGTTCGA-5’。模板链的两端引入HindⅢ和BamHⅠ两个酶切位点。采用无同源性序列的无目标siRNA作阴性对照。
1.2.2 构建重组质粒及瞬时转染 DNA片段退火后将质粒 pSilencer2.1-U6-neo双酶切(HindⅢ,BamHⅠ),T4连接酶连接,用连接产物转化DH5α(感受态大肠埃希菌),涂于LB培养基上,24h后随机挑取菌落,接种在LB培养液中振荡12h,采用碱裂解法提取质粒并定量。将SKOV3细胞接种于6孔板内(4X105/孔),用含10%胎牛血清的 RPMI-1640培养基,37℃,5%CO2培养,当贴壁细胞融合达到80%-90%时转染重组质粒,改用含20%胎牛血清的RPMI-1640培养基继续培养24小时。采用G418抗性筛选14天,获得已转染质粒细胞(稳定存活)。实验分3组:空白组(SKOV3),非特异对照组(SKOV3NS),目的siRNA组(SKOV3siRNA)三组。
1.2.3 RT-PCR 检测 HIF-1αmRNA 表达 采用Trizol法提取细胞总RNA并测定其浓度和纯度,经RT反应获取cDNA,根据人HIF-1α基因cDNA序 列,进 行 PCR 引 物 设 计:HIF-1α-upper:5’-CCCATCACACATGTAAGTTAGATC-3’;HIF-1α-lower: 5’-TGGAGAAGTTGCTAATGGAGTAG-3 ’。 β-actin-upper: 5 ’-CATGCCTCTGCTTTCTGTCA-3’;β-actin-lower:5’-TCACCTCTTGTCAGCTGTG-3’。分别在相同条件下以HIF-1α和内对照β-actin的引物进行PCR反应。PCR反应条件:95℃预变性4min,94℃变性45s,53℃退火45s,73℃延伸30s,进行35个循环,最后72℃延伸8min。PCR产物经20g/L琼脂糖凝胶电泳,染色、照相后进行图像灰度差异分析。
1.2.4 Western Blot法检测HIF-1α蛋白表达 消化并收集细胞后提取总蛋白,进行蛋白定量,SDS聚丙烯酞胺凝胶电泳分离蛋白,将胶样电转至硝酸纤维素膜上,12h后5%脱脂奶封闭,加入HIF-1α单克隆抗体(1∶1000)4℃过夜,0.1%Tween-PBS洗膜3次(10min/次),边洗边摇,加入二抗过氧化物酶标记兔抗鼠IgG(1∶5 000),室温1h后PBST重复洗膜3次,ECL发光压片显色,曝光后图片扫描分析结果。
1.2.5 MTT法检测细胞抑制率 将三组细胞消化后分别制成单细胞悬液,接种于96孔板中(4×104/孔),每孔体积200μl,培养液中加入顺铂(终浓度为20μmol/L[2]),各组设有自身不加 DDP的复孔作为空白对照。37℃,5%CO2饱和湿度条件下培养培养72h,每孔加入MTT溶液(5mg/mL)20 μL,37℃温育4-6h,1 000r/min离心5min后弃去孔内培养液,加入DMSO 150μL/孔,振荡10min,使甲臜充分溶解,选择490nm波长,酶标仪测定各孔吸光度值(A值),记录结果。细胞抑制率=(1-加药组平均A值/空白对照组平均A值)×100%。
1.2.6 流式细胞术(FCS)检测细胞凋亡率 采用胰酶消化法重悬经顺铂作用后的各组细胞,制备各组单细胞悬液并计数,加入5μl Annexin V-FITC和15μl碘化丙啶,避光室温反应20min。离心机上1 000rpm,离心5min后弃上清,加入200μl结合液轻轻重悬细胞。加入10μl碘化丙靛染色液,轻轻混匀。流式细胞仪检测凋亡率。
1.3 统计学处理 所有数据以均数±标准差表示,采用SPSS13.0统计软件分析,P<0.05表示差异有统计学意义。
2 结果
2.1 RT-PCR检测 HIF-1αmRNA表达结果 见图1,转染卵巢癌细胞后,进行图像灰度分析,空白组、非特异对照组和目的siRNA组细胞HIF-1αmRNA检测结果分别为0.535±0.071、0.472±0.083和0.316±0.085。与两对照组相比,目的siRNA组细胞HIF-1αmRNA表达水平明显降低,P值分别为0.005和0.008,提示差异有统计学意义;空白组与非特异对照组两组细胞比较,HIF-1αmRNA表达水平差异无统计学意义(P=0.725)。
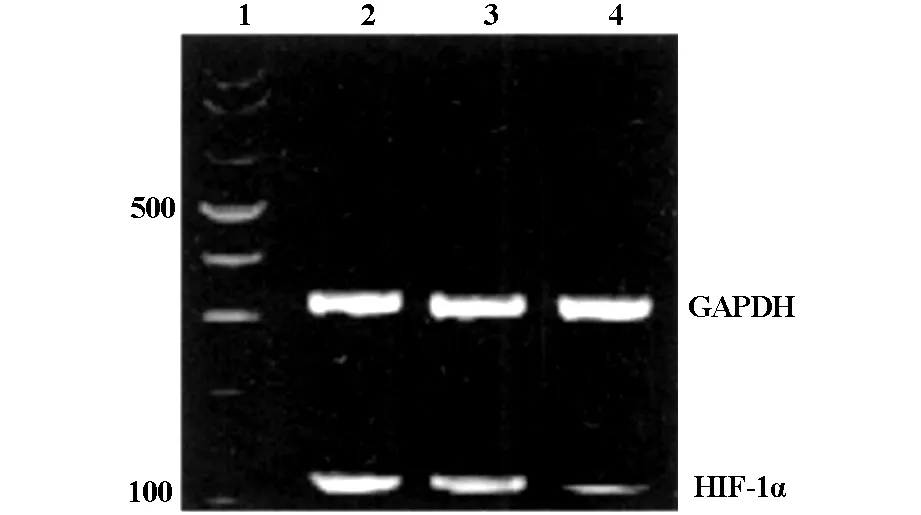
图1 细胞HIF-1αmRNA PCR检测图
2.2 Western Blot法检测HIF-1α蛋白结果 见图2。空白组、非特异对照组和目的siRNA组细胞HIF-1α蛋白检测结果分别为0.551±0.094、0.573±0.082和0.339±0.092。与两对照组相比,目的siRNA组细胞HIF-1α蛋白表达明显降低,P值分别为0.028和0.014,提示差异有统计学意义;而空白组与非特异对照组比较,细胞HIF-1α蛋白表达差异无统计学意义(P=0.652)。

图2 细胞HIF-1α蛋白Westem blot检测结果
2.3 MTT检测细胞抑制率结果 经顺铂作用后,空白组、非特异对照组和目的siRNA组细胞抑制率分别为0.456±0.127、0.431±0.136和0.721±0.114。与两组对照组相比,目的siRNA组细胞抑制率明显增加,P值分别为0.014和0.018,差异均有统计学意义;而空白组与非特异对照组比较,P=0.865,提示细胞抑制率差异无统计学意义。
2.4 流式细胞术检测细胞凋亡率结果 见图3。经顺铂作用后,空白组、非特异对照组和目的siRNA组细胞凋亡率分别为19±3、19±2和36±3。与两对照组相比,目的siRNA组细胞凋亡率明显增加,P值为别分0.001和0.002,提示差异均有统计学意义;而空白组与非特异对照组比较,P=0.862,提示细胞凋亡率差异无统计学意义。

图3 细胞凋亡FCS检测图
3 讨论
缺氧诱导因子-1α(HIF-1α)是一种调节缺氧反应和保持氧稳态平衡的关键转录因子,在低氧环境下,能够通过活化下游靶基因,使肿瘤细胞的葡萄糖转运和糖酵解增加,促进局部新生血管的生成来恢复内环境稳定,从而适应乏氧微环境,因此,HIF-1α在恶性肿瘤血管生成、侵袭及转移过程中均起到重要的作用。Wong等实验研究[3]表明,在正常人类组织中并未检测到HIF-1α蛋白的表达,而在多种人体恶性肿瘤组织中则存在着HIF-1α蛋白的表达显著增高,且随着肿瘤分期及恶性程度的增高,HIF-1α蛋白表达也呈明显增高趋势[4,5]。因此,HIF-1α可以作为评价早期卵巢癌侵袭能力的重要生物学标记物,降低卵巢癌组织中缺氧诱导因子-1α的表达对抑制卵巢癌的生长及转移具有重要意义。
RNA干扰(RNAinterference,RNAi)技术是指将双链RNA(dsRNA)导入目的细胞中,其中的一条单链与靶mRNA特异性结合后将其降解,并引起转录后基因沉默(PTGS),从而表现出细胞特定基因缺失的表型。RNAi技术与其他转录后基因治疗方法相比,可通过降解靶基因并以自身作为引物进行合成,通过两种方式瀑布式地增殖,短时间内能够高效地抑制靶基因表达,转染siRNA48h后即可看到明显的靶基因表达抑制率高于90%。同时,siRNA能够对靶基因发挥较特异性的抑制作用,其碱基序列与靶基因的mRNA序列能达到完全匹配,siRNA其中任何一个碱基发生改变,均不能与靶基因相结合,从而导致RNA干扰失败。Brummelkamp等研究[6]表明,siRNA表达载体可以长期并稳定地抑制目的基因在哺乳动物体内的表达,表明siRNA技术沉默基因具有高效性和特异性,siRNA技术能够为基因治疗提供了一个有效的工具。
化疗在卵巢癌的临床治疗中占有重要地位,化疗的疗效直接影响患者的生活质量和生存时间,如何提高卵巢癌的化疗敏感性成为临床上迫切需要解决的问题。顺铂(DDP)是临床上治疗卵巢癌常用的化疗药物之一,具有较强的细胞毒性,可以在抑制肿瘤细胞DNA复制过程的同时损伤其细胞膜结构,有较强的广谱抗肿瘤作用。DDP具有类似烷化剂双功能基团的作用,进入细胞后水解为阳离子水化物,并与肿瘤细胞DNA链上的碱基发生作用,改变其作为正常模版的功能,引起DNA复制障碍,从而抑制癌细胞分裂。
目前,卵巢癌的化疗疗效并不十分理想,致使卵巢癌患者的5年生存率一直徘徊不前,因此,如何提高卵巢癌化疗的敏感性成为治疗卵巢癌的关键,也成为临床上迫切需要解决的问题。基于上述已有的科学技术研究成果,本研究选择HIF-1α基因作为靶点,将载体系统引入卵巢癌细胞中,并使之长期稳定表达以沉默HIF-1α基因,通过RNA干扰技术有效地下调了卵巢肿瘤细胞中HIF-1α基因和蛋白的表达水平,诱导和促进了卵巢癌细胞的凋亡,在分子水平上阻断了卵巢癌细胞的生长和转移,为卵巢癌基因治疗与化学治疗相结合提供了实验依据,也为进一步提高卵巢癌患者的生存率提供一条新的治疗途径。
[1]刘亦晴,张建文,陈奎生,等.皮肤鳞状细胞癌和基底细胞癌组织中 HIF-1α、VEGF的表达[J].郑州大学学报:医学版,2007,42(2):340.
[2]王勇梅,吴维光,葛红雨,等.沉默STAT3基因对人卵巢癌化疗敏感性的影响[J].中国癌症杂志,2010,20(4):270.
[3]Wong Ch,Theresa L,Karen H,et al.VEGF and HIF-1expression are increased in sdvanced stages of epithelial ovarian cancer[J].Gynecol Oncol,2003,91(3):513.
[4]Shimogai R,Kigawa J,Itamochi H,et al.Expression of hypoxiainducible factor 1alpha gene affects the outcome inpatients with ovarian cancer[J].Int J Gynecol Cancer,2008,18(3):499.
[5]Argyriou P,Papageorgiou S G,Panteleon V,et al.Hypoxiainducible factors in mantle cell lymphoma:implication for anactivatedmTORC1→HIF-1αpathway[J].Ann Hematol,2011,90(3):315.
[6]Brummelkamp TR,BernardsR,AgamiR.A ststem for stable expression of short interfering RNAs in mammalian cells[J].Science,2002,296(5567):550.
