椪柑核中柠檬苦素类似物提取条件优化
2013-09-17唐韵熙邓放明
唐韵熙邓放明
TANG Yun-xi1,2DENG Fang-ming1,2
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
柠檬苦素类物质是一类四环三萜类植物次生代谢物质,主要存在于芸香科和楝科植物组织中[1],以果核中含量较高,果皮次之,果汁中含量最低。至今发现柑桔果实中较常见且含量较高的柠檬苦素类物质主要有:柠檬苦素、诺米林、奥巴叩酮、脱乙酰诺米林等[2]。柠檬苦素类物质有苷元和糖苷两种存在形式,至今已从柑橘属植物中分离出了37种类柠檬苦素苷元和17种类柠檬苦素糖苷[3]。类柠檬苦素苷元的结构为D-环的C17位上连一个呋喃环,而且具有高度氧化的三萜醇类诱导体结构,而糖苷是由柠檬苦素类似物苷元分子D环开环后在C17位上和一分子葡萄糖以糖苷键的形式结合而成的[4]。国外对柠檬苦素类物质的研究较为深入,据报道[5],早在20世纪60年代,Arigoni和Barton就用化学和X-ray的方法对柠檬苦素的结构进行了研究,指出柠檬苦素的分子式为C26H30O8,分子量为470。同时由于柠檬苦素类物质的苷元和糖苷两种结构决定了其具有一定的健康维护功能,因此学者[6,7]对其进行了分离、鉴定和生物活性探讨。Murthy等[8]发现柑橘中柠檬苦素类物质和姜黄素能够抑制结肠癌的发生。Archana等[9]用石油醚对Citrus medica Linn.种子进行柠檬苦素类物质提取,并以大白鼠为受体,研究表明,柠檬苦素类物质能明显降低大鼠体内血清胆固醇、血清甘油三酯的含量,提高高密度脂蛋白胆固醇(HDL)含量,这有助于降低动脉粥样硬化的风险。另有研究[10,11]指出柠檬苦素类物质还有降血糖、杀虫、抗病毒、抗肿瘤形成和抑菌等作用。
目前,对于柠檬苦素类似物的提取、分离、纯化和鉴定已有一定的研究,常用的提取方法主要有超声波辅助提取法[12]、溶剂提取法[13]、超临界 CO2提取法[14]等。其常使用乙醇或丙醇等有机物作为提取剂,但使用量大且对环境有一定污染,特别是丙醇等毒性有机物。Deepak等[15]曾采用水溶助剂法对酸橘籽中具有生物活性的柠檬苦素进行了研究,结果表明该方法可减少有机溶剂用量且提取率较好。本研究在此基础上,选择水杨酸钠水溶助剂进行提取,拟对提取工艺进行优化,旨在找到一种环境友好型且提取率高的方法,为柑桔类水果的深加工提供理论依据和实践指导。
1 材料与方法
1.1 材料
椪柑核:于湖南长沙水果市场采购椪柑并取籽,洗净,50℃下烘干,用粉碎机粉碎后过40目筛,保存于干燥环境中备用;
柠檬苦素标样:纯度98%,成都曼思特生物科技有限公司;
水杨酸钠、石油醚(60~90℃)、无水乙醇、浓硫酸、三氯化铁、对二-甲氨基苯甲醛:分析纯,国药集团化学试剂有限公司;
显色液(Ehrlich试剂):A液:准确称取125mg对二-甲氨基苯甲醛溶于100mL的浓硫酸和乙醇混合液(浓硫酸65mL,乙醇35mL)中;B液:准确称取氯化铁0.9g,用蒸溜水溶解并定容至100mL,使用时A液中加入0.5mL的B液,现配现用。
1.2 仪器
可见分光光度计:WFJ7200型,上海龙尼柯仪器有限公司;
高速中药粉碎机:ZN-400A型,长沙市岳麓区中南制药机械;
电热恒温水浴锅:DZKW-S-4型,北京市永光明医疗仪器厂;
循环水式多用真空泵:SHB-ⅢT型,郑州长城科工贸有限公司;
电热鼓风干燥箱:101-2AB型,天津市泰斯特仪器有限公司;
电子分析天平:AUY220型,日本Shmadzv公司。
1.3 试验方法
1.3.1 椪柑核柠檬苦素的测定
(1)检测波长的确定:准确称取10mg柠檬苦素标准样品,用50mL无水乙醇溶解、定容,配制成200μg/mL的柠檬苦素标准溶液。取1mL该标准溶液于10mL试管中,加无水乙醇1mL,再加显色液5mL,摇匀,于暗处静置30min,然后在不同波长下测定吸光度,并以波长为横坐标,吸光度为纵坐标作图,观察到最大吸收峰波长在490nm处。
(2)柠檬苦素标准曲线的绘制:分别取0,0.25,0.50,0.75,1.00,1.25,1.50,1.75,2.00mL标准溶液于10mL试管中,并分别用无水乙醇稀释至2mL,再分别加入5.0mL显色液,摇均,暗处静置30min。用无水乙醇作为空白参比,在490nm波长下测定吸光度。根据测得结果建立标准曲线,柠檬苦素标液浓度为横坐标x,吸光度为纵坐标y。最终得标准曲线回归方程为y=0.004 1x-0.097 9,相关系数R2=0.993 1。标准曲线见图1。
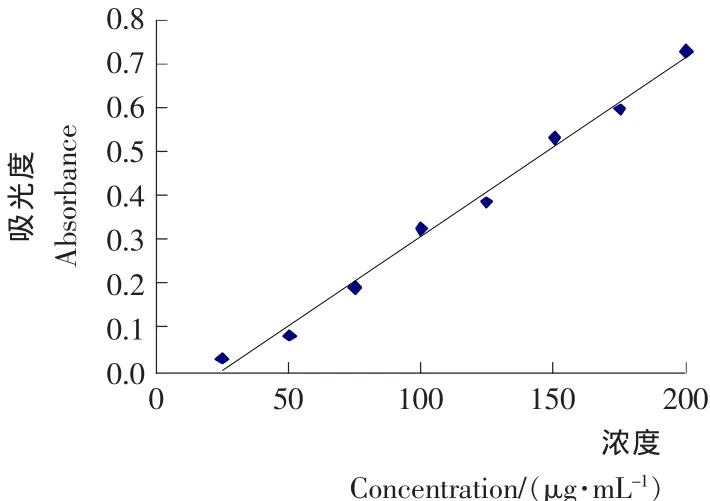
图1 柠檬苦素标准曲线Figure1 The standard curve of Limonin
(3)柠檬苦素提取得率的计算:将椪柑核柠檬苦素提取液定容到50mL,准确吸取0.1mL于10mL试管中,准确加入1.9mL无水乙醇稀释,再加入5mL显色液,于490nm波长处检测样品液的吸光度,然后根据吸光值在标准曲线上查得柠檬苦素类似物浓度,最后计算待测样品中柠檬苦素类似物的含量,其计算公式见式(1)。

式中:
R——椪柑核中柠檬苦素类似物含量,%;
V——样品定容体积,mL;
C—— 测得的样品浓度,μg/mL;
L——加入的样品体积,mL;
M—— 样品质量,g。
1.3.2 提取椪柑核中柠檬苦素类似物的操作方法
(1)椪柑核脱脂:称取一定量椪柑核粉,按料液比1∶4(m∶V)倒入适量石油醚,密封好于室温下浸提24h。而后抽滤自然干燥至无石油醚。
(2)水溶助剂提取柠檬苦素:称取脱脂椪柑核粉2g(精确至0.000 1g)于100mL锥形瓶中,按料液比加入一定量的水溶助剂水杨酸钠,于一定温度下浸提一定时间,然后抽滤,用提取溶剂定容至50mL,即得椪柑核柠檬苦素提取液。
1.3.3 椪柑核柠檬苦素提取单因素试验
(1)提取时间筛选试验:称取2.0g(精确至0.000 1g)样品粉末5份,在浓度为2mol/L的水杨酸钠20mL,温度为40℃下,分别浸提2,4,6,8,10h后,抽滤,定容至50mL,按1.3.1(2)法进行显色反应,在490nm处测定吸光度,通过计算柠檬苦素类似物得率,观察浸提时间对柠檬苦素类似物提取率的影响。
(2)提取剂浓度筛选试验:称取2.0g(精确至0.000 1g)样品粉末5份,在40℃下提取6h,用浓度分别为1.0,1.5,2.0,2.5,3.0mol/L的水杨酸钠20mL进行提取,待提取完后,抽滤,定容至50mL,按1.3.1(2)法进行显色反应,在490nm处测定吸光度,并计算得率,观察提取剂浓度对柠檬苦素类似物溶出的影响。
(3)提取温度筛选试验:称取2.0g(精确至0.000 1g)样品粉末5份,用20mL浓度为2mol/L的水杨酸钠,分别在20,30,40,50,60℃下浸提6h,过滤,加提取试剂定容至50mL,按1.3.1(2)法进行显色反应,在490nm处测定吸光度,并计算得率,观察提取温度对柠檬苦素类似物提取率的影响。
(4)料液比筛选试验:称取2.0g(精确至0.000 1g)样品粉末5份,按料液比1∶5,1∶10,1∶15,1∶20,1∶25(m∶V)加入浓度为2mol/L的水杨酸钠,在40℃下浸提6h,过滤,定容至50mL,按1.3.1(2)法进行显色反应,在490nm处测定吸光度,并计算得率,观察料液比对柠檬苦素类似物溶出的影响。
1.3.4 椪柑核柠檬苦素提取正交试验 根据单因素试验结果,选用提取时间、提取剂浓度、提取温度和料液比为试验因素,进行四因素三水平正交试验,以柠檬苦素得率为指标,确定最佳提取条件,并确定各因素的影响重要性次序。
2 结果与分析
2.1 提取时间对柠檬苦素类物质提取率的影响
由图2可知,随着提取时间由2h延长到6h,柠檬苦素类物质的提取率逐渐增大,提取6h后出现了缓慢下降的趋势,这可能是由于浸提时间延长,溶剂中有效成分发生分解氧化现象从而降低了得率。因此,提取时间选取6h左右比较适宜。
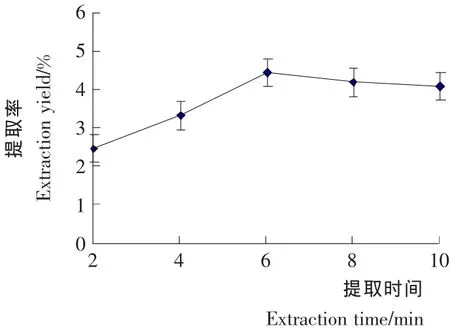
图2 提取时间对柠檬苦素类物质提取率的影响Figure2 Effects of extracting time on extraction yield of Limonin
2.2 提取剂浓度对柠檬苦素类物质提取率的影响
由图3可知,随着水杨酸钠浓度由1mol/L增加到2mol/L,柠檬苦素类物质的提取率呈上升趋势,在2mol/L时达到最高。但在2mol/L以后,随水杨酸钠浓度升高,柠檬苦素类物质的提取率稍有降低,这可能是因为其在2mol/L的水杨酸钠内已达到饱和,浓度过大反而影响柠檬苦素类似物的提取率。同时也考虑到水溶助剂浓度升高,会导致最终产品中非目标成分的增加,影响目标物纯度,因此,提取溶剂浓度选取2mol/L左右比较适宜。
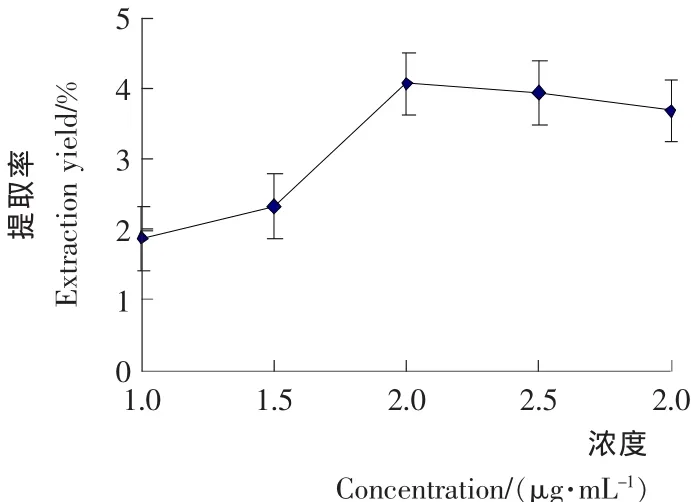
图3 提取剂浓度对柠檬苦素类物质提取率的影响Figure3 Effects of extractant concentration on extraction yield of Limonin
2.3 提取温度对柠檬苦素类物质提取率的影响
一般情况下,物质在溶剂中的溶解度会因温度的提高而增加,但柠檬苦素类物质作为一种天然抗氧化物质,在高温条件下被氧化的概率也相应增加,致使提取效率降低。由图4可知,提取温度从20℃提升到40℃,柠檬苦素类物质的提取率呈上升趋势,在40℃时达到最高。而后提取率有所下降,因此提取温度选取40℃左右为宜。
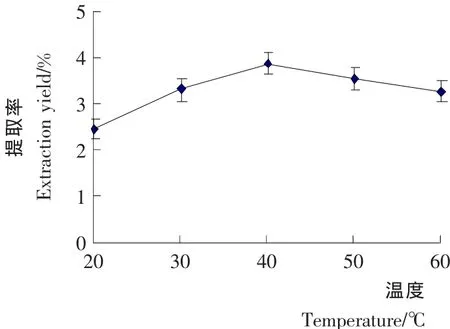
图4 提取温度对柠檬苦素类物质提取率的影响Figure4 Effects of extracting temperature on extraction yield of Limonin
2.4 料液比对柠檬苦素类物质提取率的影响
溶剂用量的多少和柠檬苦素类物质在其中的溶解率有一定的关系。由图5可知,柠檬苦素的提取率是随着料液比的提高而增加的。但是料液比到达1∶15(m∶V)后,上升趋势不明显,此时溶剂可能已经将待提取物全部提取出。从节约经济成本角度出发,选择料液比1∶15(m∶V)左右为宜。
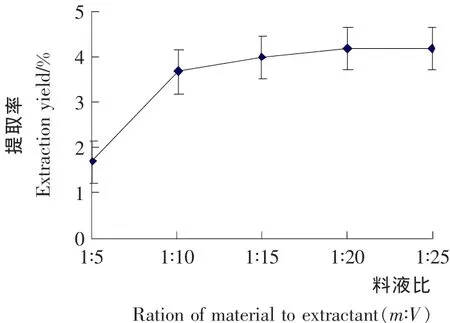
图5 料液比对柠檬苦素类物质提取率的影响Figure5 Effects of ratio of material to extractant on extraction yield of Limonin
2.5 正交试验结果与分析
为了优化椪柑核中柠檬苦素类似物提取条件,以柠檬苦素得率为指标,选用提取时间、提取剂浓度、提取温度和料液比为试验因素进行正交试验,试验因素水平取值见表1,试验设计及结果见表2,方差分析见表3。
由表2可知,用水杨酸钠提取椪柑核中柠檬苦素类物质的最佳条件为A2B2C2(C1)D3,即提取时间为6h,提取溶剂浓度为2mol/L,提取温度为40℃(或30℃),料液比为1∶20(m∶V)。各因素对椪柑核中柠檬苦素类物质提取率的影响依次为D>B>A>C,即料液比>提取剂浓度>提取时间>提取温度。

表1 正交试验因素水平表Table1 Design of factors and levels for L9(34)orthogonal test
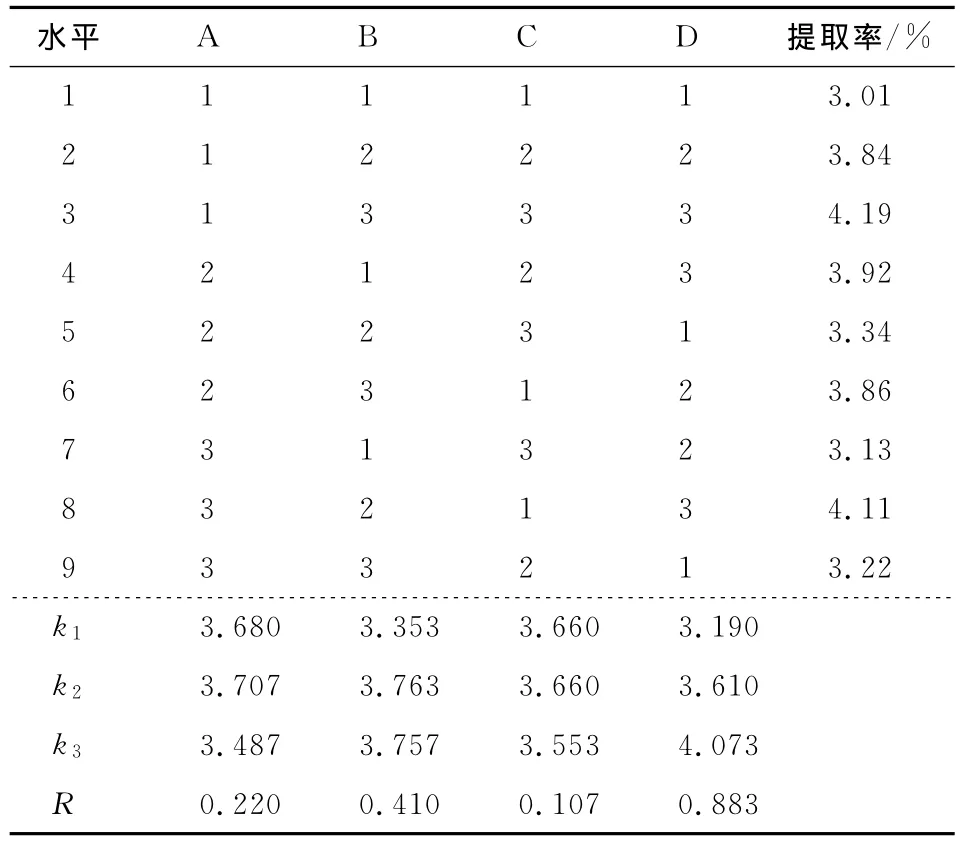
表2 L9(34)正交试验结果表Table2 The result of L9(34)orthogonal test
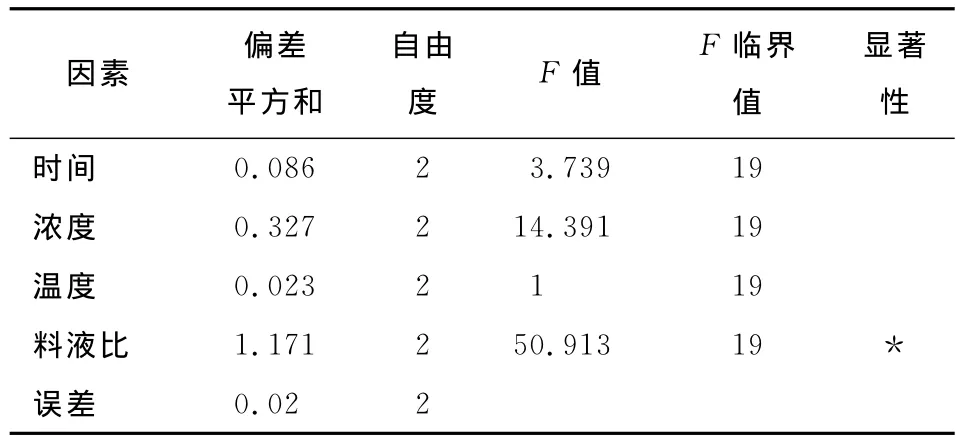
表3 方差分析表†Table3 Analysis of variance table
由表3可知,不同料液比的试验结果有显著性影响。
依据正交试验结果,在两组最优条件(即1:A2B2C2D3;2:A2B2C1D3)下进行水溶助剂法提取椪柑核柠檬苦素重复实验3次,两组得到的柠檬苦素平均得率分别为4.21%,4.19%。因此,根据实际条件,最终选择组1(A2B2C2D3)为最佳柠檬苦素提取条件。
3 结论
以椪柑核为原料,用水溶助剂水杨酸钠为提取溶剂,研究椪柑核中柠檬苦素提取的优化工艺条件。经优化后,水杨酸钠提取椪柑核中柠檬苦素的最佳提取条件为提取时间6h、水杨酸钠浓度2.0mol/L、温度40 ℃、料液比1∶20(m∶V),在此条件下,椪柑核中柠檬苦素类物质的提取率为4.21%。该方法也证实了前人对于水溶助剂提取柠檬苦素类似物可明显减少有机溶剂用量的论证,且对环境的污染性小。但该方法只是采用椪柑核种子作为研究对象,在下一步的研究中,应扩大柑橘品种的选取面,针对果皮、果肉等不同部位进行进一步探讨。
1 刘亮,戚向阳,董绪燕.柑橘中柠檬苦素类似物的研究新进展[J].农产品加工·学刊,2007(7):37~41.
2 张菊华,单扬,李高阳.柑橘果汁中的类柠檬苦素及其脱苦方法[J].食品与机械,2005,21(3):72~75.
3 Mandadi K K,Jayaprakasha G K,Bhat N,et al.Red mexican grapefruit:a novel source for bioactive limonoids and their antioxidant activity[J].Zeitschrift Fuer Naturforschung,2007(62c):179~188.
4 郭育铭,郑旭煦,殷钟意,等.柠檬苦素类似物的研究进展[J].重庆工商大学学报(自然科学版),2008,25(6):638~644.
5 姚晓颖,韩永龙,张玉玺,等.柠檬苦素的药理活性研究进展[J].中国伤残医学,2011,19(3):177~179.
6 Jayaprakasha G K,Dandekar D V,Tichy S E,et al.Simultaneous separation and identification of limonoids from citrus using liquid chromatography-collision-induced dissociation mass spectra[J].Journal of Separation Science,2011,34(1):2~10.
7 Langeswaran K,Kumar S G,Perumal S,et al.Limonin– A citrus limonoid,establish anticancer potential by stabilizing lipid peroxidation and antioxidant status against N-nitrosodiethylamine induced experimental hepatocellular carcinoma[J].Biomedicine& Preventive Nutrition,2013,3(2):165~171.
8 Murthy K N C,Jayaprakasha G K,Patil B S.Citrus limonoids and curcumin additively inhibit human colon cancer cells[J].Food Funct.,2013,4(5):803~810.
9 Archana N Sah,Amit Joshi,Vijay Juyal,et al.Antidiabetic and hypolipidemic activity of citrus medica linn.seed extract in streptozotocin induced diabetic rats[J].Pharmacognosy Journal,2011,3(23):80~84.
10 Li B,Shi R,Xiong Z,et al.Extraction and insecticidal activities of limonin in peel of citrus maxima[J].Chinese Agricultural Science Bulletin,2012(1):57.
11 蒋俊平,袁芳,吴宾,等.柠檬苦素类似物的研究进展综述[J]中国酿造,2012,31(7):10~14.
12 秦秀凤,蒲彪,王建鹏.超声波提取橘皮中柠檬苦素化合物的工艺研究[J].食品科技,2011(9):257~261.
13 王菁,郑俊霞,蒲彪.响应面法优化柑橘皮柠檬苦素提取工艺[J].食品研究与开发,2011,32(2):34~38.
14 曾祥燕,赵良忠.响应面分析法优化超临界二氧化碳萃取橘皮中类柠檬苦素工艺[J].食品科学,2011,32(22):65~69.
15 Deepak V Dandekar,G K Jayaprakasha,Bhimanagouda S Patil.Hydrotropic extraction of bioactive limonin from sour orange(Citrus aurantium L.)seeds[J].Food Chemistry,2008(109),515~520.
