反胶束萃取技术及其对植物蛋白质结构特性的影响
2013-09-17杨趁仙陈复生刘昆仑布冠好郭珍徐卫河
杨趁仙陈复生刘昆仑布冠好郭 珍徐卫河
YANG Chen-xian1CHEN Fu-sheng1LIU Kun-lun1BU Guan-hao1GUO Zhen1XU Wei-he2
(1.河南工业大学粮油食品学院,河南 郑州 450001;2.河南工业大学化学化工学院,河南 郑州 450001)
传统的蛋白质分离方法有沉淀法、离子交换法、吸附法等[1-3],但缺点是工艺复杂、效率低、能耗高、有溶剂残留等,因此难以满足现代生化分离的需要。20世纪70年代末新兴的反胶束萃取技术适用于蛋白质或酶类等大分子的分离纯化,具有操作简单、萃取率高、可连续操作、不易引起目标产物变性等优点。近些年来,反胶束萃取技术已应用于生物[4,5]、化工、食品[6]、材料、医药[7]等诸多方面,具有广阔的应用前景。文章重点介绍了反胶束萃取蛋白质的基本原理、主要影响因素及国内外有关反胶束体系萃取植物蛋白质的结构与特性的研究现状。
1 反胶束体系的概念及萃取原理
反胶束(reverse micelle),又称反胶团,是表面活性剂分散于连续有机相中形成的纳米尺度的一种聚集体(10~100nm),反胶束溶液是透明的、热力学稳定的系统。
将表面活性剂添加到水或有机溶剂中,使其浓度超过临界胶束浓度,表面活性剂就会聚集在一起,极性基团向外,与水接触,非极性基团向内,形成一个非极性核,称为正胶束。若将表面活性剂添加在有机溶剂中,当其浓度超过临界胶束浓度时,表面活性剂的亲水极性头自发向内,形成一个极性核,疏水非极性尾向外,与非极性的有机溶剂接触,形成含有极性内核的聚集体即为反胶束(见图1)。水进入此极性内核后形成的“水池”具有增溶蛋白质、酶、氨基酸等物质的能力,增溶的过程称为前萃(forward extraction);将前萃液与另一水相接触,改变水相条件(如pH值、离子种类或离子浓度等),使目标产物从反胶束转移到水相的过程,称为后萃(backward extraction)。常用的有机溶剂有异辛烷、正辛烷等脂肪烷烃[8];常用的表面活性剂有丁二酸-2-乙基已基酯磺酸钠(AOT)、十六烷基三甲基溴化铵(CTAB)、三辛基甲基氯化铵(TOMAC)等[9]。表面活性剂通常与某些有机溶剂配合使用[10],见表1。
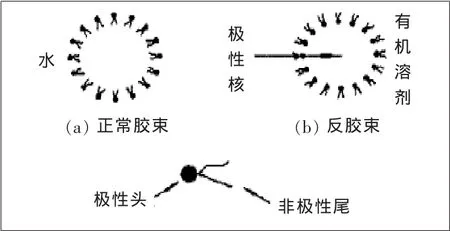
图1 正常胶束与反胶束示意图Figure1 Structure of micelle and reverse micelle

表1 反胶束萃取中常用的表面活性剂及其相应的有机溶剂Table1 Surfactant used commonly and the corresponding organic solvent of reverse micelles
2 反胶束体系表征参数
描述反胶束体系的性质通常用W0(或R)、θ和N等参数,其中W0表示形成反胶束微粒的水和表面活性剂的摩尔数比,θ(mol/L)表示增溶的水相对于有机相总体积的浓度,N表示组成反胶束微粒的表面活性的个数即聚集数。W0是衡量反胶束体系增溶能力最重要的参数,当W0一定时,θ和N决定了反胶束微粒的相对浓度。
3 影响反胶束萃取的主要因素
3.1 表面活性剂的种类
表面活性剂是形成反胶束的主要成分,它是一种由亲水的极性基团和亲油的非极性基团组成的两亲分子[11],可分为阴离子表面活性剂(如AOT,DBS,SDS)、阳离子表面活性剂(如CTAB,TOMAC)、两性离子表面活性剂(如卵磷脂)和非离子型表面活性剂(如Tween-85、烷基酚聚氧乙烯醚)。
研究[12]发现,由两种或两种以上表面活性剂构成的混合反胶束体系对蛋白质的提取优于单一的反胶束体系。赵晓燕等[13]用4种表面活性剂(AOT、CTAB、TritonX-100、SDS)形成的反胶束对大豆蛋白进行提取,对水池 (W0)大小、蛋白质提取率及蛋白质亚基分子量进行了比较,得出AOT、SDS、CTAB和TritonX-100反胶束体系提取大豆蛋白质的最佳浓度分别为0.08,0.08,0.08,0.10g/mL。孙秀平等[14]研究了 AOT、SDS、CTAB和 TritonX-100表面活性剂形成的反胶束对花生蛋白提取率的影响,结果表明不同的表面活性剂形成反胶束的“水池”大小不同,导致蛋白质提取率也不同。郭珍等[15]研究发现,用AOT、SDS与异辛烷正辛醇复合反胶束体系萃取花生蛋白,不仅萃取率有所提高,萃取时间也显著缩短,萃取效果显著优于单一反胶束体系。
3.2 表面活性剂的浓度
表面活性剂的浓度直接影响体系界面膜的稳定性、反胶束基团聚集数和萃取效率。当表面活性剂浓度过低时,难以形成稳定的反胶束微乳液;浓度过高且体系水分含量不变时,W0值变小,则反胶束尺寸减小,由于空间位阻作用使蛋白质增溶到反胶束内受阻,导致蛋白质萃取率下降;在适当的浓度范围内,随着表面活性剂浓度的增大,萃取率也不断提高[16]。
任健等[17]研究了不同浓度AOT反胶束溶液对玉米胚芽蛋白前萃率的影响,结果显示当AOT浓度增加,反胶束的W0值、水池直径及体系相对黏度增加,蛋白质的前萃率也增加,并确定了AOT浓度为0.044g/mL时前萃率最高,但随着AOT浓度再增加,玉米胚芽蛋白的前萃率有所下降,这可能是由于AOT浓度过高对蛋白质的增溶起到了阻碍作用。孙晓宏[18]研究了不同AOT浓度对小麦胚芽蛋白前萃率的影响,前萃率随AOT浓度增加有显著增加趋势,但增加到一定程度时,趋势有所下降最后趋于平衡。
3.3 水相pH值
水相pH值的改变直接影响蛋白质表面的电荷情况,若蛋白质表面净电荷与表面活性剂头部基团的电性相反,它们之间就存在静电吸引。当水相pH小于等电点(pI)时,蛋白质带正电,使用阴离子表面活性剂,有利于蛋白质进入反胶束中;若使用阳离子表面活性剂,则相反[10]。pH大于蛋白质的等电点时,蛋白质表面带负电荷。
3.4 离子强度
水相中离子强度的大小决定带电表面所赋予的静电屏蔽程度,主要表现为降低带电分子和反胶束带电界面之间的静电相互作用;降低表面活性剂头部基团之间的静电排斥力,使反胶束颗粒变小,W0值减小。因此,降低水相的离子强度,有利于极性物质在反胶束中的增溶[10]。
3.5 温度
温度也会影响反胶束的萃取率。在反胶束体系中,温度升高,表面活性剂与水的亲和力减小,导致反胶束水池直径减小,W0值降低。温度过高,反胶束体系不稳定,且蛋白质也易产生变性。
此外,蛋白质的大小、浓度、表面的电荷分布及外界因素等也影响反胶束的萃取效率。
4 反胶束萃取植物蛋白质结构和特性的研究
蛋白质结构的改变对其功能特性有着直接影响,而不同的萃取环境会不同程度的改变蛋白质的结构,如溶液中离子强度、pH值等因素会使反胶束中蛋白质的结构发生改变,影响了蛋白质的二、三、四级结构[19-21],内部结构的改变直接导致蛋白质的凝胶特性、起泡性、乳化性、持水性等功能特性的变化。目前可以用多种技术对蛋白质结构信息进行测定,如扫描电镜、氨基酸分析仪、X射线衍射、核磁共振、红外光谱图、拉曼光谱分析等[22-26]。近年来,一些学者采用上述方法对反胶束萃取的植物蛋白质的结构进行研究,并与传统的碱溶酸沉提取法提取的蛋白质对比,以探索蛋白质结构和理化特性的变化。
4.1 反胶束萃取法对植物蛋白质结构的影响
反胶束“水池”增溶蛋白质的驱动力主要包括疏水力、静电作用以及羟基间的相互作用,这些作用都可能对蛋白质的结构变化产生重要影响[27]。此外,外界条件如pH值、离子强度等也会影响蛋白质的结构[28]。因此对反胶束萃取的植物蛋白质的结构进行研究显得尤为重要,这也为研究萃取物的功能特性奠定了基础。
Chang等[29]较早地利用傅里叶变换红外光谱测定含重水的AOT/异辛烷反胶束萃取的α-胰凝乳蛋白酶的二级结构,通过红外酰胺I带子峰的位置和强度判断蛋白质的二级结构的改变,也可估测反胶束萃取条件下α-胰凝乳蛋白酶不同结构的相对含量。结果表明,反胶束萃取的α-胰凝乳蛋白酶结构中α-螺旋和β-折叠比例减少,而无规则结构增多,这可能会使α-胰凝乳蛋白酶有更多的内部结构暴露出来,从而改变了酶的活性。之后,Chen等[30]采用红外光谱技术对AOT反胶束萃取的大豆蛋白的特性进行研究,结果显示水相萃取法与AOT反胶束萃取法得到的大豆蛋白其红外谱图上4 000~400cm-1处的峰强度和位置有所不同,且α-螺旋、β-折叠及不规则构象的比例均有差异,这些改变均可能影响大豆蛋白的功能特性。Zhao等[31]应用拉曼光谱对反胶束萃取大豆蛋白的主侧链构象变化进行研究,通过与水相萃取对比发现,反胶束萃取的球蛋白分子的无序程度增加,并且出现一些新键;且此法萃取的7s和11s球蛋白主侧链的构象、α-螺旋、β-折叠及规则构象所占比例也都有变化。高亚辉等[32]采用不连续SDS-PAGE和氨基酸分析对AOT/异辛烷反胶束萃取和碱溶酸沉法生产的大豆蛋白进行了组分分析,结果发现反胶束萃取小分子蛋白质的能力较强,且其中α-螺旋和β-折叠含量低于大豆分离蛋白。反胶束萃取的蛋白中天冬氨酸、谷氨酸、精氨酸和色氨酸的含量高于碱溶酸沉法生产的大豆分离蛋白。
总体看来,在反胶束萃取的特殊微环境下,得到的蛋白质孔径较小;蛋白分子的主链的α-螺旋、β-折叠和β-转角结构有一定程度的减少,而无规则卷曲结构增加,侧链基团也有微小变化;反胶束萃取对蛋白质中必需氨基酸含量的影响不大,甚至有利于提高某些氨基酸的含量,这可以改良蛋白质的功能特性。蛋白质的基团和微观结构的改变表明反胶束体系与蛋白质发生了相互作用,如蛋白质的羟基、氢键与表面活性剂之间的作用,有机溶剂、蛋白质的疏水基团与表面活性剂之间的作用等,这些作用都对蛋白质的微观结构产生了一定影响。
4.2 反胶束萃取法对植物蛋白质功能特性的影响
中国植物蛋白资源丰富、营养价值高,被广泛应用于乳制品加工、肉制品中、烘焙食品及面制品中、罐头食品、饮料生产和保健食品等行业[33,34]。对反胶束萃取法分离的植物蛋白质的功能特性进行研究,有利于改善植物蛋白在生产应用中的稳定性、乳化性、发泡性等性能,提高其营养价值、消化利用率和保健功效,更好地满足消费者的需求。
陈复生等[35]分别用超声辅助 AOT/异辛烷反胶束、AOT/异辛烷反胶束和碱溶酸沉法提取大豆蛋白,并研究了其功能性差异。结果表明超声辅助反胶束萃取的大豆蛋白不仅蛋白质含量高,且持水性、起泡性及其稳定性、乳化性及其稳定性均优于其他两种蛋白,但溶解性略低于AOT/异辛烷反胶束萃取的大豆蛋白。通过电子显微镜扫描仪观察发现3种蛋白的微观结构均不相同,表明在反胶束和超声波的特殊环境中,蛋白质微观结构发生了变化,从而影响了其功能性质。Zhu等[36]在研究反胶束萃取的脱脂小麦胚芽蛋白的功能特性时指出,分离的小麦胚芽蛋白起泡性及泡沫稳定性高于蛋清标准,是一种高潜力蛋白,有望成为鸡蛋蛋白的廉价替代品。
4.3 反胶束萃取法对植物蛋白质物理性质的影响
食品加工过程中,蛋白质受热内部氢键断裂,会导致蛋白质分子展开,这个过程需要吸热,称之为变性热。蛋白质分子变性过程会伴随着能量的变化,差示扫描量热法(DSC)可以对其进行测量[37]。因此,研究反胶束萃取的植物蛋白质的热特性和流变学特性对其功能特性的分析以及进行工业生产的应用提供了重要依据。
Zhao等[38]用DSC分析了两种萃取方法(AOT反胶束萃取、水相萃取)获得的7s、11s球蛋白热特性和流变学特性,结果发现两者萃取的7s、11s的变性温度和转变焓与水相萃取的均不相同。AOT反胶束萃取法不影响11s的凝胶特性,但7s受到影响。反胶束萃得的7s球蛋白的硬度、弹性、粘附性和咀嚼性均低于传统水溶液萃取的,但胶黏性稍高。李飞等[39]用DSC对反胶束萃取玉米胚芽蛋白热特性进行研究发现,蛋白质在吸热过程中,分子结构由有序变为无序,热变性温度和变性焓较高,说明反胶束萃取的蛋白质结构紧密,稳定性好。与传统的蛋白质分离方法相比,反胶束体系萃取的蛋白质并没有发生较大的变性,根据萃取的蛋白种类不同,其凝胶性、咀嚼性、弹性、粘附性等受到了一定程度的影响。研究萃取蛋白的热特性和流变学特性对其应用于食品工业生产中有着重要意义,不仅可以提高资源利用率,还可以改善产品风味口感,增加营养价值[40]。
5 结束语
反胶束萃取技术在植物蛋白质的提取方面具有显著优势,而且具有广阔的应用前景。但反胶束萃取技术由于条件限制,尚未实现工业化生产,而且萃取过程中还存在一些问题亟待克服:① 有机溶剂和表面活性剂仍有残留,需研究开发一种天然安全的新型反胶束体系,以满足工业生产安全性的要求;②反胶束萃取引起植物蛋白质结构变化的原因尚不明确,需进一步研究萃取物的微观结构和特性,并与传统方法对比分析反胶束萃取法的优劣;③ 反胶束萃取的传质模型仍未确定,需深入研究反胶束萃取过程提出传质模型并验证。以上问题的解决有助于提高反胶束萃取效率,优化反胶束萃取工艺,为植物蛋白质的提取提供一种重要方法,也为反胶束萃取技术实现工业化生产提供坚实的理论依据。
1 徐向英,王岸娜,林伟静,等.响应面法优化燕麦全粉中蛋白质提取工艺[J].食品与机械,2011,27(5);96~99.
2 艾连中,张灏,陈卫,等.干酪乳杆菌LC2W胞外多糖的分离纯化及性质研究[J].食品与机械,2007,23(1):9~11.
3 赵瑞超,刘金福,陈记峦.苦瓜多糖的树脂纯化及其对 MCF-7增殖抑制作用[J].食品与机械,2011,27(5):78~81,141.
4 Melo E P,Aires-Barros M R,Cabral J M.Reverse micelles and protein biotechnology[J].Biotechnology Annual Review,2001,7:87~129.
5 史红勤,雷夏,沈忠耀.AOT-磷脂反胶团体系萃取蛋白质的研究[J].化工学报,1990(6):702~708.
6 段海霞,曹劲松,彭志英.反胶束萃取技术在食品中的应用研究进展[J].食品与发酵工业,2005,31(5):90~93.
7 石文兵.流动注射化学发光法测定盐酸雷尼替丁——基于在反胶束纳米微反应介质中的反应[J].理化检验(化学分册),2009,45(6):681~683,686.
8 段金友,方积年.反胶束萃取分离生物分子及相关领域的研究进展[J].分析化学,2002,30(3):365~371.
9 李润霞,陈复生,赵俊廷.反胶束萃取技术在食品中的应用研究[J].食品与机械,2006,22(5):115~118,136.
10 郭勇.现代生化技术[M].北京:科学出版社,2005:43~44.
11 冯琳,袁连山,褚莹.反胶束法制备纳米微粒[J].东北师大学报 (自然科学版),1999(3):52~58.
12 程小丽,陈复生,李里特.不同反胶束体系萃取植物蛋白的研究进展[J].食品科技,2009,34(6):223~227.
13 赵晓燕,陈复生,薛文通.不同反胶束体系提取大豆蛋白质的研究[J].食品科学,2007,28(4):109~112.
14 孙秀平,陈军,陈锋亮,等.不同反胶束体系对萃取花生蛋白的影响[J].食品科技,2012,37(1):164~168.
15 郭珍,陈复生,方志锋.复合反胶束萃取花生蛋白的工艺优化[J].食品与机械,2013,29(2):100~104.
16 刘晓艳,闫杰.反胶束体系在蛋白质萃取中应用的研究进展[J].食品工业科技,2010,31(4):374~376,380.
17 任健,徐慧.反胶束法前萃玉米胚芽蛋白的工艺条件优化[J].农业机械,2012(3):64~67.
18 孙晓宏.反胶束法萃取小麦胚芽蛋白的研究[D].无锡:江南大学,2008.
19 Hua Y,Cui S W,Wang Q,et al.Heat induced gelling properties of soy protein isolates prepared from different defatted soybean flours[J].Food Research International,2005,38(4):377~385.
20 Mohamed A,Xu J.Effect of ionic strength and pH on the thermal and rheological properties of soy protein-amylopectin blend[J].Food Chemistry,2003,83(2):227~236.
21 Gochman-Hecht H,Bianco-Peled H.Structure modifications of AOT reverse micelles due to protein incorporation[J].Journal of Colloid and Interface Science,2006,297(1):276~83.
22 韩丽华,曾茂茂,陈洁,等.大豆浓缩蛋白制备新工艺及其对产品性质的影响[J].食品与机械,2011,27(1):32~35.
23 刘振春,冯建国,刘春萌,等.合成类蛋白工艺优化及产物氨基酸分析[J].食品科学,2013,34(12):76~81.
24 宋丽军,张丽,肖建,等.SCCO2处理对PPO分子特性及构象的影响[J].食品与机械,2010,26(5):6~9.
25 齐银霞,成坚,王琴.核磁共振技术在食品检测方面的应用[J].食品与机械,2008,24(6):117~120.
26 马立娜,李桂娟,李娜娜,等.复合增塑剂对玉米醇溶蛋白膜性能的影响[J].食品与机械,2012,28(3):171~173.
27 Correa N M,Durantini E N,Silber J J.Binding of nitrodiphenylamines to reverse micelles of AOT in n-hexane and carbon tetrachloride:solvent and substituent effects[J].Journal of Colloid and Interface Science,1998,208(1):96~103.
28 Matzke S F,Creagh A L,Haynes C A,et al.Mechanisms of protein solubilization in reverse micelles[J].Biotechnology and Bioengineering,1992,40(1):91~102.
29 Qinglong C,Jiayong L H C.Fourier transform infared spectra studies of protein in reverse micelles:effect of AOT/isooctane on the secondary stucture of(-chymotrypsin[J].Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,1994,1 206(2):247~252.
30 Chen X,Chen J,Chen F,et al.FTIR spectroscopic characterization of soy proteins obtained through AOT reverse micelles[J].Food Hydrocolloids,2012,31(2):435~437.
31 Zhao X,Ao Q,Chen F,et al.Effect of reverse micelle on conformation of soy globulins:A Raman study[J].Food Chemistry,2009,116(1):176~182.
32 高亚辉,张书霞,陈复生,等.利用反胶束萃取技术制备大豆蛋白的产品组分研究[J].粮油加工,2010(1):15~17.
33 赵晓燕,孙秀平,陈锋亮,等.花生蛋白的研究进展与开发利用现状[J].中国粮油学报,2011,26(12):118~122.
34 敬珊珊,刘晓兰,郑喜群.玉米蛋白加工利用研究进展[J].食品与机械,2012,28(1):259~263.
35 陈复生,程小丽,李里特.不同萃取方法对大豆分离蛋白功能特性的影响研究[J].中国食品添加剂,2009(6):131~135.
36 Zhu K X,Sun X H,Chen Z C,et al.Comparison of functional properties and secondary structures of defatted wheat germ proteins separated by reverse micelles and alkaline extraction and isoelectric precipitation[J].Food Chemistry,2010,123(4):1 163~1 169.
37 黄海.DSC在食品中的运用[J].食品与机械,2002(2):6~9.
38 Zhao X,Chen F,Chen J,et al.Effects of AOT reverse micelle on properties of soy globulins[J].Food Chemistry,2008,111(3):599~605.
39 李飞.反胶束法同时提取玉米胚芽油脂和蛋白质的研究[D].无锡:江南大学,2009.
40 刘爱洁,冯立科,李理.大豆萌发对大豆酸奶品质的影响[J].食品与机械,2013,29(2):13~17.
