丘脑肿瘤手术入路的选择(21例报告)
2013-09-17严玉金陈高王林严锋
严玉金 陈高王林严锋
丘脑肿瘤由于其位置深、手术视野狭窄、暴露困难,且与下丘脑、内囊、中脑等脑内重要神经结构相邻,深部血管网复杂,手术风险较大,术后并发症较多,死亡率、致残率较高,其外科治疗一直是神经外科学界难题之一[1]。随着显微神经外科技术的迅速发展,根据丘脑肿瘤不同的部位,选择合适的手术入路,使丘脑肿瘤的手术切除率明显提高,我院2008年9月到2011年9月收治的21例丘脑肿瘤患者,根据肿瘤的部位特点,采取合适的手术入路,取得了满意效果,现报道如下。
1 资料
1.1 一般资料 入选标准:本次手术前未行放、化疗,肿瘤的主体位于丘脑。排除标准:双侧或弥漫性生长至丘脑的肿瘤。本组收集2008年9月到2011年9月本院收治的丘脑区肿瘤21例,其中男12例,女9例,年龄5~66岁,平均(38.2±1.3)岁。病程1个月~3年,平均(6.0±1.5)个月。临床表现为头痛、恶心等颅高压症状16例,感觉异常(肢体麻木、肢体痛等)6例,运动障碍(偏瘫、手足震颤等)9例,癫痫3例,视觉异常(视力下降、视野缺损、复视等)5例,下丘脑症状(低热、发育迟缓、多饮多尿等)2例,记忆减退、智力下降或精神症状8例。
1.2 影像学检查 术前诊断主要依据头颅MRI。肿瘤部位:左丘脑前部6例,左丘脑后部4例,左整丘脑1例,右丘脑前部5例,右丘脑后部3例,右整丘脑2例。本组肿瘤最大直径 1.3~6.6cm,平均 3.7cm。MRI示 T1WI低信号及等信号17例,混杂信号1例,高信号3例;T2WI呈高信号19例,混杂信号2例;注药后强化明显15例,强化不明显6例。边界清16例,边界不清5例,其中瘤周明显水肿者11例,合并脑积水8例。
1.3 方法 本组21例丘脑肿瘤均采用直接开颅显微外科切除。7例经外侧裂入路,采用改良翼点切口,解剖外侧裂,暴露岛叶,从岛叶中后部切开岛叶皮层进入肿瘤腔,分块切除肿瘤(图1)。4例经额叶经侧脑室前角入路,在额中回切开皮质或皮层造漏,向孟氏孔方向钝性分离脑白质直达脑室,经扩大的孟氏孔到肿瘤位置切除肿瘤(图2)。6例经顶枕经侧脑室三角区入路,通过顶枕部开颅,在中央后回后方2cm纵行切开顶上小叶,在三角区和体部的结合部进入侧脑室内,暴露肿瘤并切除(图3)。4例经胼胝体入路,根据肿瘤的位置分别采用胼胝体-透明隔-穹窿间入路和经胼胝体经脑室入路,做右额发际内冠状切口,在冠状缝向前2cm,双侧外耳道假想边线中点分离纵裂,纵行切开胼胝体体部,进入脑室或进入透明隔、穹窿,见到肿瘤后切除(图4)。

图1 丘脑胶质瘤经外侧裂入路全切除(左图:术前,右图:术后)
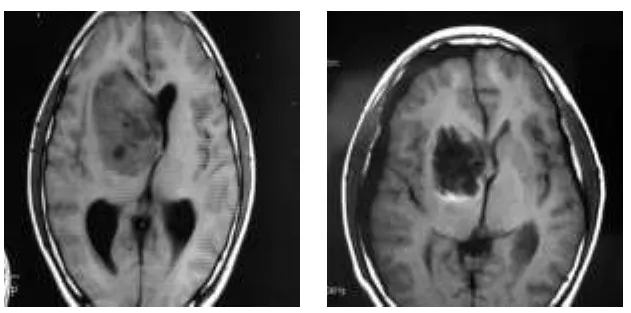
图2 丘脑胶质瘤经额叶经侧脑室前角入路全切除(左图:术前,右图:术后)

图3 丘脑后部胶质瘤经顶枕经侧脑室三角区入路全切除(左图:术前,右图:术后)

图4 丘脑胶质瘤经胼胝体入路全切除(左图:术前,右图:术后)
2 结果
肿瘤全切除9例,次全切除5例,大部切除5例,部分切除2例。对于边界清楚,水肿不明显的基本能做到全切除或次全切除,而水肿明显肿瘤呈扩展型的只能做到次全切除或大部切除甚至部分切除。7例经外侧裂入路有4例全切除,3例次全切除。4例经额叶经侧脑室前角入路,全切除2例,次全切除1例,大部切除除1例。6例经顶枕经侧脑室三角区入路,全切2例,次全切除1例,大部分切除3例。4例经纵裂胼胝体入路,全切除1例,大部切除1例,部分切除2例。本组均经手术病理证实,胶质瘤17例(星形细胞瘤Ⅰ-Ⅱ级6例,Ⅲ-Ⅳ级8例,少突胶质细胞瘤、少突-星形细胞瘤、室管膜瘤各1例),生殖细胞瘤2例,淋巴瘤1例,转移瘤1例。术前合并脑积水8例,术后4例改善,无改善的4例行脑室-腹腔分流术。本组出院时症状,改善8例,稳定9例,加重3例,死亡1例。死亡的1例病理结果为WHO IV级胶质母细胞瘤,术中见肿瘤血供丰富,边界不清,术中作次全切除,术后手术区出血,引起脑疝,中枢衰竭,次日死亡。本组15例随访6~48个月,7例良好生存,4例生活基本自理;2例严重残疾,生活不能自理;2例死亡。手术切除程度与随访结果的关系见表1。

表1 随访时KPS与手术切除程度的关系
3 讨论
丘脑肿瘤人群发病率低,仅占颅内肿瘤的1%~5%[2],起病较为隐匿,临床表现复杂,特别是那些生长缓慢,临床表现不典型的病例,常被当作内科和眼科疾病进行诊治,延误确诊[3]。近年来,随着影像诊断技术、手术条件及手术技术的进步,丘脑肿瘤一经诊断,手术的致残率、死亡率已明显下降。手术成功的关键之一是必须对肿瘤的位置和手术入路有充分的认识。Schmidek等[4]根据丘脑肿瘤的局部解剖关系进行了分类:①前部肿瘤,肿瘤位于Monro孔水平;②后部肿瘤,肿瘤占据丘脑后部和丘脑后结节;③侧方肿瘤;④肿瘤占据整个丘脑并向周围结构浸润,可累及双侧丘脑和中脑。我们认为这种分类方法对丘脑肿瘤的治疗方案的制定有一定的临床指导意义,前3类比较适合于外科手术,在现代神经外科技术设备的支持下,考虑肿瘤性质同时应把全切除作为外科治疗的目标。对于第④类病人,手术应以明确诊断和减压为目的,如果手术中刻意追求全切除,可能引起灾难性后果。
各种入路的选择至关重要,入路的选择主要是由肿瘤的影像特征决定的,包括肿瘤的形状、大小、生长方向、与正常脑组织的关系、有时也受肿瘤供血动脉的位置及多少,脑室扩大以及手术医生习惯的影响。各种入路均有其适应条件及手术并发症[5]:①经外侧裂岛叶入路适合于丘脑肿瘤向后外侧岛叶方向生长的情况,这时该入路到肿瘤部位路径最短,对脑组织的侵入较小,而且不经过脑室系统而降低了术后脑积水的发生。但该入路的难点是外侧裂的解剖和岛叶切开部位的选择,岛叶切开的部位应该在岛叶中央后回的中部,否则有损伤内囊后肢的危险。本组5例术前均有不同程度的偏瘫,术后稳定3例,加重2例。②经皮层经脑室入路适合于大多数前部或后部偏一侧的丘脑肿瘤的切除,尤其适合于有脑室扩大的情况。可分为经额中回入路和经顶枕入路,选择前角入路还是三角区或后角入路主要是根据肿瘤和室间孔的关系,肿瘤向前生长超出室间孔方向的采用前角入路,反之采用三角区或后角入路。由于丘脑肿瘤有向脑室生长的倾向,该入路通过切开皮层经脑室切除肿瘤,手术路径相对简单,肿瘤容易暴露,而且一般不会损伤穹隆及前后向分布的胼周动脉和深部引流静脉。但该入路通常情况下经纵切皮层或皮层造瘘进脑室切除肿瘤,但当肿瘤长向丘脑内侧或对侧时,该入路对其内侧面暴露困难,特别对于血供丰富的肿瘤,有时因暴露不够而很难控制出血,引起手术风险增加和切除率下降。本组4例经额叶经侧脑室前角入路,6例经顶枕经侧脑室三角区入路,成功切除肿瘤。③经胼胝体入路也分为经胼胝体-透明隔-穹窿间入路和经胼胝体经脑室入路,该入路经纵裂切开胼胝体进入侧脑室或三脑室切除肿瘤,避免了皮层的破坏和损伤,减少了癫痫的发生率,中线部位视野相对较开阔,可以对三脑室前后进行探查,比较适合于没有脑积水的丘脑肿瘤。但该入路在肿瘤长向外侧使穹隆的中前部变形时可产生操作困难,对肿瘤的前外侧面的暴露困难。经胼胝体入路不可避免地影响穹隆,常见的并发症是记忆障碍和缄默,其机理可能在于胼胝体切开或穹隆柱受损造成的[6],根据本组情况来看,4例都是一过性的,一般在2周内好转。
手术要注意以下技巧:①经额入路和经顶枕入路切开皮层时,尽量采用脑沟入路,切口不宜过长(一般不超过2cm),减少牵拉压迫,其内侧重要的深部引流静脉不能损伤。②进入侧脑室后,首先要明确脑室的立体形状。辨认脑室壁的重要结构。侧脑室体部的下壁为丘脑,丘纹静脉是重要的解剖学标志,丘纹静脉在丘脑与尾核之间向前向内经室间孔汇人大脑内静脉、手术过程中要注意保护,否则会引起严重的脑水肿。③切除肿瘤要注意及时止血,并用带线脑棉将脑室系统其他部分与肿瘤手术区分隔,防止出血向远处弥散引起术后脑脊液循环不畅。④切除肿瘤时动作轻柔准确,可先行瘤内分块切除,待肿瘤体积缩小后再分离切除肿瘤的边缘,牵拉要适度,防止瘤周重要结构的损伤。总的来说,大部分丘脑肿瘤是星形胶质细胞瘤,对于低级别胶质瘤,大多数肿瘤较局限,边界较清,术中可争取全切,若边界不清,盲目争取全切除可能造成严重神经功能损害,术中使用B超识别肿瘤边界,可提高切除率。对于高级别的星形细胞瘤和胶质母细胞瘤,大多边界不清,血管丰富,手术难度和风险大,全切除可能性减小,但尽可能多切肿瘤应是我们的目标。
由于技术和设备的发展,丘脑肿瘤的手术死亡率及致残率分别降至可以接受的程度。本组手术死亡率和致残率不高,而且术后致残的部分病例在随访过程中逐渐恢复。尽管如此,但丘脑肿瘤的整体预后仍不容乐观[7]。影响丘脑肿瘤预后的因素很多[8],包括病理类型、切除率、病人年龄、肿瘤的大小等[9]。根据丘脑肿瘤不同的部位,选择合适的手术入路,提高手术切除率,能使患者能长期生存,并且有较好的生活质量。
[1]Baroncini M,Vinchon M,Minéo JF,et al.Surgical resection of thalamus tumors in children:approaches and clinical results[J].Childs Nerv Syst,2007,23(7):753-760.
[2]Puget S,Crimmins DW,Garnett MR,et al.Thalamus tumors in children:a reappraisal[J].Neurosurg.2007,106(5 Suppl):354-362.
[3]Habek M,Brinar VV,Mubrin Z,et al.Bilateral thalamus astrocytoma[J].Neurooncol,2007,84(2):175-177.
[4]施米德克-斯威特.神经外科手术学[M].王任直,译.第4版.北京:人民卫生出版社,2003:78l-783.
[5]Albright AL.Feasibility and advisability of resections of thalamus tumors in pediatric patients[J].Neurosurg,2004,100(5 Suppl Pediatrics):468-472.
[6]Groves MD,Katz RL.Low grade astrocytoma presenting with visual loss[J].Neurooncol,2008,89(1):49-50.
[7]Albright AL.Feasibility and advisability of resections of thalamus tumors in pediatric patients[J].Neurosurg,2004,100(5 Suppl Pediatrics):468-472.
[8]Rasalkar DD,Chu WC,Cheng FW,et al.Atypical location of germinoma in basal ganglia in adolescents:radiological features and treatment outcomes[J].Br J Radiol,2010,83(987):261-267.
[9]Pathy S,Jayalakshmi S,Chander S,et al.Prognostic factors influencing the outcome of thalamus glioma[J].Neurol India,2002,50(1):37-40.
