片仔癀对脑梗死大鼠ZO-1、MMP-9蛋白及mRNA表达的影响1)
2013-09-17黄希艳朱陵群
黄希艳,李 倩,朱陵群
我国每年约有200万新发卒中病例,死于卒中人数约有150万人。在卒中疾病中,缺血性脑卒中占60%~80%[1],因此探讨缺血性脑卒中发病机制及药物保护问题显得尤为重要。片仔癀方由三七、天然麝香、天然牛黄、蛇胆等天然药材组成[2]。具有清热解毒、凉血化瘀、消肿止痛的显著功效[3]。本课题为了进一步了解片仔癀在脑缺血后脑保护的作用,探讨其恢复机制,建立大脑中动脉阻塞(MCAO)大鼠模型,给予片仔癀干预,观察其ZO-1、MMP-9蛋白及mRNA表达的变化,为临床治疗提供理论及实践基础。
1 材料与方法
1.1 动物分组 成年SD大鼠35只,雄性,体重260g±20g,由中国人民解放军军事医学科学院实验动物中心提供,许可证编号:SCXK-(军)2007-004。
大鼠随机分为手术组和假手术组(正常组)。手术组根据术后Longa评分将纳入标准者随机分组,模型组(生理盐水组)、片仔癀大剂量组、片仔癀中剂量组、片仔癀小剂量组脑、得生组、尼莫地平组,每组5只。
1.2 药品与试剂 片仔癀胶囊(漳州片仔癀药业股份有限公司,批号:0711050;);尼莫地平片(拜耳医药保健有限公司,国药准字:H20003010,产品批号:BJ00604,规格:每片含30mg);脑得生(广东国医堂制药股份有限公司,批号110101,糖衣片,片芯重0.3,每盒72片);一抗:MMP-9为羊多克隆抗体(santa cruz,货号:SC-6841);ZO-1为兔多克隆抗体(santa cruz,货号:SC-1084);Actin兔多克隆抗体(santa cruz,货号:sc-1616);二抗:HRP标羊抗兔IgG 二抗(santa cruz,货号:sc-2004)、HRP标兔抗羊IgG 二抗(santacruz,货号:sc-2768);RNA 抽提试剂盒:尚柏生物医学(北京)有限公司。
1.3 MCAO模型的制备 参考文献[4,5]采用改良 Zea-Longa方法制备。于清醒后2h参照Longa 5级标准[4]对神经功能评分。
1.4 给药方法 按大鼠与人体表面积等效剂量折算,片仔癀实验小剂量、中剂量、大剂量分别设定为每日0.054g/kg、0.162 g/kg、0.486g/kg,脑得生为0.486g/kg,尼莫地平为0.010 8 g/kg。以上各组均于造模前灌胃给药3d,第4天灌胃给药后30min造模,造模后给药观察至第7天,取材。
1.5 标本制备 分别于MCAO术后第3天取各组大鼠5只,经3.5%水合氯醛腹腔注射麻醉后,迅速断头处死大鼠,立即取右侧梗死区大脑皮层(约120mg),放入冻存管后置于液氮罐中保存,以备行western blot及实时荧光PCR检测。
1.6 MMP-9、ZO-1蛋白测定 每组组织各取20mg左右置入预冷的研钵中,倒入液氮,迅速研磨成粉末状,加入1mL总蛋白提取液,冰上裂解20min,离心后取上清液即为总蛋白;BCA法样品蛋白浓度测定后5×buffer缓冲液在100℃沸水中煮沸10min;转膜;5%脱脂奶粉封闭,37℃摇床孵育1h;一抗用含5%脱脂奶粉稀释1∶200,二抗1∶3000;ECL曝光:使用ECL化学发光显色液(SUNBIO)。
1.7 MMP-9、ZO-1mRNA测定 应用总RNA提取试剂盒,用一步法RQ-PCR试剂盒(Promega Corporation)进行检测。ZO-1、MMP-9引物由尚柏生物医学(北京)有限公司使用Primer express 3.0软件设计并合成上下游引物,选用actin作为内参校正样品的RNA含量。
2 结 果
2.1 片仔癀对ZO-1、MMP-9蛋白表达的影响与假手术组相比,模型组ZO-1表达显著降低(P<0.01),与模型组相比,片仔癀大剂量组、尼莫地平组及脑得生组ZO-1表达显著升高(P<0.05);片仔癀大剂量组较片仔癀小剂量组有统计学意义(P<0.05)。详见表1。
表1 ZO-1蛋白表达的变化(±s)
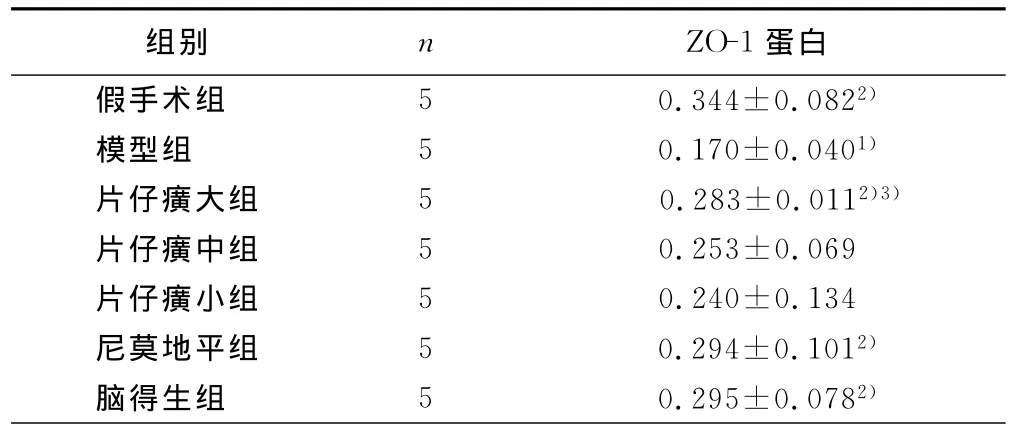
表1 ZO-1蛋白表达的变化(±s)
与假手术组相比,1)P<0.01;与模型组相比,2)P<0.05;与片仔癀小剂量组相比,3)P<0.05
组别 n ZO-1蛋白假手术组 5 0.344±0.0822)模型组 5 0.170±0.0401)片仔癀大组 5 0.283±0.0112)3)片仔癀中组 5 0.253±0.069片仔癀小组 5 0.240±0.134尼莫地平组 5 0.294±0.1012)脑得生组 5 0.295±0.0782)
1)为国家科技重大专项基金课题(重大新药创制,No:2008ZX09202)
用Western Blot方法检测片仔癀对MCAO大鼠术后MMP-9表达的影响,与假手术组相比,模型组MMP-9表达显著升高(P<0.01),与模型组相比,片仔癀大剂量组、尼莫地平组及脑得生组MMP-9表达显著降低(P<0.05);片仔癀大剂量组较片仔癀小剂量组有统计学意义(P<0.05)。详见表2。
表2 MMP-9蛋白的表达变化OD值分析(±s)
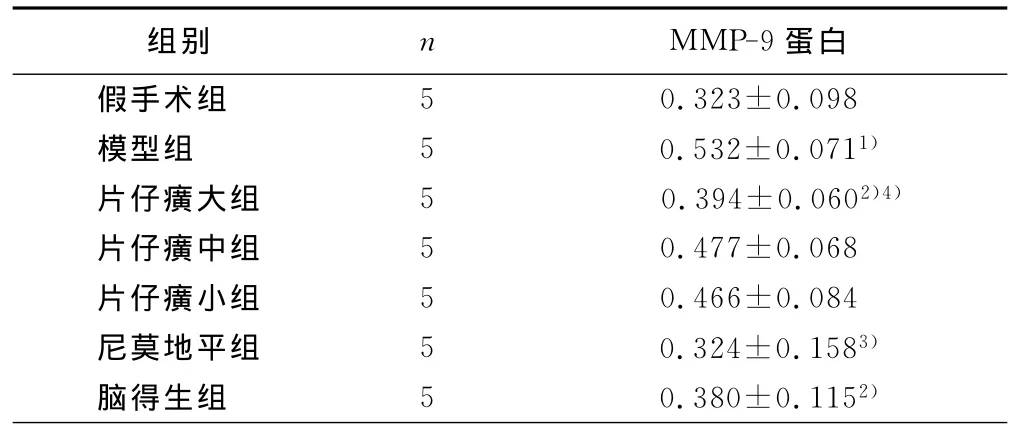
表2 MMP-9蛋白的表达变化OD值分析(±s)
与假手术组相比,1)P<0.01;与模型组相比,2)P<0.05,3)P<0.01;与片仔癀小剂量组相比,4)P<0.05
组别 n MMP-9蛋白假手术组5 0.323±0.098模型组 5 0.532±0.0711)片仔癀大组 5 0.394±0.0602)4)片仔癀中组 5 0.477±0.068片仔癀小组 5 0.466±0.084尼莫地平组 5 0.324±0.1583)脑得生组 5 0.380±0.1152)
2.2 片仔癀对ZO-1、MMP-9mRNA表达的影响 用RQ-PCR方法检测片仔癀对 MCAO大鼠术后ZO-1mRNA表达的影响,与假手术组比较,模型组ZO-1mRNA表达显著降低(P<0.01),与模型组比较,片仔癀大剂量组、中剂量组、尼莫地平组及脑得生组较模型组显著升高(P<0.01)。详见表3。
表3 ZO-1mRNA表达变化(±s,2-△△Ct)
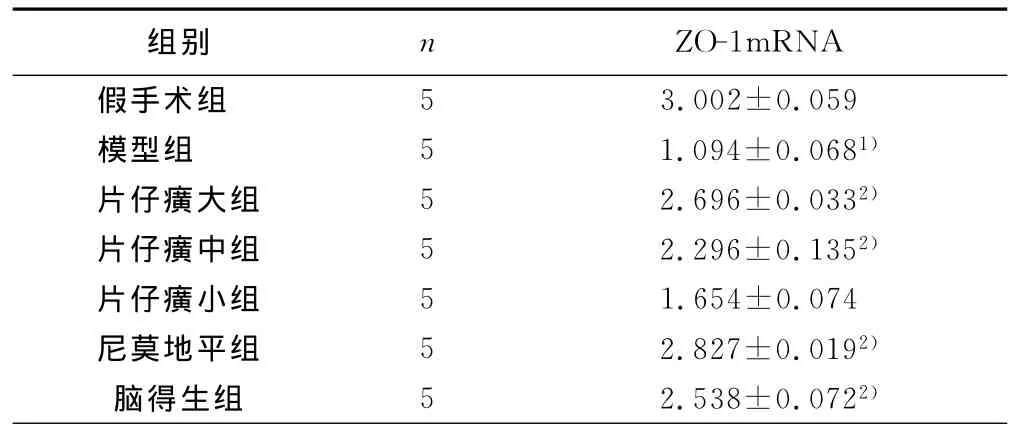
表3 ZO-1mRNA表达变化(±s,2-△△Ct)
与假手术组相比,1)P<0.01;与模型组相比,2)P<0.01
组别 n ZO-1mRNA假手术组5 3.002±0.059模型组 5 1.094±0.0681)片仔癀大组 5 2.696±0.0332)片仔癀中组 5 2.296±0.1352)片仔癀小组 5 1.654±0.074尼莫地平组 5 2.827±0.0192)脑得生组 5 2.538±0.0722)
用RQ-PCR方法检测片仔癀对 MCAO大鼠术后 MMP-9mRNA表达的影响,与假手术比较,模型组 MMP-9mRNA表达显著升高(P<0.01),与模型组比较,片仔癀大剂量组、中剂量组、小剂量组、尼莫地平组及脑得生组较模型组显著降低(P<0.05)。详见表4。
表4 MMP-9mRNA表达变化(±s,2-△△Ct)

表4 MMP-9mRNA表达变化(±s,2-△△Ct)
与假手术组相比,1)P<0.01;与模型组相比,2)P<0.05
组别 n MMP-9mRNA假手术组5 0.436±0.018模型组 5 0.970±0.0141)片仔癀大组 5 0.680±0.0232)片仔癀中组 5 0.800±0.0343片仔癀小组 5 0.920±0.0302)尼莫地平组 5 0.476±0.0242)脑得生组 5 0.591±0.0182)
3 讨 论
缺血性中风一直是临床上的治疗难题,血脑屏障(blood brain barrier,BBB)的破坏既是脑缺血损伤的结果,又是进一步导致脑损伤的关键环节[6],而BBB通透性的改变与紧密连接(tight junction,TJ)的主要成分ZO-1分布及缺失密切相关[7]。同时MMP-9在血脑屏障的损伤中扮演着重要作用[8,9]。在正常状态下,MMP-9被控制在较低水平,不会过度激活。但在缺血性脑损伤发生时,其活性明显增加,促使血脑屏障微血管基膜遭到破坏,导致继发性脑水肿和脑出血等一系列生理病理改变。
片仔癀具有清热解毒、活血祛瘀之功效,运用于治疗缺血性中风取得了很好的疗效。本实验结果提示,片仔癀药物组ZO-1蛋白及mRNA的表达较模型组增高,脑缺血发生后应用片仔癀可上调ZO-1蛋白及mRNA的表达,同时片仔癀药物组MMP-9蛋白及mRNA的表达较模型组下降,脑缺血发生后应用片仔癀可下调MMP-9蛋白及mRNA的表达,这可能是片仔癀促进脑梗死后功能恢复的可能机制之一,可为脑保护剂研制提供新的思路和方法。
[1] 中华医学会神经病学分会脑血管病学指南撰写组[J].中国急性缺血性脑卒中诊经科杂志,2010,43(2):146-153.
[2] 刘丛盛.片仔癀药理及临床应用综述[J].医药世界,2006(7):64-66.
[3] 徐武英,阎庚飞.片仔癀治疗病毒性肝炎的疗效观察[J].黑龙江医药,2003,16(6):542-543.
[4] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomyin rats[J].Stroke,1989,20(1):84-91.
[5] 徐叔云,卞如濂,陈修.药理实验方法学[M].第3版.北京:人民卫生出版社,2002:1066-1067.
[6] Allen CL,Bayraktutan U.Oxidative stress and its role in the pathogenesis of ischaemic stroke[J].Int J Stroke,2009,4(6):461-470.
[7] Jiao H,Wan g Z,Liu Y,et al.Specific role of tight junction proteins Claudin-5,occludin,and ZO-1of the blood brain barrier in a focal cerebral ischemic insult[J].J Mol Neurosci,2011,4(22):130-139.
[8] 毛玲,查运红,梅元武.基质金属蛋白酶-9与脑缺血血脑屏障损伤的关系[J].国际神经病学神经外科学杂志,2006,33(1):96-98.
[9] 李小记,王航辉,米志宽.L-硝基-精氨酸甲酯对大鼠脑缺血再灌注损伤后血脑屏障功能和基质金属蛋白酶-9表达的影响[J].陕西医学杂志,2009,38(5):537-540.
