制备高效液相色谱法分离纯化大黄酚和大黄素甲醚
2013-09-14田嘉铭信秀玲王书华
田嘉铭, 饶 娜, 信秀玲, 王书华
(河北北方学院药学系,河北张家口075000)
大黄酚和大黄素甲醚为蓼科植物大黄中的两种有效成分单体,属蒽醌类化合物,大黄酚具有止咳、抗菌、止血、降血糖、收缩血管、降低血管脆性的作用,能消除体内自由基,有明显的抗衰老和促进学习记忆的作用[1-4],大黄素甲醚对大肠杆菌等26种细菌有抑制作用,对人体宫颈癌Hela细胞生长具有较强的抑制作用[5]。
在植物体内,大黄酚和大黄素甲醚常共同存在,结构见图1。
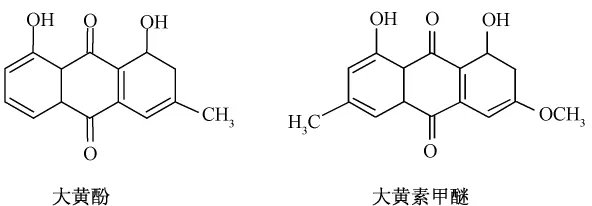
图1 大黄酚和大黄素甲醚结构图
两种化合物结构相似,酸性与极性相近,使分离工作极为困难。大黄酚、大黄素甲醚的分离纯化方法有柱色谱法、薄层色谱法、高效毛细管电泳法等,但操作繁琐、制备量低。
制备高效液相色谱 (PHPLC)法已成为当今高效分离与纯化中药有效成分的重要技术手段,在制备高纯度生物活性物质时,操作简单,制备量大[6],而用PHPLC分离纯化大黄酚和大黄素甲醚的研究尚未见报道。本实验建立了PHPLC分离、纯化大黄中大黄酚和大黄素甲醚的分析方法,为大黄酚和大黄素甲醚的实验室大规模制备提供了实验依据。
1 材料与仪器
1.1 材料与试剂 大黄购于张家口市张垣中药饮片有限公司,甘肃,批号为090801;大黄酚对照品,批号为110796-200310,大黄素甲醚对照品,批号为0758-9803,中国药品生物制品检定所;甲醇为色谱纯,其它试剂均为分析纯。
1.2 仪器 Agilent 1100 HPLC(美国安捷伦公司);Agilent1200 Preparative HPLC(美国安捷伦公司);MODUL YOD-230真空冷冻干燥系统 (美国热电公司);ME-SE Series电子天平 (德国赛多利斯公司);SGW X-4显微熔点仪(上海精密科学仪器有限公司);U-3900紫外可见分光光度计 (日本日立公司);BRUKER AVANCE-400兆液体谱仪(德国布鲁克公司);LD-04高速中药粉碎机 (浙江省温岭市大海药材机械厂)。
2 方法与结果
2.1 大黄中大黄酚和大黄素甲醚粗产品的提取 按文献[7]并改进,称取干燥粉碎的大黄粉末 (过60目筛)400.0 g置于2 L圆底烧瓶中,加入适量的石油醚,常压恒温 (62~63℃)回流1 h,趁热过滤,滤渣真空干燥(50℃,0.08 MPa)。称真空干燥的大黄粉末200.0 g,加15%的硫酸溶液400 mL,搅拌均匀,密封5 d,加入三氯甲烷1 000 mL回流提取2次,每次3 h(温度61.7~63.0℃),稍冷后抽滤,弃去残渣,将三氯甲烷提取液转入分液漏斗中,用蒸馏水洗涤三氯甲烷提取液。将三氯甲烷提取液置于1 000 mL分液漏斗中,用5%碳酸氢钠、5%碳酸钠、5%氢氧化钠依次萃取,直至三氯甲烷溶液的颜色变为黄色 (除去大黄酸、大黄素、芦荟大黄素等)。将含有大黄酚和大黄素甲醚的三氯甲烷溶液减压浓缩 (42~43℃,0.08 MPa)至200 m L,用5%氢氧化钠溶液反复萃取三氯甲烷溶液中的大黄酚和大黄素甲醚,同时用高效液相色谱法定量,跟踪检测大黄酚和大黄素甲醚的萃取过程。合并几次萃取的5%氢氧化钠溶液,滴加盐酸至pH值为3,减压浓缩该溶液至有沉淀析出,抽滤,用蒸馏水洗涤沉淀,低温高速离心 (1 000 r/min,8 min),用AgNO3随时监测上清液中的氯离子,直至氯离子消失。沉淀物自然干燥得大黄酚和大黄素甲醚混合物粗品。
2.2 HPLC法测定大黄酚和大黄素甲醚[8-9]
2.2.1 色谱条件 Hypersil ODS2色谱柱 (4.6 mm×150 mm,5.0μm),柱温35℃,进样量20μL,流动相为甲醇-0.1%磷酸溶液 (85∶15),体积流量1 mL/min,检测波长254 nm。
2.2.2 标准曲线的制作 精密称取大黄酚、大黄素甲醚对照品1.0 mg,甲醇溶解、定容,配成0.10 mg/mL的标准溶液。吸取标准溶液分别配成质量浓度为1.0、5.0、10.0、15.0、20.0μg/mL的标准溶液,按色谱条件进样,以质量浓度对峰面积进行线性回归,得标准曲线方程为:大黄酚Y=3.431X-3.987,r=0.999 8,线性范围为1.0~20.0 μg/mL。大黄素甲醚:Y=1.703X+11.839,r=0.999 6,线性范围为1.0~20.0μg/mL。
2.2.3 供试品的定量测定 采用外标法。按2.2.1项色谱条件测定,将大黄酚和大黄素甲醚峰面积代入标准曲线方程,得大黄酚和大黄素甲醚质量浓度,计算含有量。
2.3 PHPLC分离纯化大黄酚和大黄素甲醚
2.3.1 检测波长的选择 大黄酚、大黄素甲醚对照品,甲醇溶解,经U-3900紫外分光光度计在200~450 nm扫描,结果大黄酚、大黄素甲醚均在254 nm有吸收,且灵敏度较高。因此,选择254 nm为检测波长。
2.3.2 制备液相色谱条件 色谱柱为ZORBAX SB-C18(21.2 mm×250 mm,7μm),流动相为甲醇-0.1%磷酸溶液 (85∶15),柱温30℃,进样量8 mL,体积流量20 mL/min,检测波长254 nm,基于峰进行馏分收集,最小阈值为2.0 mAU。
2.3.3 制备大黄酚和大黄素甲醚 用适量流动相溶解2.1项的大黄酚与大黄素甲醚粗品,过0.45μm微孔滤膜。按制备色谱条件进样,根据制备色谱图收集大黄酚与大黄素甲醚馏分,馏分经减压浓缩,至有少量晶体析出时,真空冷冻干燥,得大黄酚1.780 2 g,大黄素甲醚0.980 2 g。见图2。
2.4 制备所得大黄酚和大黄素甲醚纯度检测 对照品定性,见图3、4,将制备所得大黄酚和大黄素甲醚按2.2.1项色谱条件下进行定量测定,采用峰面积归一化法,大黄酚的纯度为98.1%(杂质峰面积为25.7,大黄酚峰面积为1 323),外标法定量,测得大黄酚质量分数为98.8%(n=3),大黄素甲醚的纯度为98.3%(杂质峰面积之和为19.3,大黄素甲醚峰面积为1 149.8),外标法定量,测得大黄素甲醚质量分数为98.7%(n=3)。
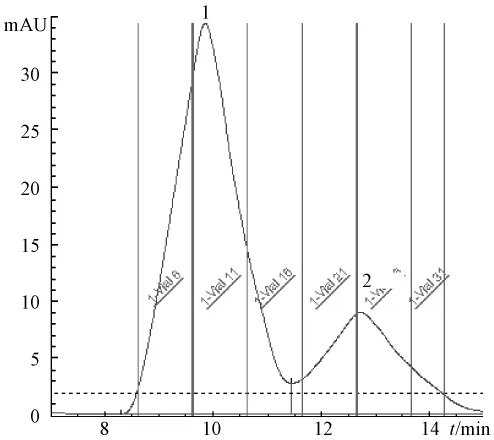
图2 大黄酚和大黄素甲醚制备液相色谱图
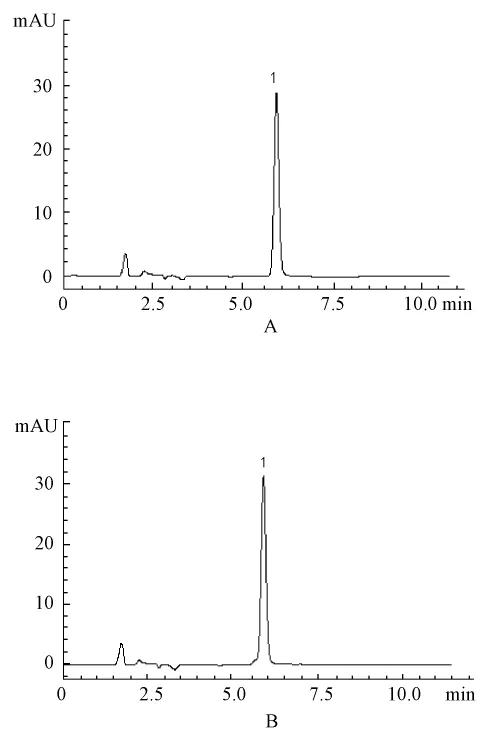
图3 大黄酚HPLC图
2.5 大黄酚和大黄素甲醚结构鉴定
所得单体大黄酚为黄色晶体,熔点仪未校正,mp 184~185℃,与对照品混合熔点不下降。1H-NMR进行结构鉴定,1H-NMR(DMSO-d6)δ:12.17(1H,s, - OH),12.07(1H,s, - OH),7.87(1H,d,C5-H),7.72(1H,dd,C6-H),7.70(1H,s,C4-H),7.32(1H,dd,C7-H),7.15(1H,s,C2-H),2.51(3H,s,Ar-CH3)。数据与文献[10]报道一致。
所得单体大黄素甲醚为橙红色晶体,熔点仪未校正,mp 203~204℃,与对照品混合熔点不下降。1H-NMR进行结构鉴定,结果为:1H-NMR(DMSO-d6)δ:12.30(1H,s, - OH),12.29(1H,s, - OH),7.35(1H,d,C5-H),7.58(1H,d,C4-H),7.69(1H,d,C7-H),7.05(1H,s,C2-H),3.96(3H,s,OCH3),2.46(3H,s,Ar-CH3)。数据与文献 [11]报道一致。
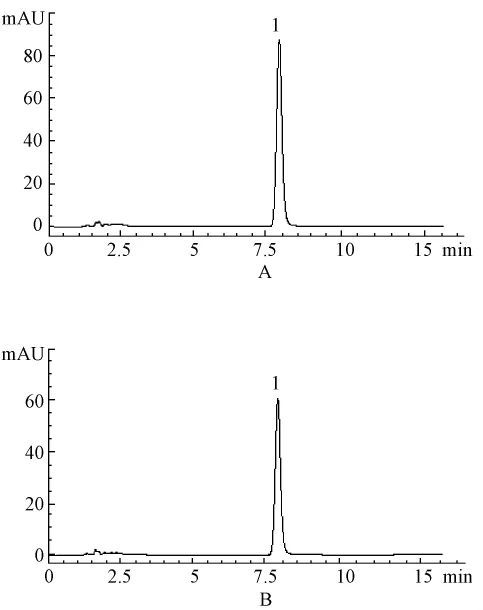
图4 大黄素甲醚HPLC图
3 讨论
3.1 提取条件的选择 按文献[7]提取时,提取物冷冻干燥时总会有油状物存在,干燥不完全,考虑可能是挥发油类物质,经查文献,大黄酚和大黄素甲醚在石油醚中几乎不溶,为此我们选择先用石油醚对大黄进行脱脂处理,在用5%氢氧化钠萃取大黄酚和大黄素甲醚过程中,先对三氯甲烷溶液减压浓缩,节省了氢氧化钠的使用量,同时采用HPLC实时检测大黄酚和大黄素甲醚的萃取过程,比文献[7]中报道的单纯靠颜色判断萃取过程更加准确可靠。
3.2 流动相和体积流量的选择 大黄酚和大黄素甲醚均具有一定的极性和酸性,考察了不同比例的甲醇-1%醋酸,乙腈-1%醋酸,甲醇-0.1%磷酸,乙腈-0.1%磷酸对分离效果的影响,结果表明,同一条件下甲醇-0.1%磷酸 (85∶15)作为流动相时,大黄酚和大黄素甲醚可以达到基线分离,出峰时间短 (20 min)。在流动相选定的条件下,考察了不同体积流量 (10~25 mL/min)对分离大黄酚和大黄素甲醚的影响,当体积流量小于20 m L/min时,虽然大黄酚和大黄素甲醚能很好的分离,但保留时间延长,所需流动相的量增加,造成试剂的浪费;而增大体积流量虽然能够缩短保留时间,但体积流量大于20 mL/min时,大黄酚和大黄素甲醚分离效果不佳,本实验选择体积流量为20 mL/min。
3.3 进样量的选择 在样品质量浓度一定条件下,考察了不同进样体积(4~10 mL)对大黄酚和大黄素甲醚分离度的影响。实验结果表明,小于8 mL进样体积范围内,分离度较好,但流动相用量太大,造成浪费;进样体积大于8 mL时,大黄酚和大黄素甲醚重叠严重,无法选取合适的馏分收集位置,使产品纯度无法保证。当进样量为8 mL时,保证了流出曲线的峰对称性。因此,本实验选择进样量为8 mL。
与薄层色谱法、高效毛细管电泳法[12-13]相比较,应用PHPLC法分离制备大黄酚和大黄素甲醚,进样量大,出峰时间短,样品纯度高、操作简便,可用于实验室大规模制取大黄酚和大黄素甲醚对照品。
[1]王开金,张颖君,杨崇仁.蓼属植物的化学成分与生物活性研究进展[J].天然产物研究与开发,2006,18(1):151-164.
[2]朱有光.中药大黄止血作用的研究进展[J].临床和实验医学杂志,2008,7(1):138-139.
[3]张丹参,张 力,薛贵平,等.大黄酚的抗衰老作用[J].中国医院药学杂志,2005,25(1):15-17.
[4]王 树,薛贵平,张丹参,等.大黄酚对脑缺血再灌注小鼠学习记忆障碍及耐缺氧的影响[J].中国药理学通报杂志,2008,37(4):402-404.
[5]唐 康.穗花大黄化学成分的研究[D].成都:西南交通大学,2009.
[6]Hostettmann K,Marston A,Hostettmann M.Preparative chromatography technique applications in natural product isolation[J].Plant Growth Regul,1997,8(4):375-376.
[7]廖华卫,李瑞珍,陈飞苑.大黄中大黄酚的提取、分离和纯化方法的研究[J].中国药房,2006,17(12):6.
[8]谭晓虹,张丹参,张 力,等.大黄酚在兔体内分布研究[J].中成药,2007,29(8):1211-1212.
[9]黄江虹.何首乌中大黄素甲醚的提取、分离和纯化研究[J].中药材,2007,30(3):359-361.
[10]王振月,李延冰,匡海学,等.毛脉酸模根中大黄酚、大黄素的分离鉴定[J].中医药学报,1996(2):54.
[11]Yang Xiuwei,Gu Zhming,Ma Chaomei,et al.A new indole derivative isolated from the root of Tuber Fleeceflower(Polygonum multiflorum)[J].Chin Tradit Herb Drugs,1998,29(1):5-11.
[12]王定勇,陈铭祥,冯玉静.一种分离大黄酚和大黄素甲醚的简便方法[J].广东药学院学报,2007,23(5):496-497.
[13]黎 艳,李 奕,刘虎威.中草药成分的毛细管电泳分析[J].现代仪器,2000(5):1-5.