双黄连口服液抗炎作用的代谢组学研究
2013-09-14邹忠杰龚梦鹃王淑美梁生旺
邹忠杰, 龚梦鹃, 王淑美, 梁生旺
(广东药学院中药学院,广东广州510006)
代谢组学 (Metabonomics)是近年来新兴的一种“组学”技术,其主要是定量测定生物系统因病理生理或基因改变等刺激所致的动态多参数代谢应答[1]。采用代谢组学方法一方面能够获取生物体在外界刺激影响下代谢状态整体性的改变,另一方面可以利用代谢标志物的变化推断特定病理生理状态下被调控的代谢途径。代谢组学研究的整体性与中药“多组分、多靶点”的作用模式相吻合,因此,代谢组学可能是科学阐释中药药效与作用机制的重要途径[2-3]。
角叉菜胶致大鼠足肿胀作为一种成熟的应用最广的非特异性炎症模型,已广泛应用于抗炎药物的筛选和药效学评价等领域,常用药效评价指标为大鼠足肿胀率等,但此指标灵敏度较低,而且主观因素影响较大[4]。双黄连口服液由金银花、黄芩和连翘组成,具有疏风解表、清热解毒的功效,临床上主要用于细菌和病毒引起的感冒、流感以及肺炎、气管炎、扁桃体炎等症[5]。双黄连口服液对角叉菜胶致大鼠足肿胀有明显的抑制作用[6],但其发挥抗炎作用的机制却不清楚。因此,本实验使用核磁共振 (NMR)方法建立大鼠血清及尿液的代谢指纹谱,探讨炎症引起的机体代谢状态的变化,进而鉴定与炎症相关的代谢标志物,并通过比较双黄连口服液干预下这些代谢物的变化情况,探讨双黄连口服液抗炎作用机制。
1 材料
1.1 实验动物 雄性SD大鼠 (SPF级),体质量160~180 g,购自广东省医学实验动物中心,合格证号SCXK(粤)2008-0002。
1.2 仪器与试剂 Bruker AVANCE III 500 MHz全数字化超导核磁共振谱仪 (BrukerBiospin,Rheinstetten,Germany);PV—200足趾容积测量仪 (成都泰盟科技有限公司);双黄连口服液 (哈药集团三精制药股份有限公司,批号11041004,10 mL/支);叠氮钠 (NaN3)、氘水 (D2O)、角叉菜胶购自美国Sigma公司。
2 方法
2.1 动物分组、给药及血清、尿液收集 将15只雄性SD大鼠置于12 h光照和12 h黑暗环境 (温度22℃,相对湿度50%)下自由饮食。饲养3 d后随机分为3组,分别为对照组、角叉菜胶炎症模型组和双黄连给药组。给药组大鼠按5 mL/kg(根据动物与人体间的等效剂量换算确定)灌胃给予双黄连口服液,每天1次,连续5 d,对照组和模型组给予等体积蒸馏水。末次给药30 min后,模型组和给药组大鼠用1.0%角叉菜胶100μL/只皮下注射于左后足跖部致炎,对照组皮下注射等体积生理盐水。随后,各组大鼠置于具有集尿器 (放于冰上)的代谢笼中收集12 h尿液,同时加入2%NaN3溶液0.5 mL做防腐剂,收集的尿液置于-20℃冰箱中保存备用。尿液收集完成后,于大鼠眼眶后静脉丛取血3 mL,经凝固 (4℃,60 min)后离心 (3 500 r/min,15 min,4℃)得到血清,置于-20℃冰箱中保存备用。同时,在造模前、造模后6 h和12 h测量肿胀足跖容积,计算各大鼠足跖肿胀度和肿胀抑制率。足跖肿胀度=[致炎后足跖容积 (mL)-致炎前足跖容积(mL)]/致炎前足跖容积 (mL);肿胀抑制率 =(模型组肿胀度-给药组肿胀度)/模型组肿胀度×100%。
2.2 血清和尿液样本预处理 参照课题组前期研究[7]报道的方法,血清:室温解冻后,于5 mm NMR测试管中加入400μL血清,然后加入50μL磷酸缓冲液 (0.2 mol/L Na2HPO4-0.2 mol/L NaH2PO4,pH7.4)和50μL D2O(用于锁场),振荡混匀,待测。尿液:室温解冻后,取200μL磷酸缓冲液 (0.2 mol/L Na2HPO4-0.2 mol/L NaH2PO4,pH7.4)加入到400μL尿液中,静置20 min后离心(3 500 r/min,10min,4℃),取500μL上清液加至5mm NMR测试管中,然后再加入50μLD2O(含有0.05%W/V TSP-d4),振荡混匀,待测。
2.3 血清和尿液代谢指纹谱的测试 实验温度为298 K;对于水峰采用有预饱和的1D NOESY脉冲序列进行抑制,对于血清中蛋白质及脂蛋白较宽的共振信号采用Carr-Purcell-Meibom-Gill[CPMG,relaxation delay-90°-(τ-180°-τ)n-acquisition]脉冲序列进行抑制;总的回波时间2nτ=100 ms;为使采样后的磁化矢量完全恢复到热平衡态,弛豫延迟时间为4 s;谱宽10 kHz;采样点数64 K;采集次数128次;傅立叶变换中线宽因子为0.3 Hz。在软件 MestReNova 6.1(Mestrelab Research S.L,Santiago de Compostela,Spain)中手动对所获谱图进行相位和基线校正,然后进行化学位移的定标,血清和尿液样品分别参照乳酸的甲基共振双重峰(δ 1.33)和 TSP(δ0.0)[7]。
2.4 数据分析 按δ0.02等间隔在δ0.5~9.5区域分段积分,将所得数据转换成ASCⅡ文件输出到Excel 2007(Microsoft Inc.,Bellevue,WA)中进行下一步处理[7]。对于血清和尿液样品,为了消除饱和水峰时引起的谱线差异及消除由于尿素与溶剂交换质子后发生的部分饱和转移所造成的尿素信号差异,分别将区域δ4.74~5.22和δ4.50~5.98设为0积分段。各分段积分值进行归一化处理后乘以10 000导入 SIMCA-P 12.0(Umetrics AB,Umea,Sweden),进行主成分分析 (PCA)及正交偏最小二乘判别分析 (OPLS-DA)前,数据要经过 Pareto标度化处理[7]。
3 结果
3.1 双黄连口服液对角叉菜胶致大鼠足肿胀的影响 见表1,大鼠连续给药5 d后,双黄连口服液对角叉菜胶所致大鼠足肿胀有较好的抑制作用,与模型组相比有显著性差异。

表1 双黄连口服液对角叉菜胶致大鼠足肿胀的影响Tab.1 Effect of Shuanghuanglian Oral Liquid on carrageenan-induced hind paw oedema in rats
3.2 血清和尿液的1H-NMR代谢物谱分析 如图1所示,血清和尿液中的代谢物主要是氨基酸类、有机酸类和酮体等物质,除此之外,血清中还含有大量的脂蛋白和脂类物质。
3.3 角叉菜胶致炎后大鼠机体代谢指纹谱的变化大鼠血清和尿液所含成分非常复杂,本实验使用多变量统计分析中的正交偏最小二乘判别分析(OPLS-DA)法对对照组和模型组大鼠的代谢指纹谱进行比较。如图2所示,两组大鼠的血清和尿液样本点在PC1维可以完全区分开,说明角叉菜胶致炎后大鼠机体生理及物质代谢状况已经发生了明显的改变。本实验采用7倍交叉验证法对OPLS-DA模型的可靠性进行了验证,主要参数如下,血清:R2X(cum)=0.82,R2Y(cum)=0.895,Q2(cum)=0.866;尿液:R2X(cum)=0.726,R2Y(cum)=0.874,Q2(cum)=0.831。从上述参数可以看出本研究建立的模型具有较高的可靠性。

图1 对照组大鼠血清 (A)和尿液 (B)1 H-NMR图Fig.1 Representative 1 H-NMR spectra of rat serum(A)and urine(B)samp les from the control group

图2 对照组 (●)和模型组 (▲)大鼠血清 (A)和尿液 (B)OPLS-DA得分图Fig.2 OPLS-DA score p lots derived from 1 H-NMR spectra of serum(A)and urine(B)sam ples in control group(●)and model group(▲)
3.4 与炎症相关的代谢标志物鉴定 首先选取OPLS-DA模型中变量重要性投影 (Variable importance in the projection,VIP)>1的差异变量,然后再利用t检验 (P<0.05)对筛选到的差异变量进行验证,最终在血清和尿液中分别筛选得到12种和10种与炎症相关的代谢标志物,结果见表2、表3。
3.5 双黄连口服液对角叉菜胶致大鼠足肿胀的干预作用 药理研究结果表明,双黄连口服液对角叉菜胶致大鼠足肿胀有明显抑制作用。从大鼠血清和尿液样本代谢指纹的主成分分析 (PCA)(见图3),给药组样本点与模型组样本点可以完全分离,且与对照组样本点接近。综合这两个方面的实验结果可以看出双黄连口服液有效地干预了炎症模型大鼠的生理及代谢状况。
4 讨论
血清和尿液中通常包含众多的代谢产物,NMR的技术优势在于可以对所有代谢产物同时测定,并且代谢产物的化学位移具有非常高的重现性。本实验中代谢物谱峰的归属主要是依据化学位移值、峰的裂分情况、耦合常数及参考文献报导[8-9],同时借助于软件 Chenomx NMR Suite 7.1(Chenomx,Inc.,Edmonton,Alberta,Canada)中代谢产物的自动解析功能。
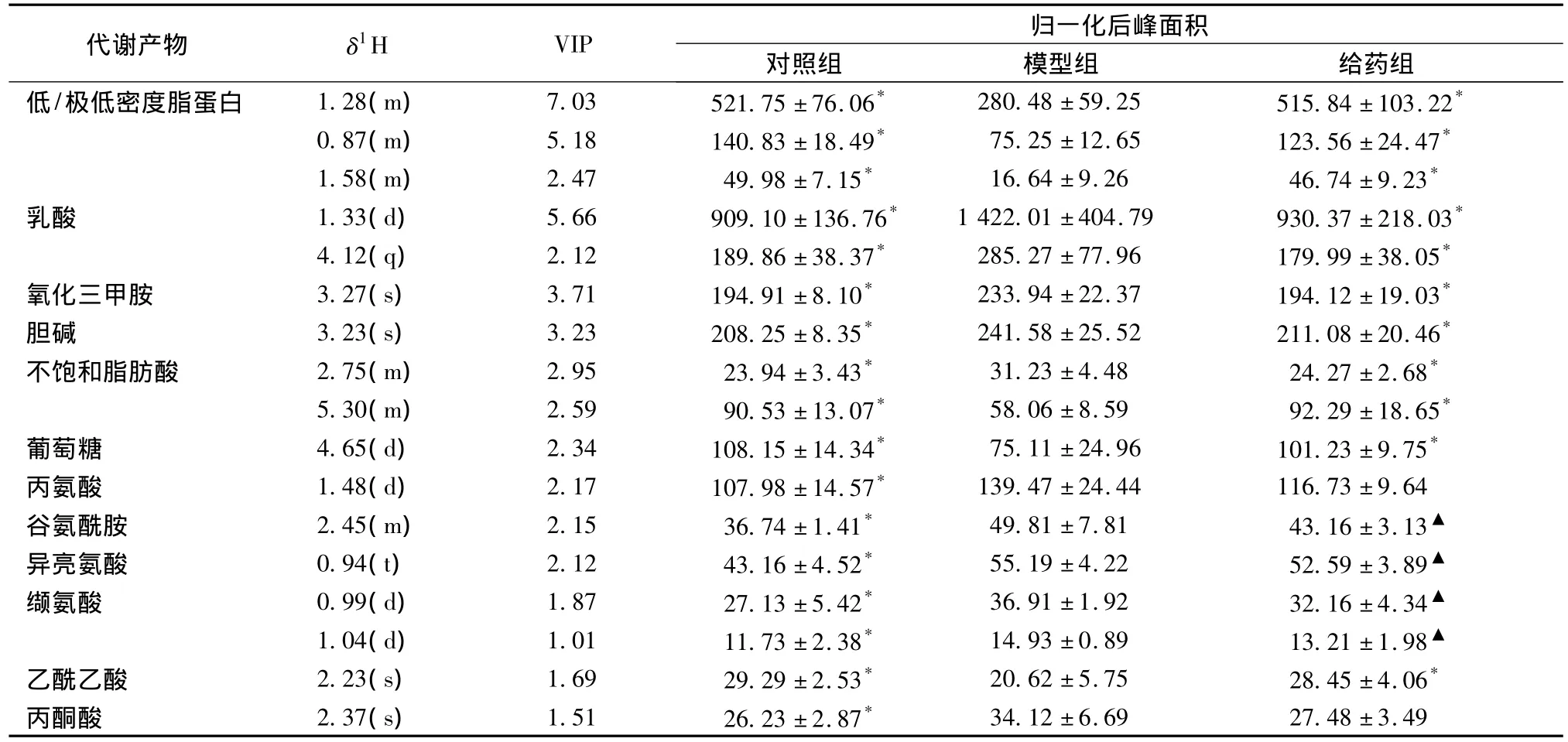
表2 与炎症相关的大鼠血清生物标志物Tab.2 Biomarkers associated w ith inflammation in rat serum

表3 与炎症相关的大鼠尿液生物标志物Tab.3 Biomarkers associated w ith inflammation in rat urine

图3 对照组 (●)、模型组 (▲)和给药组 (■)大鼠血清 (A)和尿液 (B)PCA得分图Fig.3 PCA score plots derived from 1 H-NMR spectra of serum(A)and urine(B)samples in control group(●),model group(▲)and Shuanghuanglian Oral Liquid treatment group(■)
从表2和表3可以看出,模型组血清中葡萄糖水平下降而丙酮酸和乳酸水平升高,同时,与三羧酸循环相关的代谢产物的量升高,如尿液中的柠檬酸、α-酮戊二酸和琥珀酸,这是机体糖代谢加速的表现,急性炎症期机体最明显的表现是红、肿、热、痛和功能障碍,其中涉及大量的炎症因子的释放,对能量的需求大大增加。给药组中双黄连口服液可以使血清中葡萄糖水平升高、乳酸水平下降,同时使尿液中柠檬酸、α-酮戊二酸和琥珀酸水平下降,这说明其有效地干预了机体的糖代谢失衡。机体对能量需求增加还表现在模型组血清中低/极低脂密度蛋白及脂肪酸水平下降,由于供能需求,脂肪的转运、分解和β-氧化作用等过程被加速。酮体是脂肪酸在肝脏中β-氧化后的中间代谢产物,是肝脏输出能源的一种形式,模型组血清和尿液中的乙酰乙酸及尿液中的3-羟基丁酸和丙酮水平下降可能是机体脂质代谢失调的一种表现。双黄连口服液对脂质代谢的作用表现在其对低/极低脂密度蛋白及酮体等的干预。磷脂是细胞膜和脂蛋白等的重要成分,炎症时,机体分泌大量的磷脂酶A2,磷脂的水解导致了模型组血清中胆碱和多不饱和脂肪酸如花生四烯酸的升高,花生四烯酸是前列腺素和白三烯等炎症因子的重要前体;同时,这也可能导致模型组血清中低/极低脂密度蛋白水平下降[10]。双黄连口服液可以使血清中胆碱和多不饱和脂肪酸的水平下降,说明其有可能抑制了磷脂酶A2的活性,这与已报道的研究相符[11]。马尿酸、氧化三甲胺和二甲胺均与肠道菌群的代谢有关,其水平的升高说明模型组肠道菌群受到一定同程度的影响[12]。双黄连口服液可以调节肠道菌群。炎症引起细胞损伤导致蛋白质分解加速,模型组血清中氨基酸升高[10]。双黄连口服液对炎症模型大鼠血清中升高的氨基酸水平不能进行有效的逆转,说明其不能阻止炎症部位蛋白质分解。
本实验采用基于NMR的代谢组学方法研究了角叉菜胶致炎后大鼠机体代谢表型的变化并鉴定了相关的代谢标志物,通过双黄连口服液对标志物的调控作用探讨了其抗炎机制。代谢组反映了各种生命活动的“终点”信息,可从整体性的角度体现机体的变化,与传统单一或孤立的药效评价方法相比,代谢组学方法对阐释具有“多成分、多靶点”作用特点的中药及复方的药效具有明显的优势。
[1]Nicholson JK,Lindon JC,Holmes E.“Metabonomics”:understanding themetabolic responses of living systems to pathophysiological stimuliviamultivariate statistical analysis of biological NMR spectroscopic data[J].Xenobiotica,1999,29(11):1181-1189.
[2]Wang X,Sun H,Zhang A,et al.Potential role ofmetabolomics apporoaches in the area of traditional Chinesemedicine:as pillars of the bridge between Chinese and Western medicine[J].JPharm Biomed Anal,2011,55(5):859-868.
[3]黎 莉,孙 鹏,梁琼麟,等.白香丹胶囊干预经前期综合征肝气逆证大鼠血清代谢组学研究[J].中成药,2011,33(5):762-767.
[4]徐叔云,卞如濂,陈 修.药理实验方法学[M].3版.北京:人民卫生出版社,2002,905.
[5]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:611-612.
[6]周兴东,刘晓放,朱 沂,等.双黄连口服液抗炎、解热作用研究[J].中成药,1990,12(9):45.
[7]邹忠杰,施旭光,龚梦鹃,等.利血平所致大鼠脾虚证代谢组学研究[J].中药新药与临床药理,2012,23(3):291-294.
[8]Lindon JC,Nicholson JK,Everett JR.NMR spectroscopy of biofluids[J].Annu Rep NMR Spectro,1999,38:1-88.
[9]Nicholson JK,Foxall P J,Spraul M,et al.750 MHz1H and1H-13C NMR spectroscopy of human blood plasma[J].Anal Chem,1995,67(5):793-811.
[10]Martin F P,Rezzi S,Philippe D,et al.Metabolic assessment of gradual development ofmoderate experimental colitis in IL-10 deficientmice[J].JProteome Res,2009,8(5):2376-2387.
[11]杨巧芳,孟庆刚.黄芩抗炎作用的药理研究述评[J].中华中医药学刊,2008,26(7):1443-1445.
[12]Wei L,Liao P,Wu H,etal.Metabolic profiling studies on the toxicological effects of realgar in rats by1H-NMR spectroscopy[J].Toxicol Appl Pharmacol,2009,234(3):314-325.