植物源农药大黄素甲醚的光解特性研究
2020-07-08魏京华袁善奎周艳明刘雁雨
魏京华,袁善奎,周艳明,刘雁雨
(农业农村部农药检定所,北京 100125)
大黄素甲醚(physcion)属蒽醌类化合物,是以大黄等天然植物为原料加工研制而成的。国内对大黄素甲醚提取工艺的研究已经比较成熟,目前高效、简便的大黄酚和大黄素甲醚分离方法已成熟,可使大黄素甲醚的纯度达到99%以上[1],而西安绿海生物科技有限公司发明的闪式提取大黄素和大黄素甲醚的方法更节省大量能源和时间[2]。因大黄素甲醚具有多种生理活性,其在医药和农药方面的用途颇广,如其对脑神经具有保护作用[3];对金黄色葡萄球菌、大肠杆菌、绿脓杆菌、链球菌和痢疾杆菌等26种人体病原细菌均具有抑制作用[4]。国内已有两家企业的6个大黄素甲醚相关产品在农药上取得登记,涉及葡萄、黄瓜、小麦等作物的白粉病和番茄病毒病等植物病害。
近年来,随着全社会对化学农药残留和环境安全性的日益关注,类似大黄素甲醚的植物源农药普遍受到欢迎。但植物源农药也是化学物质,并非绝对无害,安全性与其毒性和环境暴露浓度密切相关。而化学物质在环境中的降解主要包括生物降解和物理降解,其中光解又是最主要的物理降解途径。为了解大黄素甲醚的光解特性,笔者参考GB/T 31270.3—2014《化学农药环境安全评价试验准则》[5],在室内采用模拟自然光源对大黄素甲醚在水和土壤表面的光解行为进行了试验研究,旨在为大黄素甲醚的环境安全性评估提供参考。
1 材料和方法
1.1 仪器和试剂
XT5409光稳定性试验箱,杭州雪中炭恒温技术有限公司;离心机,德国希格玛公司;2695-2996高效液相色谱仪,美国沃特世公司;低温恒温培养箱,日本三阳公司;BP211D电子天平,德国赛多利斯公司。98%大黄素甲醚标准品,成都瑞芬思生物科技有限公司;甲醇、二氯甲烷(色谱纯),美国霍尼韦尔公司。
1.2 试验方法
1.2.1 标准溶液的配制及标准曲线绘制
称取98%大黄素甲醚标准品0.013 41 g(精确至0.00 01 g),少量多次用甲醇超声溶解,并定容至100 mL,得到131.42 mg/L大黄素甲醚标准储备液,冷藏备用。取储备液用甲醇逐级稀释,分别配成10.00、8.00、5.00、2.00、1.00、0.80、0.50、0.20、0.10 mg/L系列标准溶液。以质量浓度为横坐标,峰面积为纵坐标绘制标准曲线。
1.2.2 方法的准确度和精密度
在空白水样中添加大黄素甲醚,使其添加水平分别为0.25 mg/L和4.00 mg/L,每个添加水平重复5次;在空白土样中添加大黄素甲醚,使其添加水平分别为0.40 mg/kg和10.00 mg/kg。每个添加水平重复5次。
1.2.3 色谱条件
采用2695-2996高效液相色谱仪进行测定,仪器配置二极管阵列检测器(PDA),色谱柱为C18柱(4.6 mm×250 mm,5 μm);流动相为85%甲醇+15%磷酸水(磷酸体积分数为0.1%);流速为1.0 mL/min;柱温为室温;进样体积为10 μL;检测波长为222.9 nm。
1.2.4 样品前处理
水样品:量取5.0 mL供试水样,加入5.0 mL二氯甲烷,涡旋振荡2 min,静置分层后,取下层二氯甲烷相1.0 mL氮吹至干,加入1.0 mL甲醇,充分溶解后过0.22 μm有机滤膜,待测。土壤样品:称取4 g供试土壤,加入10.0 mL水和10.0 mL二氯甲烷,涡旋振荡2 min,室温下10 000 r/min离心10 min,取下层二氯甲烷相1.0 mL氮吹至干,加入1.0 mL甲醇,充分溶解后过0.22 μm有机滤膜,待测。
1.2.5 土壤表面光解试验
称取经风干后过0.25 mm筛的土壤4 g,加适量水,使其均匀展布于玻璃平皿上,室温下阴干,制成厚度为1~2 mm土壤薄层。将供试物试验溶液均匀滴加于各土壤薄层表面,使土壤中供试物浓度为4.00 mg/kg,盖上石英玻璃板,然后将其置于光化学反应装置中进行光解试验,光源采用人工光源氙灯(波长范围为290~800 nm),保证试样接受紫外强度90~110 μW/cm2(紫外强度测定波长为365 nm)照射,反应温度为23~27℃。试验过程中定期取样,测定土壤中供试物含量,同时设黑暗条件下的对照试验。整个光解试验期内隔离其他光源,以减少对试验结果的影响[5]。
1.2.6 水中光解试验
将3.00 mg/L供试物水溶液装满石英玻璃管,盖紧塞子,保持管外壁洁净,将光解反应管置于光化学反应装置中进行光解试验,光源采用人工光源氙灯(波长范围为290~800 nm),保证试样接受紫外强度90~110 μw/cm2(紫外强度测定波长为365 nm),反应温度为23~27℃。试验过程中定期取样,测定水中供试物含量变化,同时设黑暗条件下的对照试验。整个光解试验期内隔离其他光源,以减少对试验结果的影响[5]。
1.3 数据处理
农药在环境中降解规律一般遵循一级动力学方程,可按式(1)与式(2)计算光解半衰期(T0.5)[5]。

式中:k为光解速率常数;t为光解时间,d;C0、Ct分别为初始时刻和t时刻时大黄素甲醚的质量浓度或质量比,mg/L或mg/kg;T0.5为光解半衰期,d。
2 结果与分析
2.1 方法准确度和精密度
在空白样品中,添加大黄素甲醚标准溶液进行回收率试验,每个浓度设置5个重复,同时设置空白对照,按上述方法进行分析测定,并计算回收率,结果见表1。空白水样中添加质量浓度为0.25 mg/L和4.00 mg/L,回收率在82.6%~103.7%范围内,相对标准偏差为0.7%~8.5%;空白土壤样品中添加质量比为0.40 mg/kg和10.00 mg/kg,回收率在76.2%~90.0%,相对标准偏差为1.9%~6.6%。方法的回收率和精密度均满足农药残留分析的要求。大黄素甲醚色谱图见图1,由图1可见,在此检测条件下,目标物峰形好,响应高,保留时间约21 min,虽然土壤中杂质较多,但是检测时并没有出现干扰峰,说明水中和土壤中大黄素甲醚无论是前处理还是检测方法都能很好地满足试验的要求。
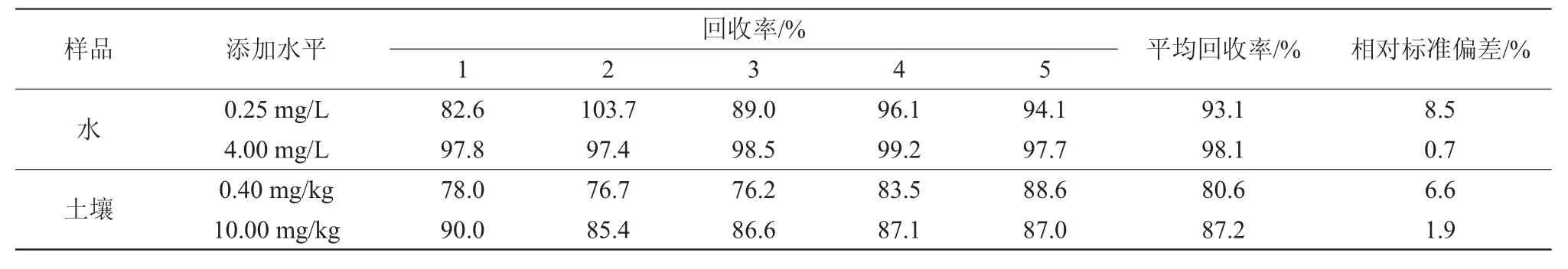
表1 大黄素甲醚添加回收率

图1 大黄素甲醚色谱图
2.2 水中光解特性
大黄素甲醚在水中降解情况满足一级动力学方程,拟合曲线见图2,其在光照条件下动态方程为Ct=2.509 8 e-0.1626t,R2=0.985 3,得到水中光解半衰期为4.26 d;而在黑暗条件下,其动态方程为Ct=2.640 0 e-0.0878t,R2=0.984 3,降解半衰期为7.89 d。无论是光照还是黑暗条件降解曲线拟合度都较高(R2=0.985 3,R2=0.984 3)。其水中光解试验测定结果见表2,分别于0、1、2、3、4、6、7、10、14 d取试验水样进行含量分析,大黄素甲醚在水中初始检出量为2.69 mg/L,4 d时降解率达到51.2%,14 d时降解率达到89.6%。当光照条件下降解率达到89.6%时,黑暗条件的降解率也达到了72.2%,说明在水中大黄素甲醚发生光解作用的同时,水解作用也加快了其降解速率。

图2 大黄素甲醚水中光解曲线
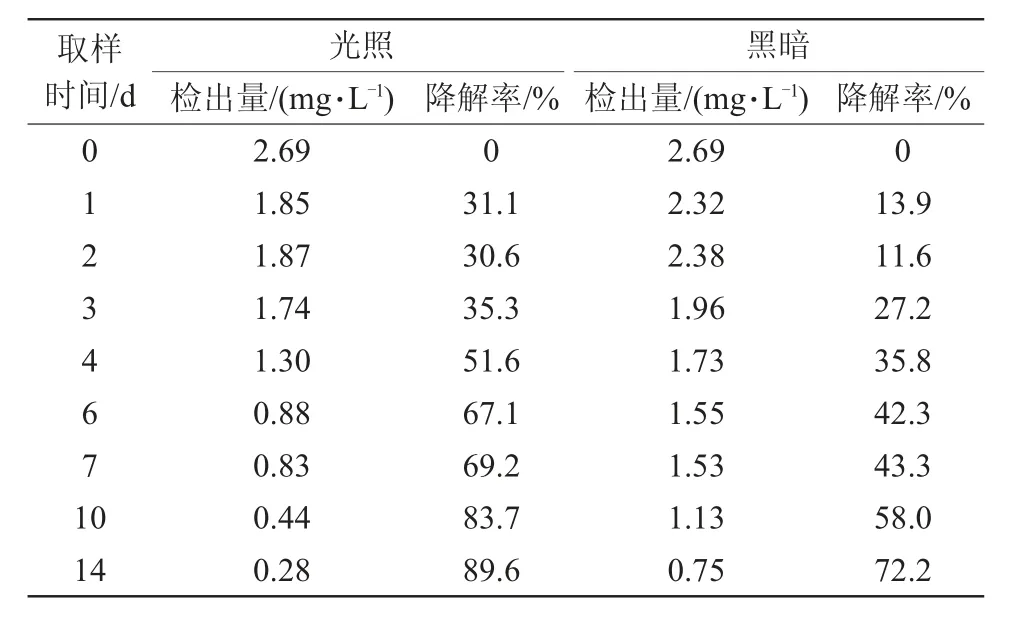
表2 大黄素甲醚在水中光解试验测定结果
2.3 土壤表面光解特性
分别于0、2、3、4、5、6、7、13、40、55 d取试验土壤进行定量分析,大黄素甲醚在土壤表面光解试验测定结果见表3。由表3可见,大黄素甲醚在光照条件下前5 d降解率就已达到43%,而在黑暗条件下,大黄素甲醚在前5 d降解并不明显,降解率仅为10%左右。因此可以看出,该时段大黄素甲醚对光照反应更强烈,光解在其降解过程中占的比重较大。而在5 d之后的检测结果中可以看出,黑暗条件下降解率逐渐升高,其升高速率明显高于光照条件下,原因可能是随着光解反应的进行土壤中存在的微生物活力增加或土壤pH等其他影响因素在大黄素甲醚的降解行为中占了主导地位。
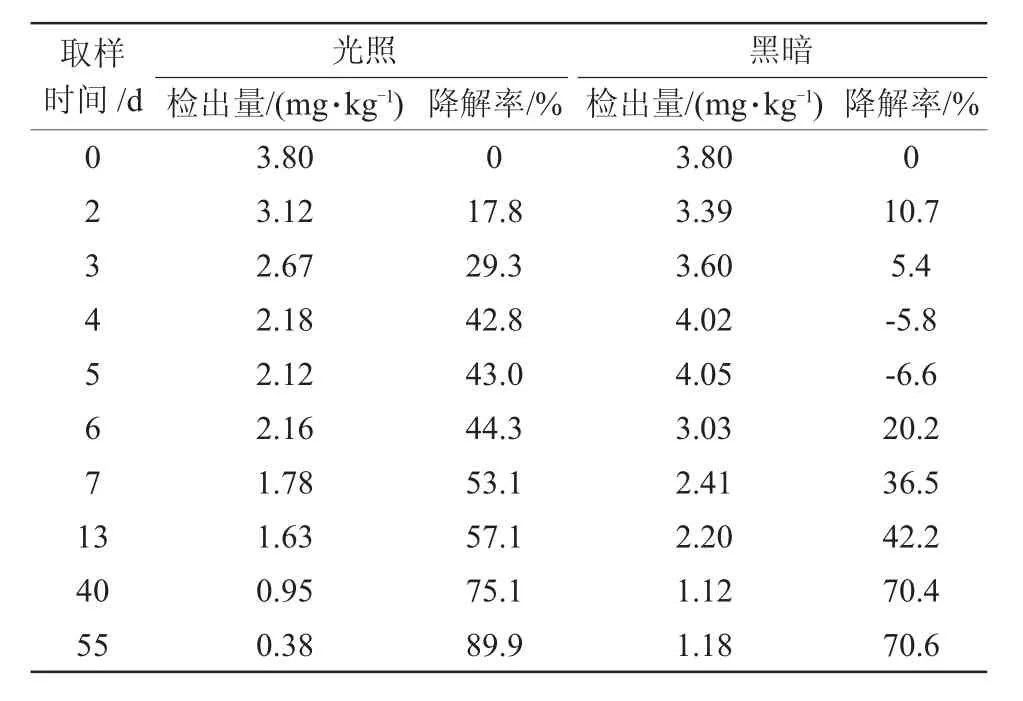
表3 大黄素甲醚在土壤表面光解试验测定结果
对不同条件下大黄素甲醚在土壤表面的降解数据进行拟合,拟合曲线见图3。由图3可知,人工光源氙灯及黑暗对照处理中,大黄素甲醚的降解均符合一级动力学方程,其光解动态方程为Ct=2.836 4 e-0.0341t,相关系数R2=0.923 7,由此得到土壤表面光照条件下降解半衰期为20.33 d。黑暗条件下,其动态方程为Ct=3.664 5 e-0.0249t,相关系数R2=0.882 4,得到黑暗条件下降解半衰期为27.84 d。
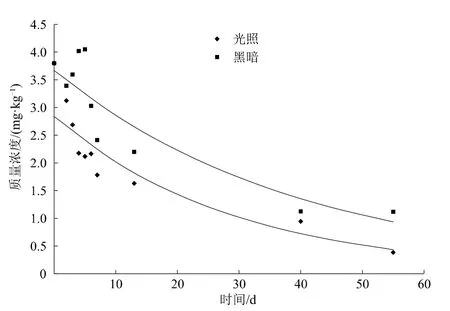
图3 大黄素甲醚土壤表面光解曲线
3 结 论
试验中大黄素甲醚在水中光解半衰期为4.26 d,在土壤表面光解半衰期为20.33 d,根据GB/T 31270.3—2014《化学农药环境安全评价试验准则》[5]中农药光解性评价标准,当光解半衰期不小于24 h时农药难光解,因此大黄素甲醚无论是在水中还是在土壤表面光解性等级均为难光解。
根据GB/T 31270.3—2014《化学农药环境安全评价试验准则》[5]规定,光解试验周期最长为7 d,而根据前7 d的检测结果得到大黄素甲醚在水中光解半衰期为4.22 d,与降解率达到90%时得到的光解半衰期4.26 d基本一致。而前7 d的检测结果得到大黄素甲醚在土壤表面光解半衰期6.58 d,与降解率达到90%时得到的光解半衰期20.33 d差距较大,这说明当化学农药降解较慢时,7 d的试验周期已经能判定农药的光解特性等级,但是如果想要得到较为准确的半衰期仍需延长试验时间,得到更充分的数据。
近年来农药残留量限量标准越来越严格,植物源农药的研发应用正好能有效地解决这一瓶颈,植物源农药的广泛应用是必然趋势,而对其环境安全性评价意义重大。目前大黄素甲醚在农药方面的研究较少,国内对其环境安全性研究报道并不全面,本文对大黄素甲醚的光解行为进行研究,为其环境安全评价提供科学依据。
