碱性成纤维细胞生长因子凝胶的无菌检查
2013-09-10丁有学史新昌饶春明中国食品药品检定研究院北京00050卫生部生物技术产品检定方法及其标准化重点实验室
丁有学,刘 兰,毕 华,史新昌,饶春明* (中国食品药品检定研究院,北京 00050; 卫生部生物技术产品检定方法及其标准化重点实验室)
碱性成纤维细胞生长因子 (bFGF)凝胶用于烧伤创面,体表慢性溃疡创面及外伤、手术伤等新鲜创面的愈合,因此bFGF凝胶须为无菌制剂。《中国药典》2010年版三部规定,凡要求无菌的生物制品均需进行无菌检查;当建立产品的无菌检查法时应进行方法学验证,以证明所采用的方法适合于该产品的无菌检查;若该产品的组分或检验条件发生改变时,检查方法应重新验证[1]。这与 《中国药典》2010年版二部、欧洲药典及美国药典的要求相同[2-4]。生物技术药物多为小容量注射剂产品且不允许添加抗菌素及防腐剂,无菌检查通常采用薄膜过滤法。bFGF凝胶中含有大量的赋形剂、保护剂、防腐剂等,不能通过0.45μm滤膜,因此选择直接接种法对其进行无菌检查并进行了方法学验证。
1 材料与方法
1.1 设备
生物安全柜,超净工作台,生化培养箱 (20~25℃、30~35℃),高压灭菌器。
1.2 培养基及试剂
硫乙醇酸盐流体培养基、改良马丁培养基、营养肉汤培养基、改良马丁琼脂培养基均由中国食品药品检定研究院培养基室提供;标准比浊管由中国食品药品检定研究结核病疫苗室提供;0.9%氯化钠注射液 (石家庄四药有限公司);灭菌0.05%聚山梨酯80的0.9%氯化钠溶液为本实验室自制。
1.3 菌种
金黄 色 葡 萄 球 菌 (Staphylococcusaureus)[CMCC (B)26003]、铜绿假单胞菌 (Pseudomonas aeruginosa) [CMCC (B)10104]、枯草芽孢杆菌(Bacillussubtilis) [CMCC (B)63501]、生孢梭菌(Clostridiumsporogenes) [CMCC (B)64941]、白色念珠菌 (Candidaalbicans) [CMCC (F)98001]、黑曲霉 (Aspergillusniger) [CMCC (F)98003],均来自中国食品药品检定研究院国家菌种保藏中心。
1.4 供试品
碱性成纤维细胞生长因子 (bFGF)凝胶(5g·支-1,批 号:20090901、20090902、20090903)由企业提供。
1.5 方法[1-2]
1.5.1 菌液的制备
分别接种金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌的新鲜培养物200μL置10mL营养肉汤培养基中,接种生孢梭菌的新鲜培养物200μL置10mL硫乙醇酸盐流体培养基中,30~35℃培养18~24h;接种白色念珠菌的新鲜培养物200μL置10mL改良马丁培养基中,20~25℃培养24~48h,上述培养物用0.9%氯化钠溶液配制成每1mL含菌数小于100cfu的菌悬液。接种黑曲霉的新鲜培养物200μL置改良马丁琼脂培养基上,23~28℃培养5~7d,加入3~5mL无菌的含0.05% (mL/mL)聚山梨酯80的0.9%氯化钠溶液,将孢子洗脱,然后,吸出孢子悬液置无菌试管内,用无菌的含0.05% (mL/mL)聚山梨酯80的0.9%氯化钠溶液配制成每1mL含孢子数小于100cfu的孢子悬液。细菌计数可采用比浊法[5-6],与标准比浊管对照,根据中国细菌浊度标准使用说明书参考菌数表将菌液稀释,同时进行平板计数。
1.5.2 方法学验证
取碱性成纤维细胞生长因子凝胶供试品 (批号:20090902)10支,全部加至100mL 0.9%无菌氯化钠注射液中,充分搅拌,使凝胶完全溶解于氯化钠溶液中,保证供试品的均一性,作为供试液。取200mL·瓶-1的硫乙醇酸盐流体培养基8瓶,分别接入小于100cfu的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、生孢梭菌各2瓶,取200mL·瓶-1改良马丁培养基4瓶,分别接入小于100cfu的白色念珠菌、黑曲霉各2瓶。将以上接入各种菌液的培养基中的1瓶接入供试液,每瓶10mL,作为供试品组;另1瓶不加供试液作为阳性对照组;同时另取硫乙醇酸盐流体培养基和改良马丁培养基各1瓶,作阴性对照,细菌置30~35℃培养3~5d,真菌置20~25℃培养3~5d,逐日观察各瓶内试验菌的生长情况。
1.5.3 无菌检查
3批供试液的配制同方法学验证。每批供试品取硫乙醇酸盐流体培养基8瓶、改良马丁培养基4瓶,各200mL·瓶-1(2种培养基接种瓶数比例为2∶1),每瓶接种供试液10mL;另取硫乙醇酸盐流体培养基2瓶、改良马丁培养基1瓶,接入0.9%无菌氯化钠注射液10mL,作为阴性对照;将以上硫乙醇酸盐流体培养基平均分成2份,其中1份置30~35℃培养,另1份和改良马丁培养基共同置20~25℃培养14d,培养期间逐日观察并记录是否有菌生长。
1.5.4 阳性对照
无菌检查的同时做阳性对照。取硫乙醇酸盐流体培养基1瓶,接入供试液10mL,接入小于100cfu的金黄色葡萄球菌1mL,置30~35℃培养48~72h。
2 结果
2.1 菌液制备结果
各菌液经相应条件培养后,细菌生长状态良好,计数结果见表1。

表1 细菌计数结果
2.2 方法学验证结果
方法学验证的各试验瓶经相应培养条件培养后结果见表2。从表2可以看出,各供试品组与阳性对照组细菌生长速度一致,金黄色葡萄球菌等4菌株组均在24h即可观察到细菌生长,白色念珠菌和黑曲霉两组细菌生长较慢,各培养瓶均
在第2d可以观察到细菌生长,说明该条件下供试品无抑菌作用或抑菌成分可忽略不计,可用于碱性成纤维细胞生长因子 (bFGF)凝胶的无菌检查。
2.3 无菌检查结果
无菌检查试验经14d培养后,阴性对照组与3批供试品均无菌生长,阳性对照经3d培养细菌生长良好。
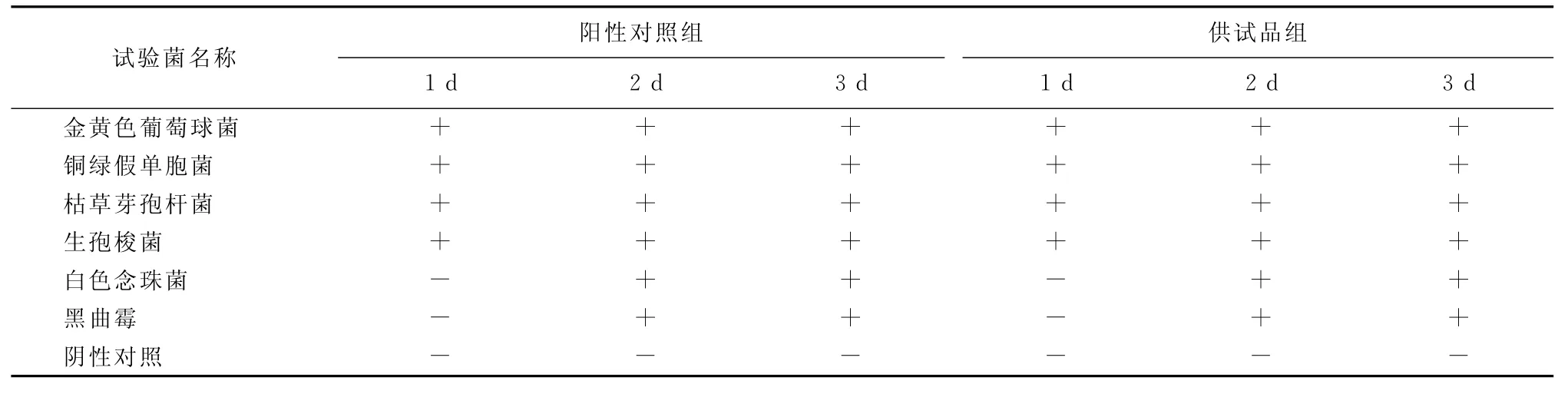
表2 方法学验证结果
3 讨论
《中国药典》2005年版三部无菌检查法项下没有关于方法学验证的要求,因此很多生产和检验机构均未进行生物制品无菌检查的方法学验证,《中国药典》2010年版三部增加了这部分内容。新版药典的实施给实验人员在实验操作上带来了一些困难,本实验室在几年前开展了这方面的研究工作,现将一些体会总结如下,希望能为同行提供参考。
(1)在菌液制备过程中,细菌的生长速度与接种活菌数量有很大关系。因此,应注意观察各菌生长状态,在实验人员经验不足的情况下,细菌计数应采用平板计数法,以保证菌液浓度在10~100cfu·mL-1之间[5-6],建议最好控制在50cfu·mL-1左右[7]。适宜的菌液浓度是方法学验证的关键,细菌的生长速度过快或过慢,均不利于观察供试品的抑菌情况,有可能出现假阴性结果。
(2)菌液的制备、验证试验和阳性对照试验应在有独立排风的阳性实验室进行,而不能在供试品的无菌检查实验室进行,以避免污染无菌操作环境。试验后废弃的阳性菌应尽可能原位灭菌。试验菌株传代不能超过5代 (从菌种保藏中心获得的冻干菌种为0代),以保证其生物学特性。
(3)在建立生物制品的无菌检查方法时,应优先采用薄膜过滤法。因为薄膜过滤法通过冲洗可以最大限度地降低抑菌成分的作用,比其他方法更加灵敏[8]。当薄膜过滤法无法操作时再考虑采用直接接种法。直接接种法的最大缺点是所有成分都在培养基中一起培养,供试品浓度高时会影响培养基的澄清度,无法观察结果[9];增加稀释度又会造成供试品体积过大。为了保证接种量必须加大培养基用量,造成不必要的麻烦和浪费,掌握好适当的稀释度是无菌检查试验有效性的必要保障。
(4)在方法学验证的过程中,应每天密切观察各试验管细菌生长情况。如果供试品组与试验菌组细菌生长速度不一致,考虑可能是供试品中的抑菌因素没有被完全消除。此时应增加稀释倍数,直至两组试验管细菌生长速度相同。应特别强调的是,在无菌检查试验时,供试品的稀释方法必须与验证的方法保持一致。
[1]中国药典 [S].三部,2010:附录Ⅻ.
[2]中国药典 [S].二部,2010:附录Ⅺ H.
[3]EP7.0 [S].02methods of analysis:140 2.6.1,Sterility 153-155.
[4]USP30-NF25 [S].General Test and Assays:Microbiologica Test:71SterilityTests.
[5]中国药品生物制品检定所.中国药品检验标准操作规范[M].北京:中国医药科技出版社,2005:313-323.
[6]纪绍梅,严德喜.微生物培养基质控与图解 [M].北京:北京科学技术出版社,2006.
[7]江志杰,刘文杰,高春,等.左氧氟沙星注射液无菌检查方法验证 [J].中国药品标准,2008,9 (4):245-247.
[8]吴菊华,张树梅.直接接种法与薄膜过滤法在小容量注射剂无菌检查中的应用比较 [J].中国交通医学杂志,2005,19(2):152-153.
[9]丁有学,毕华,刘兰.细胞因子的无菌检查法 [J].中国药事,2010,24 (6):600-601.
