发光二极管光动力学疗法对裸鼠肺移植瘤的抑制作用研究
2013-09-10邵红霞杜钟珍
邵红霞,杜钟珍,李 莉,吴 琦
肺癌是当今世界各国最常见的恶性肿瘤之一,80%的肺癌患者在诊断后1年内死亡,5年生存率为14%[1]。尽管近年来医务工作者在肺癌的预防、早期诊断、早期治疗、新化疗药物的发明及放、化疗与手术相结合的综合治疗等手段上做了很大的努力,但目前肺癌的总体预后效果仍不理想。肺癌发病率和病死率居高不下,迫切期望人们突破传统思维,寻求新的治疗方法。光动力学疗法 (photodynamic therapy,PDT)是利用光敏剂和光产生的光动力学反应治疗肿瘤的一种非手术治疗方法,此方法通过全身或局部应用光敏剂后选择性地吸收潴留于肿瘤组织内,经特定波长激光照射,产生光化学作用而杀伤肿瘤细胞。本研究旨在探讨发光二极管 (light-emitting diode,LED)作为PDT光源对裸鼠肺移植瘤的抑制作用。
1 材料与方法
1.1 材料
1.1.1 细胞株 人肺腺癌细胞株A549购自中国医学科学院基础医学研究所。
1.1.2 动物 BALB/C nu/nu裸鼠15只,雄性,4~6周龄,购自中国医学科学院实验动物中心。
1.1.3 光敏剂与主要试剂 血卟啉衍生物类光敏剂photosan-3,细胞培养基,液态灭菌F12,Hyclone Inc;胎牛血清,胰蛋白酶,四甲偶氮唑盐,二甲基亚砜,250 ml细胞培养瓶,100 ml细胞培养瓶,微孔滤膜。
1.1.4 主要设备 LED激光器;光功率计:PM50,Thorlab,New Jersey;二氧化碳培养箱:D6450,德国Heraeus;倒置显微镜:德国Leica;微量加样器:德国Eppendof;高速台式离心机:江苏海门其林贝尔;2010MC型酶标仪;涡旋振荡器:日本东芝 SCR20BA;-20℃低温冰箱 (BD-93):海尔;-80℃超低温冰箱:美国Thermo Forma;防护眼镜:Thorlab。
1.2 方法
1.2.1 细胞培养方法 F12培养基,10%小牛血清,含100 U/ml青霉素及100 μg/ml链霉素双抗,置于37℃、5%CO2的培养箱中,常规细胞培养、传代。细胞培养相关技术方法参照参考文献 [2]介绍的方法进行。
1.2.2 动物移植瘤模型的建立 取对数生长期细胞,经胰酶消化后,加含血清的培养基,转移至离心管内,1000 r/min离心10 min,取出后弃去上清液,加入培养基2 ml,吸管吹匀,取100 μl计数,调整细胞密度至1×105/ml,按每只小鼠0.2 ml注入右腋下皮下,每日开始用游标卡尺测量,粗略估计肿瘤长径 (a)与短径 (b),肿瘤体积 (V)=a×b2×0.5。待肿瘤体积长至50 mm3左右备用。
1.2.3 实验分组 将15只4~6周龄BALB/C nu/nu雄性裸鼠随机分为荷瘤对照组、单纯激光照射组和LED-PDT治疗组,各5只。
1.2.4 光敏剂配置 于实验前避光条件下在电子天平上称少许颗粒状photosan-3,使用PBS液 (pH 7.4)溶液配制成较高浓度工作液,过滤除菌后密封,黑纸包裹4℃避光保存使用,使用时用PBS液梯度稀释成实验所需各种不同浓度。每次实验均临时配制新鲜的光敏剂溶液。
1.2.5 避光方法 配置与加入光敏剂、照射时均需严格避光处理,光敏剂存放、配液均使用专用避光锡箔纸包裹;裸鼠在注射光敏剂药物后要用黑布遮盖鼠笼避光,照光时将鼠笼拿入暗室对裸鼠进行PDT,治疗后仍要用黑布遮盖鼠笼。
1.2.6 激光器光源的准备 将光功率计表头平放在实验台上,每次照射前调整光斑大小超过肿瘤直径,使用光功率计进行光分布测量。
1.2.7 照射过程 荷瘤对照组不予任何治疗;单纯激光照射组不予光敏剂,用LED激光器将功率调至80 mW,照射肿瘤组织局部21 min,使能量密度达到约100 J/cm2;LED-PDT治疗组按照20 mg/kg剂量腹腔内注射photosan-3,避光5 h后,将LED激光器功率调至80 mW,在能量密度100 J/cm2条件下进行肿瘤局部PDT。PDT后裸鼠仍避光7 d。
1.2.8 治疗后处理 观察肿瘤组织表面情况,7 d后,颈椎脱臼法处死小鼠,取出肿瘤组织,甲醛溶液中固定,固定后进行HE染色,观察组织坏死情况。测量治疗前后裸鼠肿瘤体积。
1.3 统计学方法 采用SPSS 17.0统计软件进行数据分析,计量资料以 ()表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
治疗前3组肿瘤体积比较,差异无统计学意义 (P>0.05)。治疗7 d后,3组肿瘤体积比较,差异有统计学意义(P>0.05);其中荷瘤对照组和单纯激光照射组肿瘤体积均大于LED-PDT治疗组,差异有统计学意义 (P<0.05,见表1)。治疗后,荷瘤对照组、单纯激光照射组肿瘤表面无明显变化,病理显示肿瘤组织无坏死 (见图1);LED-PDT组见肿瘤表面坏死、结痂,镜下见细胞坏死、崩解、细胞轮廓模糊(见图2)。
表1 3组治疗前后肿瘤体积比较(,mm3)Table 1 Comparison of tumor volume among 3 groups before and after treatment
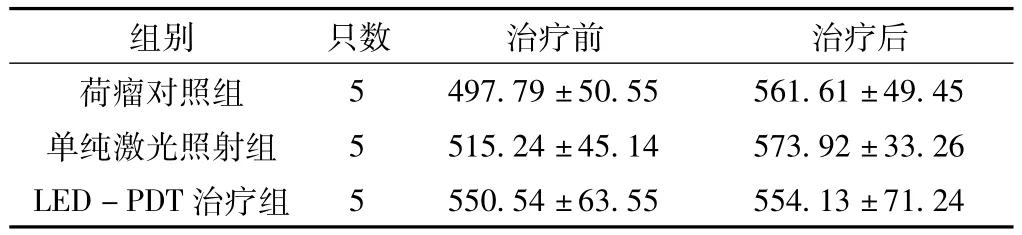
表1 3组治疗前后肿瘤体积比较(,mm3)Table 1 Comparison of tumor volume among 3 groups before and after treatment
5 497.79±50.55 561.61±49.45单纯激光照射组 5 515.24±45.14 573.92±33.26 LED-PDT治疗组组别 只数 治疗前 治疗后荷瘤对照组5 550.54±63.55 554.13±71.24
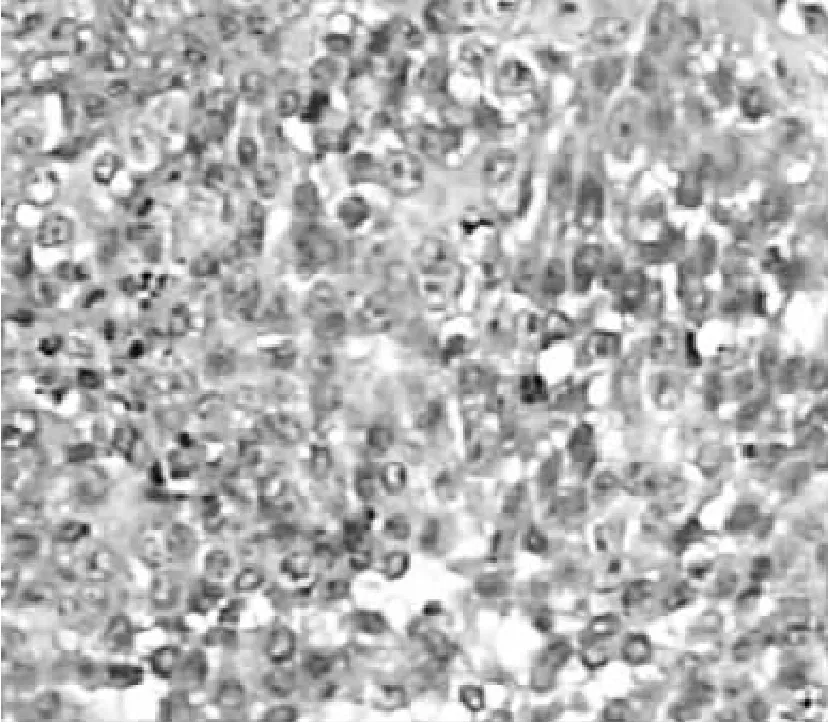
图1 正常肿瘤组织,无细胞结构破坏,凋亡 (HE染色,×10)Figure 1 Normal tumor tissue,without cell structural damage,apoptosis
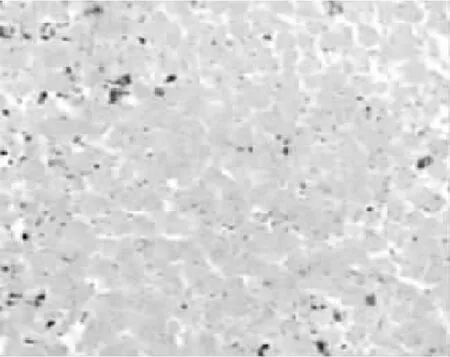
图2 坏死肿瘤组织,细胞已溶解破坏,不能见到完整肿瘤细胞 (HE染色,×40)Figure 2 Necrotic tumor tissue,cells lysised,without intact tumor cells
3 讨论
肺癌是当今世界对人类健康及生命危害最大的恶性肿瘤之一,目前手术、放化疗仍是治疗肺癌的首选方法。但是对于一部分心、肺功能较差或伴有其他系统疾病,不宜手术的早期肺癌患者,这些方法创伤或毒副作用较大,常难以接受;而对于晚期出现呼吸道堵塞症状的患者,上述方法不能多次应用且无法有效控制堵塞症状,严重影响晚期肺癌患者的生活质量[3-4]。PDT是随着光纤技术、激光医学和内镜技术发展而兴起的一种治疗恶性肿瘤的新方法[5],已在实体肿瘤的临床治疗中被广泛应用。PDT通过光敏剂在恶性肿瘤组织与正常组织形成一定的浓度差时,给予肿瘤组织照射特定波长的光,光敏剂吸收光子的能量后,产生一系列氧化活性分子。这些氧化活性分子通过氧化作用攻击肿瘤细胞使其死亡,达到治疗目的。
目前认为,PDT除了直接细胞杀伤机制,还可以通过以下两种机制抗肿瘤生长[6]:(1)脉管损伤机制:使肿瘤血管阻塞;(2)免疫应答机制:使肿瘤组织内淋巴细胞、白细胞、巨核细胞大量聚集。PDT已较多应用于皮肤等浅表肿瘤,主要是因其便于照射治疗的特点,近几年发现PDT应用于上消化道肿瘤亦可以达到治疗效果[7-8]。并已有报道称光动力对上消化道肿瘤可以达到治愈效果[9],这为腔内肿瘤的早期无痛苦治愈及晚期姑息治疗提供了新的方法。
本实验采用荷瘤裸鼠活体实验来观察LED-PDT治疗肺癌的疗效,光敏剂照射组可见肿瘤组织表面变红,治疗后连续观察可见肿瘤表面出现坏死,观察7 d发现肿瘤生长速度与其他两组相比明显减慢,1周后肿瘤部位出现干燥、结痂、组织坏死。处死小鼠后,镜下见细胞坏死、崩解、细胞轮廓模糊,而荷瘤对照组及单纯照射组均无此变化。本实验通过荷瘤裸鼠活体实验说明,PDT对肺癌细胞有直接杀伤作用,为光动力学在肺癌的临床治疗中的应用奠定了实验基础。
PDT与目前常用的外科手术、化疗和放疗相比,最大的优点在于可选择性杀伤肿瘤细胞,对正常细胞损害小,并可与其他疗法联合使用,具有良好的临床应用前景。在PDT治疗过程中,激光光源良好的可控性更加强了PDT的选择性,对肿瘤组织杀伤效应强,对正常组织损伤小,同时穿透深度有限。本实验所用激光器以红光LED作为激光光源,因为其具有体积小、使用方便、使用寿命长、功率输出稳定等优点。虽然作为照明设备,LED成本高于白炽灯,但是作为PDT光源,与其他激光器相比,LED材料具有较易获得、坚固耐用、寿命长的特点,可以大大降低治疗成本[2]。LED光源最大优势在于输出功率小,功率稳定,为得到与大激光器相同的能量密度,LED需要更长照射时间,而此过程LED可以保证较稳定的功率输出。另外LED相对大激光器价格便宜,更适于推广应用[10]。可见,LED作为PDT光源具有更大的优势,更具发展前景。
1 陈首英,刘福林,庞志刚,等.肺癌病人5年生存率及生存因素分析 [J].预防医学信息,2004,10(1):1-3.
2 Peloi LS,Soares RR,Biondo CE,et al.Photodynamic effect of light-emitting diode light on cell growth inhibition induced by methylene blue [J].Boisci,2008,33(2):231 -237.
3 Cheung R,Solonenko M,Busch TM,et al.Correlation of in vivo photosensitizer fluorescence and photodynamic-therapy-induced depth of necrosis in a murine tumor model[J].Journal of Biomedical Optics,2003,8(2):248-252.
4 雷亚春,张勇,刘滇生,等.卟啉及其配合物在分析化学中应用进展 [J].光谱实验室,2003,20(4):479-485.
5 Allison RR,Bagnato VS,Sibata CH.Future of oncologic photodynamic therapy [J].Future Oncol,2010,6(6):929 -940.
6 Robertson CA,Evans DH,Abrahamse H.Photodynamic therapy(PDT):a short review on cellular mechanisms and cancer research applications for PDT [J].J Photochem Photobiol B,2009,96(1):1-8.
7 林佳钿,陈俊辉.光动力疗法在食管癌治疗中的应用 [J].中国肿瘤临床与康复,2012,19(1):94-96.
8 章忠强,姚宏亮,文宇,等,光动力技术治疗胃癌的进展与展望[J].激光生物学报,2012,21(4):289-293.
9 刘慧龙,李慧丽,贾晓燕,等.光动力疗法治愈上消化道癌5例的临床分析[J].中国激光学杂志,2013,22(2):93-96.
10 Attar N,Korkmaz Y.Effect of two light-emitting diode(LED)and one halogen curing light on the microleakage of class V flowable compositerestorations [J]. J Contemp Dent Pract,2007,8(2):80-88.
