大鼠心室肌细胞单通道钙电流的记录及其电生理学特性分析
2013-09-07刘书源刘雅茹高青华赵美眯赵金生孙雪菲郝丽英
刘书源,刘雅茹,高青华,赵美眯,赵金生,孙雪菲,郝丽英
(中国医科大学1.药学院药物毒理教研室;2.生物制药研究室,沈阳 110001)
L-型钙通道普遍存在于机体的各种组织和细胞中,尤其是骨骼肌和心肌[1,2],L-型钙通道在生理功能的调节方面起到了重要作用,钙离子通过L-型钙通道进入细胞后[3],可引起肌细胞兴奋和收缩[4],调控腺体分泌激素和调节基因的表达[5]。因此对L-型钙通道的研究一直是多个学科领域的研究热点。膜片钳技术是研究离子通道的主要技术,共有4种基本记录模式。由于L-型钙通道电导小,大多实验室都采用全细胞记录模式研究整个细胞中L-型钙通道的作用,但是单通道记录模式可以使我们了解到L-型钙通道的门控机制、通道性质与结构关系、细胞内通道信号的转导过程等,其中细胞贴附式记录模式可用于检测离子通道的特性,内膜外记录模式可以便于更换细胞内液,适于研究离子通道的细胞内成分的效应[6]。所以确立稳定的心室肌细胞的膜片钳单通道的记录模式尤为重要。本研究在以往研究的基础上,对记录单通道钙电流的实验方法进行改进,记录到大鼠心室肌细胞膜上的单通道钙电流,并分析L-型钙通道的基本特性,为研究离子通道的细胞内成分效应奠定基础。
1 材料与方法
1.1 实验动物
Wistar大鼠(250~350 g),雌雄不限,由中国医科大学实验动物中心提供。
1.2 溶液与药品
无钙台氏液(mmol/L):NaCl 135,KCl 5.4,MgCl21.0,NaH2PO40.33,Glucose 5,CaCl21.8,和 Hepes 10(pH 7.4);保存液(KB 液)(mmol/L):KOH 70,Glutamic acid 50,KCl 40,KH2PO420,Taurine 20,MgCl23,Glucose 10,EGTA 0.5,Hepes 10(pH 7.4);电极内液 (mmol/L):BaCl250,TEACl 70,EGTA 0.5,Bay K8644 0.03和 Hepes 10(pH 7.4);IO 液(mmol/L):Aspartic acid 130,KOH 100,KCl 30,MgCl20.5,EGTA 1,CaCl20.5,HEPES 10(pH 7.4)。NaCl,KCl,MgCl2,NaH2PO4,NaOH,KOH,KH2PO4,Glucose 和 Taurine均为国产市售分析纯试剂;Aspartic acid,Glutamic acid和HEPES购自Amresco公司;EGTA购自日本DOJINDO公司;Protease和Bay K8644购自Sigma公司;胶原酶I型购自Worthington biochemical corporation。
1.3 单个大鼠心室肌细胞的制备
采用酶机械法分离心室肌细胞[7],戊巴比妥钠100 mg/kg腹腔注射麻醉,在人工呼吸机的支持下进行主动脉逆行插管。游离出心脏后置于Langendorff灌流装置,进行主动脉灌流。先用台氏液灌流约3 min,继以无钙台氏液灌流约6 min,然后用含胶原酶[浓度为(0.22~0.24 mg/mL)]的无钙台氏液消化 20~30 min,最后用KB液冲洗残酶约5 min。整个灌流系统所用液体均用恒温水浴保持在37℃,所有液体均用纯氧饱和。灌流结束后,取下左心室,放入室温的KB液中机械分离细胞,得到单个细胞悬液。将得到的细胞悬液经钢丝膜滤过后,置于含蛋白酶的KB液中,37℃水浴均匀震荡4 min。离心3次(1 000 r/min,3 min),弃去上清后,将细胞置于4℃冰箱稳定1 h后进行实验。
1.4 单通道膜片钳技术记录L-型钙通道电流
应用膜片钳放大器利用细胞贴附式和内膜向外式膜片钳技术进行单通道电流记录。两步拉制法拉制电极,电极尖端表面涂以硅酮树脂,然后烘干。电极内液中加入 50 mmol/L Ba2+和 30 μmol/L Bay K8644,Bay K8644为L-型钙通道的激动剂,它能够延长钙通道的开放时间,不影响电流的大小[8]。灌流液为IO液。利用Ba2+负载记录细胞膜上L-型钙通道电流,通过钙通道的钡电流由从-70 mV至0 mV的去极化脉冲引出,波宽200 ms,刺激频率0.5 Hz,由Axopatch 200B膜片钳放大器(美国Axon公司)放大,通过Digidata 1440数模/模数转换器(美国Axon公司),由计算机pClamp10软件采集,采样速率为3.3 Hz。并用pClamp10分析软件进行分析。
2 结果
2.1 大鼠心室肌细胞的制备
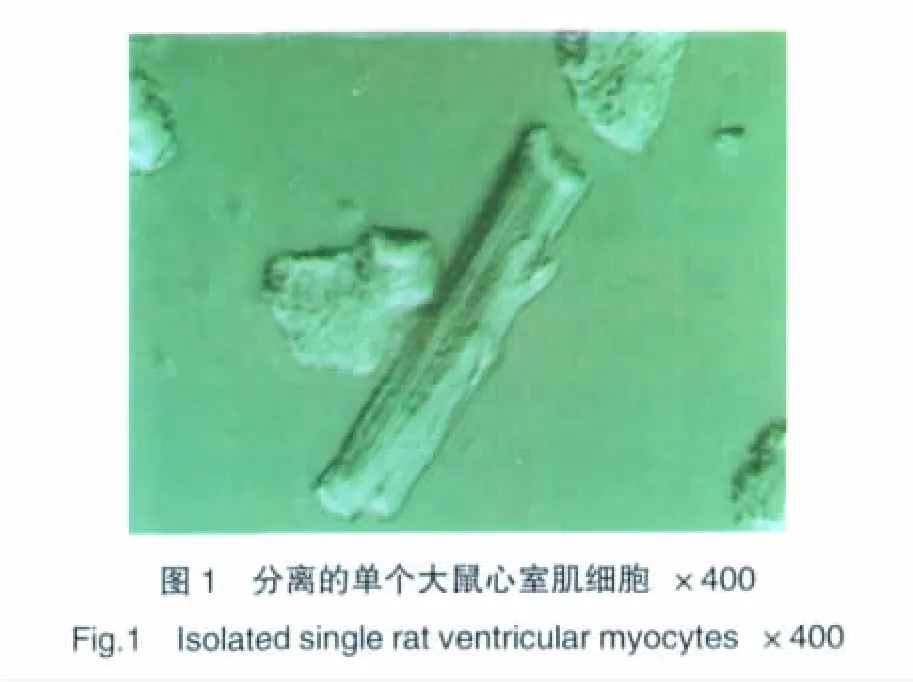
本实验得到单个心室肌细胞存活率达40%~50%,×400镜下可见活细胞形态良好,呈杆状或柱状,具有清晰的横纹(图1)。
2.2 单通道膜片钳技术记录L-型钙通道电流及其数据分析
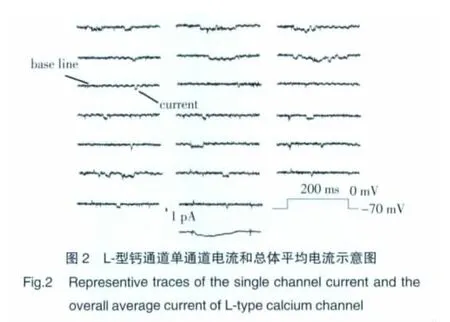
2.2.1 记录L-型钙通道的单通道电流:形成细胞贴附式记录模式后,在电压钳状态下,膜电位由保持电位-70 mV去极化至0 mV,刺激时间200 ms,记录到L-型钙通道的单通道电流图(图2),最下面一条曲线为上面20条曲线的平均值。
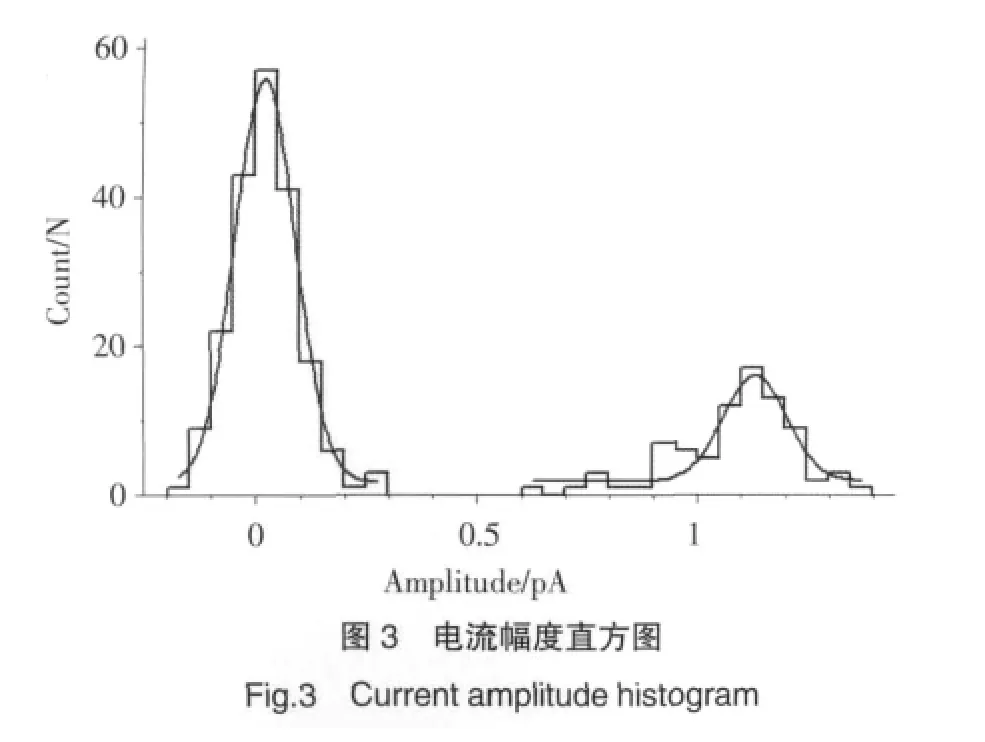
2.2.2 L-型钙通道单通道电流幅度分析:记录到L-型钙通道单通道电流后,用Clampfit分析软件作出电流幅度直方图,采用高斯方程进行拟合后,其峰值就是单通道开放的平均电流幅度。图3为实验中一实例,通过拟合后得到电流的平均幅度为1.13 pA。
2.2.3 L-型钙通道的开关动力学分析:记录到L-型钙通道单通道电流后,用Clampfit分析软件作出通道开关时间的事件频数直方图,然后选择指数方程对其拟合,求出通道开放和关闭时间分布的时间常数τ值。Bay K8644为L-型钙通道激动剂,它能够延长钙通道的开放时间,但不影响电流的大小,所以本实验分别计算电极内液中加入 30 μmol/L Bay K8644和未加入Bay K8644时通道开放和关闭时间分布的时间常数τ值。电极内液中加入30 μmol/L Bay K8644时,通道开放时间的τo为14.8 ms(图4 A),关闭时间的 τc为 20.04 ms(图 4 C);电极内液中未加入30 μmol/L Bay K8644时,通道开放时间的τo为1.35 ms(图4 B),通道关闭时间τc为46.75 ms(图4 D)。

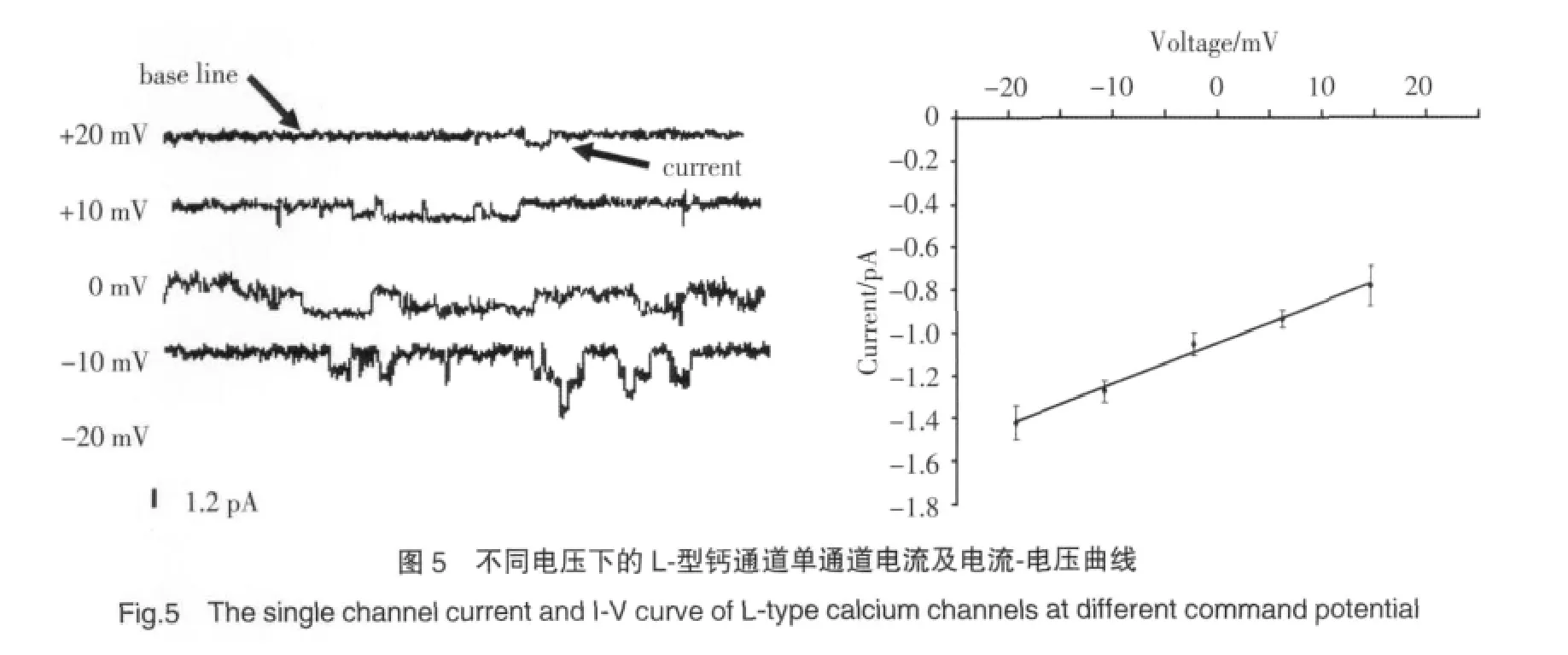
2.2.4 L-型钙通道的电导:在电压钳状态下,以10 mV步阶电压使心肌细胞膜的膜电位由-20 mV逐步去极化到+20 mV,刺激电压持续200 ms,保持电位-70 mV,记录到-20 mV,-10 mV,0 mV,10 mV,20 mV膜电位下的一系列电流(图5 A)。对不同膜电位下记录到的电流进行电流幅度直方图拟合,求出各个电压下的平均电流幅度值,膜电位为-20 mV(8例)的平均电流幅度为(-1.59±0.01)pA,膜电位为-10 mV(9例)的平均电流幅度为(-1.42±0.06)pA,膜电位为0 mV(13例)的平均电流幅度为(-1.16±0.06)pA,膜电位为 10 mV(12例)的平均电流幅度为(-1.02±0.05)pA,膜电位为 20 mV(6例)的平均电流幅度为(-0.84±0.11)pA,最后作出I-V曲线(图5 B),进而求得斜率电导,本实验条件下求出的斜率电导为19 pS。
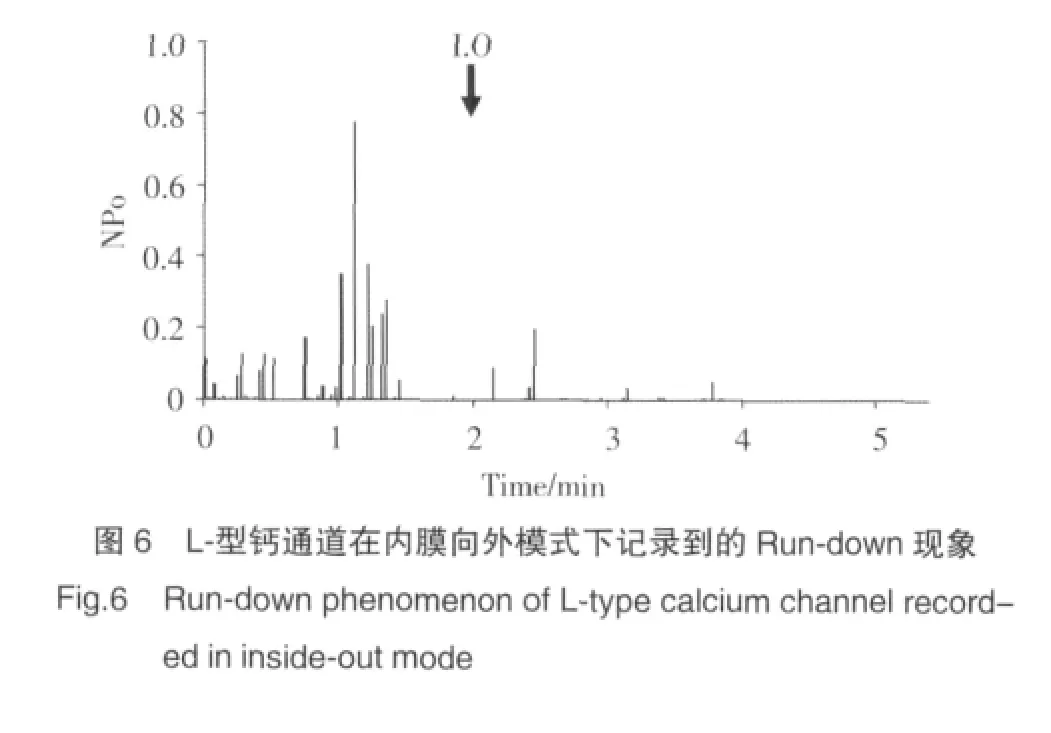
2.2.5 L-型钙通道的Run-down现象:采用内膜向外膜式记录L-型钙通道电流时,以基本细胞内液灌流膜片,通道的活性会迅速减弱直至完全消失,这种现象被称为Run-down。图6表示的是在细胞贴附模式下记录钙通道电流2 min后,再形成膜内向外膜片记录方式所得到的通道开放概率图,从图6中可以看出采用内膜向外记录模式后钙通道NPo迅速降低的现象。
3讨论
心肌细胞的分离是重要基础,膜片钳实验要求细胞标本具有呼吸活性、细胞膜完整、平滑、清洁度高,以利于微电极与细胞膜进行高阻封接。本实验中我们总结影响细胞产量和质量的关键因素如下:(1)手术:采用在体游离心脏,进行主动脉逆行插管,配合人工呼吸机,可避免手术中心肌细胞缺血缺氧,其中难点为主动脉插管深度把握。灌流液的温度一般在(35~37)℃,pH值要保持在 7.4,可以略微偏酸。另外,实验中所用灌流液均用Milli-Q水配制,其电阻值≥18 MΩ。整个灌流系统要排尽气泡,避免空气栓塞导致局部冠脉不通,灌流液需要通氧气饱和,以减轻灌流消化过程中引起的细胞缺氧甚至死亡[7]。(2)胶原酶的用量及时间:酶量过多会使细胞本身的结构遭到破坏,得到的细胞体积膨大,结构模糊,横纹消失。酶量过少,细胞间的连接未被消化,在吹打时,剪下的小块心肌组织不易分散呈絮状,用力吹打,则细胞碎片较多,死细胞多,而长杆状结构清晰的活细胞几乎没有。胶原酶的灌流时间是最大的难点和重点,实验时要根据大鼠个体的体质量和灌流液流速适当地延长或缩短消化时间[9,10]。(3)分离得到的细胞放在KB液里保存,这种高钾低钠的溶液可以显著延长细胞保存时间,改善细胞状态[11]。
L-型钙电流为小电导电流,电流幅度小,极易被埋没在噪音里,因此本实验的难点就是对整个膜片钳系统装置噪音的排除,包括膜片钳放大器、探头、电极夹持器、电极及浴槽等处的噪音。降低膜片钳系统装置的噪音,可通过接地屏蔽等方法[6]。在电极尖端玻璃外壁涂上疏水性树脂,可以降低电极噪音,涂抹时要尽可能靠近电极尖端,涂抹厚度要尽可能的厚[12],另外良好的高阻封接是获得低噪声记录的先决条件,电阻值愈大,噪声电流愈小[6]。另外,在细胞悬液中加入微量蛋白酶,有利于膜片钳实验中电极与细胞膜之间进行高阻封接[13]。
我们在实验中发现,在正常生理条件下记录到的单通道L-型钙电流的平均开放时间非常短暂,对观察实验现象和后期比较实验数据不利,因此我们采用在电极内液中加入Bay K8644的方法,使L-型钙电流的平均开放时间明显增加,且对L-型钙电流的大小无影响[8],有利于实验观察与数据分析。
本实验建立的大鼠心室肌细胞适用于膜片钳单通道记录模式,成功记录到了大鼠心室肌细胞膜上的单通道钙电流,分析其电生理学性质,其结果符合L-型钙通道电流性质,为应用膜片钳技术研究离子通道的细胞内成分的作用提供依据。
[1]杨宝峰,李宝馨,李玉荣,等.离子通道药理学[M].北京:人民卫生出版社,2005:151-152.
[2]Henry C,Tuckwell.Quantitative aspects of L-type Ca2+currents[J].Prog Neurobiol,2012,96(1):1-31.
[3]Josephson IR,Guia A,Lakatta EG,et al.Ca2+-dependent components of inactivation of unitary cardiac L-type Ca2+channels[J].J Physiol,2010,588(1):213-223.
[4]Retting J,Neher E.Emerging roles of presynaptic proteins in Ca2+-triggered exocytosis[J].Science,2002,298(5594):781-785.
[5]Dolmetsh R.Excitation-transcription coupling:signaling by ion channels to the nucleus[J].Sci STKE,2003,2003(166):4.
[6]刘振伟.实用膜片钳实验技术[M].北京:军事医学科学出版社,2005:5-105.
[7]赵美眯,赵金生,高青华,等.豚鼠心室肌细胞的分离及其基本电生理特性的观察[J].中国医科大学学报,2010,39(4):248-249.
[8]Satoh H,Katoh H,Velez P,et al.BayK 8644 increases resting Ca2+spark frequency in ferret ventricular myocytes independent of Ca2+influx:contrast with caffeine and ryanodine effects [J].Circ Res,1998,83(12):1192-1204.
[9]牛肖星,牛小麟,朱萧玲,等.不同活性的胶原酶对大鼠心肌细胞分离的影响[J].解放军医学杂志,2008,9(33):1089-1091.
[10]张军,宋俊丽,武冬梅.膜片钳实验中心肌细胞快速分离方法分析[J].中西医结合心脑血管病杂志,2008,6(10):1238-1239.
[11]Li S,Blaschke M,Henbach JF,et al.Effects of azelastine on contractility,action potentials and L-type Ca2+current in guinea pig cardiac preparations[J].Eur J Pharmacal,2001,418(1-2):7-14.
[12]陈恒胜,伍亚民,刘宝松,等.噪声来源及解决在膜片钳试验中的作用[J].中国临床康复,2004,8(5):955.
[13]Isenberg G,Kl觟ckner U.Glycocalyx is not required for slow inward calcium current in isolated rat heart myocytes[J].Nature,1980,284(5754):4358-4360.
