MMP-9和uPA在脑胶质瘤中的阳性表达及意义
2013-09-05高建洲柳红艳郭艳峰聂栓锁董超颖李兰梅
高建洲,孔 昕,柳红艳,郭艳峰,聂栓锁,贺 龙,董超颖,李兰梅
(1邯郸市第一医院,河北 邯郸 056002;2邯郸市中心医院;3河北工程大学医学院)
脑胶质瘤是颅内最常见且极具破坏性生长的肿瘤之一,浸润能力强,复发率高,治愈率低,加之手术、放疗及化疗等治疗手段缺乏特异性,是神经外科治疗的难题。脑胶质瘤的发生、发展及浸润的机理目前尚不十分清楚,其中肿瘤细胞外基质(ECM)的降解、癌基因的活化、抑癌基因的失活等均与其恶性程度和浸润密切相关。基质金属蛋白酶-9(MMP-9)属明胶酶类,对ECM的降解、组织重建以及细胞内多种可溶性因子的调控起重要作用。尿激酶型纤溶酶原激活剂(uPA)是一种丝氨酸蛋白水解酶,参与或调节肿瘤细胞的迁移和侵袭过程,在肿瘤浸润和微血管生成中起重要作用。2009年10月~2012年6月,我们观察了脑胶质瘤组织、正常脑组织中MMP-9、uPA的阳性表达情况,并探讨其与患者临床病理特征的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择同期在邯郸市第一医院行胶质瘤根治性切除的脑胶质瘤患者50例(观察组),均经影像学检查和病理诊断确诊,所有患者手术前未行化疗或放疗。其中男32例、女18例,年龄9~76(46.3 ±15.6)岁;按 WHO(2000 年)神经系统肿瘤分类标准明确病理诊断(分类和分级):Ⅰ级8例、Ⅱ级16例、Ⅲ级16例、Ⅳ级10例,为了方便统计,将Ⅰ、Ⅱ级归为低级别组,Ⅲ、Ⅳ级归为高级别组。同期取本院脑外伤颅内减压手术切除的正常脑组织标本10份(对照组),其中患者男8例、女2例,年龄10~69(40.1±13.2)岁,均经影像学检查和病理诊断确诊为正常脑组织。
1.2 方法
1.2.1 组织芯片的制作 所有组织经中性甲醛固定,石蜡包埋。标本经连续切片,厚度4 μm,进行HE染色。每一组织标本由2位病理专家作2次诊断,并在HE切片上根据典型病理部位作标记,即组织定位;制作微阵列蜡块,选用特殊工具在空白蜡块上均匀地打出小孔(直径1.0 mm),然后根据HE切片上的精确范围在供体组织蜡块相应位置获取所要组织芯片,放入受体蜡块阵列孔中,并记录组织编号,所有组织整齐排列,制成组织芯片蜡块。对组织芯片蜡块连续切片,制成组织芯片,均设有平行对照。
1.2.2 免疫组化的制作 标本经连续切片,厚度4 μm,行免疫组化S-P染色,常规免疫组化S-P试剂盒,鼠抗人MMP-9单克隆抗体和鼠抗人uPA单克隆抗体购自北京中杉金桥生物技术有限公司。方法操作按试剂盒说明书进行,取已知肿瘤组织切片作为阳性对照,以PBS缓冲液代替一抗作为阴性对照。
1.2.3 结果判断 MMP-9和uPA阳性定位于细胞质,以在细胞质内出现棕黄色颗粒为阳性信号。按照Tanaka于2000年改良的定量记分法[1]:每张切片在阳性表达较高区随机选择5个高倍镜视野(×400),连续计数至少1000个肿瘤细胞。计算阳性细胞百分率和评定显色强度。首先,依照阳性细胞所占的百分率打分,小于5%为0分,5% ~25%为1分,26% ~50%为2分,51% ~75%为3分,大于75%为4分;再依照染色强度分级打分,未显色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分(染色深浅与背景着色对比)。染色强度与阳性细胞百分率乘积分为4个等级,即0~1为阴性(-),2~4分为低表达(+),5~8分为中表达(++),9分以上为高表达(+++)。为了减少人为因素造成的判断误差,由2名高年资病理医师逐一观察同一切片,以2人观察结果核对后作为最终评定结果。
1.2.4 统计学方法 采用SPSS16.0统计软件,计数资料比较采用χ2检验。相关分析采用Spearman相关分析。P≤0.05为差异有统计学意义。
2 结果
2.1 组织芯片质量 制作阵列蜡块过程中,有2片组织芯片脱落,其他组织芯片排列整齐,无组织折叠,实际有效芯片58片,占总样本量的96.67%。
2.2 MMP-9和uPA的阳性表达与患者临床病理特征的关系 正常脑组织中MMP-9、uPA全部弱表达,脑胶质瘤组织中MMP-9、uPA的阳性表达分别为37(74.0%)、39(78.0%)例,两组比较 P 均 <0.05。MMP-9、uPA阳性表达与脑胶质瘤患者性别、年龄、WHO分期的关系见表1。

表1 MMP-9和uPA阳性表达与脑胶质瘤患者性别、年龄、WHO分期的关系
2.3 脑胶质瘤组织中 MMP-9与 uPA的关系Spearman相关分析显示,uPA的阳性表达与MMP-9的阳性表达呈正相关(r=0.456,P <0.05)。见表2。
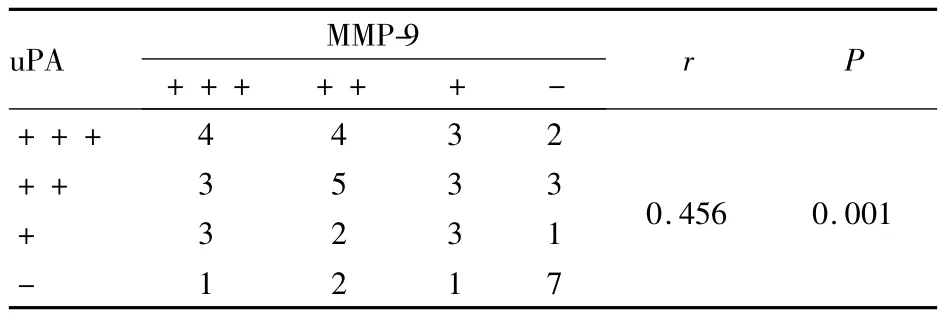
表2 MMP-9和uPA在脑胶质瘤组织中表达的相关性分析(例)
3 讨论
组织芯片由Kononen等[2]于1998年率先报道,其后得到了广泛的应用,研究内容包括膀胱移行细胞癌、结直肠癌、肺癌等,而胶质瘤方面的研究较少。由于组织标本及待测目的基因数量较多,采用常规病理学方法耗时、费力,且实验条件难以统一。因此,我们采用组织芯片技术结合免疫组织化学方法检测目的基因的阳性表达,极大地提高了效率,减少了时间及资金的耗费,同时可平行地研究组织细胞形态及蛋白的表达,避免了传统技术在不同实验条件下结果的差异,对比性和重复性强。
恶性脑肿瘤占全身肿瘤的1% ~3%[3],其中胶质瘤发生率最高,约占全部颅内肿瘤的46%[4]。随着胶质瘤恶性程度的增高,2年存活率也随之下降[5]。由于胶质瘤系浸润性生长,它和正常脑组织间没有明显界限,难以完全切除,对放疗、化疗不甚敏感,非常容易复发。同时,化学药物和一般抗肿瘤的中药因血脑屏障等因素的影响,疗效也不理想。因此,脑胶质瘤至今仍是全身肿瘤中预后最差的肿瘤之一。浸润性生长是胶质瘤的重要生物学特性,又是胶质瘤复发的根源,肿瘤的恶性程度越高,其浸润能力越强。呈浸润生长的胶质瘤,一方面沿着白质纤维突破血脑屏障,向邻近的脑组织生长;另一方面,通过降解基底膜,破坏血脑屏障,完成浸润性生长。在活组织中,ECM主要成分是Ⅳ型胶原,它的降解成为细胞侵袭与转移的关键因素,其中基质金属蛋白酶(MMPs)和uPA在ECM的重塑中起关键的作用。
MMPs是一个大家族,其中MMP-9是MMPs家族中分子量最大的酶,位于染色体20q11.1~13.1,26~27 kbp,具有 13个外显子和 9个内含子。MMP-9主要由巨噬细胞、结缔组织细胞和某些肿瘤细胞合成分泌,它可以降解Ⅳ、Ⅴ、Ⅸ、Ⅺ型胶原[6]。肿瘤发生时由具有转移倾向的肿瘤细胞自身或诱导其他细胞大量分泌MMP-9,使肿瘤细胞可以沿着受损的基底膜向周围组织浸润;它还能降低肿瘤细胞之间的黏附性,使肿瘤细胞容易脱离原发灶,提高肿瘤细胞的浸润和游走能力,最终导致恶性肿瘤的浸润及转移[7]。本实验中,我们使用脑胶质瘤组织和正常脑组织制备成的组织芯片来检测MMP-9的表达情况。结果显示,MMP-9的阳性表达明显高于正常脑组织中的阳性表达,且WHO分期高级别组的阳性表达高于低级别组,表明在胶质瘤的生长过程中,MMP-9通过降解ECM,为肿瘤细胞向周围正常脑组织侵袭提供通路和空间,促进胶质瘤的侵袭性生长。
uPA是一种丝氨酸蛋白水解酶,uPA能将纤溶酶原激活为纤溶酶,纤溶酶和尿激酶自身都能降解ECM和基底膜,参与或调节肿瘤细胞的迁移和侵袭过程,在肿瘤侵润和微血管生成中起重要作用,最终导致ECM的降解和基底膜屏障的突破[8]。目前认为,uPA是刺激肿瘤血管形成和肿瘤侵袭性生长过程中的重要因子[9]。有报道[10,11]显示,uPA 在多种恶性肿瘤中均有过表达。本研究显示,uPA蛋白结在脑胶质瘤组织中呈过度表达,在正常脑组织中不表达。uPA的表达在不同级别胶质瘤中差异有显著性,胶质瘤恶性程度越高,uPA的阳性表达越强,表明uPA在胶质瘤的浸润中起着重要的作用。
研究发现,uPA在与细胞表面的受体结合后,催化纤溶酶原转变成纤溶酶,活性纤溶酶还能激活MMP-3、MMP-9、MMP-12 和 MMP-13 等 MMPs的前体,活化的MMPs可进一步降解ECM,特别是降解其中的基质和Ⅳ型胶原,对细胞迁移和肿瘤侵袭转移过程中ECM的降解有重要作用[12],本实验研究结果与上述研究相一致。在脑胶质瘤组织中uPA蛋白高表达,同时MMP-9也高表达,而且两者具有显著正相关,提示uPA可能通过促进MMP-9表达上调,从而增强肿瘤细胞侵袭力,促进肿瘤细胞的侵袭、转移。
综上所述,我们认为MMP-9、uPA的阳性表达可能与脑胶质瘤的发生及恶性程度有关。
[1]Tanaka K,Iwamooto S,Gon G,et al.Expression of survivin and its relationship to loss of apopotosis in breast carcinomas[J].Clin Cance Res,2000,6(1):127-134.
[2]Kononen J,Bubendorf L,Kallioniemi A,et al.Tissue microarrays for high-throughput molecular profiling of tumor specimens[J].Nat Med,1998,4(7):844-847.
[3]Tan X,Egami H,Nozawa F,et al.Analysis of the invasionmetastasis mechanism in pancreatic caneer:involvement of plasmin(ogen)cascade proteins in the invasion of pancreatic cancer cells[J].Int J Onco,2006,28(2):369-374.
[4]Serena P,Lucia C,Gaetano F.Brain cancer immunoediting:novel examples provided by immunotherapy of malignant gliomas[J].Expert Review of Anticancer Therapy,2011,11(11):1759-1774.
[5]Jasmin JO,David S,Benjamin P.Angiogenic inhibition in highgrade gliomas:past,present and future[J].Expert Review of Neurotherapeutics,2012,12(6):733-747.
[6]Chakravarti A,Delaney MA,Noll E,et al.Prognostie and pathologic significance of quantitative protein expression profiling in human gliomas[J].Clin Cancer Res,2001,7(8):2387-2395.
[7]Kadoglou NP,Liapis CD.Maxtrix metalloproteinases:contribution to pathogesis,diagnosis,surveillance and treatmeat of abdominal aortic aneurysms[J].Curr Med Res Opin,2004,20(4):419-432.
[8]Peterson JT.Matrix metalloproteinase inhibitor development and the remodeling of drug discovery[J].Heart Fail Rev,2004,9(1):63-79.
[9]DeClerck YA,Mercurio AM,Stack MS,et al.Proteases,extracellular matrix,and cancer:a workshop of the path B study section[J].Am J Pathol,2004,164(4):1131-1139.
[10]Hildenbrand R,Gandhari M,Stroebel P,et al.The urokinase-system-role of cell proliferation and apoptosis[J].Histol Histopathol,2008,23(2):227-236.
[11]Hofmann HS,Bartling B,Simm A,et al.Identification and classification of differentially expressed genes in non-small cell lung cancer by expression profiling on a global human 59.620-element oligonucleotide array[J].Oncol Rep,2006,16(3):587-595.
[12]Shariat SF,Roehrborn CG,McConnell JD,et al.Association of the circulating levels of theurokinase system of plasminogen activation with the presence of prostate cancer and invasion,progression,and metastasis[J].J Clin Oncol,2007,25(4):349-355.
