酿酒酵母脂酰-∆9脱氢酶亚细胞定位表达及其对烟草脂肪酸合成的影响
2013-09-03薛金爱毛雪吴永美杨致荣贾小云张莉王计平岳爱琴孙希平李润植
薛金爱,毛雪,吴永美,杨致荣,贾小云,张莉,王计平,岳爱琴,孙希平,李润植
山西农业大学 分子农业与生物能源研究所,山西 太谷 030801
酿酒酵母脂酰-∆9脱氢酶亚细胞定位表达及其对烟草脂肪酸合成的影响
薛金爱,毛雪,吴永美,杨致荣,贾小云,张莉,王计平,岳爱琴,孙希平,李润植
山西农业大学 分子农业与生物能源研究所,山西 太谷 030801
薛金爱, 毛雪, 吴永美, 等. 酵母脂酰-∆9脱氢酶亚细胞定位表达及其对烟草脂肪酸合成的影响. 生物工程学报, 2013,29(5): 630−645.
Xue JA, Mao X, Wu YM, et al. Subcellular-targeting expression of a yeast acyl-∆9 desaturase and effects on fatty acid biosynthesis in tobacco. Chin J Biotech, 2013, 29(5): 630−645.
以烟草Nicotiana tabacumL.为宿主植物,分别在细胞质内质网和质体内定位表达酿酒酵母Saccharomyees cerevisiae脂酰-CoA-Δ9脱氢酶 (ScΔ9D),以期提高植物组织中棕榈油酸 (16∶1Δ9) 的积累量和分析该酶不同亚细胞定位表达对油脂代谢的影响。与野生型和空载体 (对照) 植物相比,转基因烟草植株叶片中单不饱和的棕榈油酸及顺式十八碳烯酸 (18∶1Δ11) 含量明显提高,而饱和的棕榈酸 (16∶0) 含量相应减少,多不饱和的亚油酸 (18∶2Δ9,12) 和亚麻酸 (18∶3Δ9,12,15) 含量亦降低。ScΔ9D质体定位表达烟叶中棕榈油酸及顺式十八碳烯酸含量分别是ScΔ9D细胞质内质网定位表达烟叶的2.7和1.9倍。这表明酵母脂酰-Δ9脱氢酶能在高等植物细胞中正确催化棕榈酸 (16∶0) 转化为棕榈油酸 (16∶1Δ9),而且在质体内表达的效应显著高于在细胞质内质网上的效应。新建立了一种应用脂酰-CoA-Δ9脱氢酶代谢工程培育植物组织高水平合成积累棕榈油酸等ω-7脂肪酸的策略,有助于在生物量大的烟叶等营养器官中组装ω-7脂肪酸合成途径以生产优质生物燃油。
脂酰-CoA-Δ9脱氢酶,亚细胞定位表达,棕榈油酸,ω-7脂肪酸,酿酒酵母,烟草
植物油脂不仅是人类食用油的主要来源,而且还是生物燃料及油脂化工业所需的可再生优质原料[1]。目前全球所消费的植物油主要来源于大豆Glycine maxL.和油菜Brassica napusL.等普通油料作物种子油。这些油料作物种子油仅含有5种主要脂肪酸,即饱和的棕榈酸 (16∶0)、硬脂酸 (18∶0)、单不饱和的油酸 (18∶1∆9)、多不饱和的亚油酸 (18∶2∆9, 12) 和亚麻酸(18∶3 ∆ 9, 12, 15)。
棕榈油酸 (16∶1∆9) 是一种由16个碳原子组成、含一个双键的ω-7脂肪酸 (16∶1ω7)。这种重要的稀有脂肪酸在普通油料种子中含量甚微(<1%),但是在一些野生植物种子中能高水平积累[2]。例如,猫爪花 (草)Doxantha unguiscatiL.,澳洲坚果Macadamia integrifolia和一种山龙眼科植物Kermadecia sinuata,其种子油分别含有64%、30%和70%的棕榈油酸。这些高积累ω-7脂肪酸的野生植物因其种子小、产量低和地理分布窄等农艺性状差,还不能像普通油料作物那样大规模种植和商业化生产种子油。
棕榈油酸具有重要的营养、医药和工业用价值。例如,棕榈油酸可增加细胞膜的流动性,减少血液中胆固醇含量,防止心律失常,抑制肿瘤发生等功能[3-7]。相反,它的前体物质棕榈酸则被证实可引起血液中胆固醇含量升高,增加心脏性疾病和结肠癌等肿瘤疾病发生率。在工业上,新近发现棕榈油酸及顺式-11-十八碳烯酸(18∶1∆11) 等 ω-7脂肪酸可直接用于高效生产工业需求量较大的1-辛烯[8-10]。棕榈油酸还具有较好的抗低温和抗氧化特性,非常适于制取优质生物柴油[11]。
棕榈油酸的自然资源少,不能低成本商业化生产,难以满足急剧增长的市场需求。因此,通过对大田油料作物油脂合成途径的遗传修饰和组装,以期大幅提高普通油料作物种子油中棕榈油酸的合成积累,就成为当今植物油脂代谢工程的一个热点研究领域[2,9,12]。在生物体内,脂酰-∆9脱氢酶负责催化棕榈酸 (16∶0) 生成棕榈油酸(16∶1Δ9)[13-14]。一些不同来源的脂酰-Δ9 脱氢酶已用于提高植物棕榈油酸含量的代谢工程,尽管目前转基因植物种子中该脂肪酸积累量(<10%) 远低于在高积累棕榈油酸植物中的含量[9,12,15-19]。
酿酒酵母Saccharomyees cerevisiae脂酰-Δ9脱氢酶 (acyl-Δ9 desaturase,ScΔ9D) 是一种结合于细胞质内质网的膜蛋白酶,属于 CoA-型脱氢酶,即脂酰-CoA-Δ9脱氢酶[20]。ScΔ9D负责酵母细胞不饱和脂肪酸的从头生成,即催化细胞质中16∶0转化为16∶1Δ9。与前人仅在高等植物细胞质中表达脂酰 CoA-Δ9脱氢酶转基因策略不同[18,21-23],本文以烟草为转基因受体,分别在质体 (叶绿体) 中和细胞质内质网上定位表达酵母脂酰CoA-Δ9脱氢酶 (ScΔ9D),解析该酶两种不同亚细胞定位表达对靶标脂肪酸即棕榈油酸(16∶1∆9) 和其他脂肪酸合成积累的影响及其机制。同时探讨能否通过遗传修饰使棕榈油酸在植物营养组织中大量合成积累。实验结果表明,酵母脂酰-CoA-Δ9脱氢酶能在高等植物细胞质体内催化16∶0生成16∶1Δ9。质体表达ScΔ9D的转基因烟叶组织中稀有单不饱和脂肪酸即棕榈油酸 (16∶1Δ9) 及其碳链延长产物顺式十八碳烯酸 (18∶1Δ11) 的含量,显著高于细胞质内质网定位表达 ScΔ9D叶组织的含量。相应地,饱和的棕榈酸 (16∶0) 以及多不饱和的亚油酸(18∶2Δ9, 12) 和亚麻酸 (18∶3Δ9, 12, 15) 含量减少。这一质体定位表达脂酰-CoA-Δ9脱氢酶显著提高植物叶组织中棕榈油酸生物合成的策略可应用于在生物量大的烟叶等营养器官中组装ω-7脂肪酸合成途径以及培育优质燃油型烟叶新种质的油脂代谢工程。
1 材料与方法
1.1 植物表达载体的构建
酵母脂酰-CoA-Δ9 脱氢酶 (ScΔ9D) 基因(GenBank Accession No. J05676.1) 的编码序列(1 533 bp) 用高保真PCR扩增酵母DNA获得,并双向测序验证所扩增序列正确性。所用正反向引物分别为 ScΔ9D-F1 和 ScΔ9D-R1 (表 1)。引物中下划线的序列分别为Hind Ⅲ、KpnⅠ和SacⅠ酶切位点序列。在反向引物终止子前加有6个编码组氨酸的密码 (粗斜体序列),以使成熟蛋白带有His-tag,便于用相应的抗体检测该蛋白表达。同样,拟南芥核酮糖 1,5-二磷酸羧化酶(RUBISCO) 小蛋白亚基 (GenBank Accession No. NM23 202) 的质体转运肽 (Transit peptide,TP) 编码序列 (171 bp) 亦用高保真PCR从实验室保存的RUBISCO克隆载体上扩增,并测序鉴定。所用正反向引物为 RUBISCO-F和RUBISCO-R (表1)。引物中下划线的序列分别为Hind Ⅲ和KpnⅠ酶切位点序列。这两个靶序列用于构建植物组成型表达载体。
首先,将ScΔ9D基因的编码序列 (1 533 bp)插入 pKYLX80载体[24]35S2启动子和rbcs3¢终止子之间,构建ScΔ9D组成型表达盒 (图1A)。其次,用EcoRⅠ和ClaⅠ从pKYLX80 载体上切取ScΔ9D表达盒,并亚克隆到 pBluescript载体的多克隆位点,形成中间载体 (图 1B)。最后用EcoRⅠ和XhoⅠ从pBluescript载体上切取ScΔ9D表达盒,并插入植物表达载体 pCAMBIA1301(http://www.cambia.org/daisy/cambia/585.html)(GenBank Accession No. AF234297.1) 的多克隆位点,构建成ScΔ9D组成型表达载体 (35SScΔ9D) (图 1C),用作细胞质内质网定位表达ScΔ9D。
将质体引导肽 (TP) 的编码序列插入到 35S启动子3¢末端和ScΔ9D基因5¢前端,构建成质体定位表达载体 (35S-TP-ScΔ9D) (图1D)。含35S启动子和 rbcs3¢终止子,不含ScΔ9D序列的pCAMBIA1301载体用作对照 (35S-vector)(图1E)。构建的表达载体经酶切和测序鉴定后,用电转化方法 (BioRad electroporation) 将之导入根癌农杆菌Agrobacterium tumefaciensGV3850菌株。
1.2 烟草的遗传转化
烟草N. tabacumL.品种KY160用作转基因受体材料。采用常规的叶盘农杆菌感染法进行遗传转化。烟草无菌苗培养、农杆菌菌液制备及侵染、共培养及选择培养,芽和根分化及植株再生培养条件和方法参见文献[16]。
1.3 转基因烟草植株的分子鉴定
应用 PCR 和 Southern blotting 检测ScΔ9D基因是否整入烟草基因组。依据 Junghans和Metzlaff[25]描述的快速提取DNA的实验方法,取植株叶片样品提取核基因组 DNA。扩增ScΔ9D基因的正反引物为ScΔ9D-F2和ScΔ9D-R2 (表1)。200 ng DNA 用于PCR反应。PCR程序为:95 ℃变性 2 min;95 ℃ 20 s,55 ℃ 30 s,68 ℃ 2 min,30个循环;最后68 ℃再延伸8 min。1%琼脂糖凝胶电泳分离PCR产物。
应用定量 PCR (qRT-PCR) 检测和 Northern blotting 检测ScΔ9D基因是否有效表达。取生长正常的4叶期烟草植株的叶片样品,用Trizol试剂的方法提取总 RNA。RNA样品用 DNase(Promega公司) 处理已消解残余的 DNA。第一链cDNA合成采用Invitrogen公司SuperScript Ⅲ反转录体系。
应用 PrimerQuest软件 (Integrated DNA Technologies,Coralville,IA) 设计实时定量 PCR扩增 147 bpScΔ9D片段的引物。正反引物为ScΔ9D-F3 和 ScΔ9D-R3 (表 1)。实时定量 PCR 应用 SYBR GreenⅠ试剂盒 (Molecular Probes,Eugene,OR) 和iCycler iQ定量PCR仪 (Bio-Rad Laboratories,Hercules,CA)。每个 96孔 PCR板上同一RNA样品重复3次,各RNA样品分别进行3次独立的实验。PCR反应程序为:95 ℃2 min;95 30 s℃,55 30 s℃,72 30 s℃,35个循环;最后72 ℃延伸5 min。18S RNA用作内参对照,正反引物为18S RNA-F和18S RNA-R(表 1)。依Livak和Schmittgen[26]描述的方法计算各样品中ScΔ9D的相对表达量。
1.4 ScΔ9D亚细胞定位表达的检测
以新鲜烟叶为试材,分别分离叶绿体蛋白、微体蛋白,细胞核蛋白和细胞总蛋白,用Western blotting检测ScΔ9D酶蛋白的定位表达。
依据Roughan等[27]和Yu等[28]描述的阶式蔗糖密度梯度离心法分离叶绿体蛋白、微体蛋白、细胞核蛋白和细胞总蛋白。蛋白质含量用Bradford[29]的方法测定。每样品 35 mg蛋白用12.5% SDS-PAGE凝胶电泳分离,电泳系统为Mini-ProteinⅡSystem (Bio-Rad公司)。一块胶用Semi-dry transfer blotter (Bio-Rad公司) 系统将分离的蛋白原位转印到硝酸纤维素膜上,电转缓冲液为TBST (2 mmol/L Tris,192 mmol/L甘氨酸,20%甲醇,0.1% SDS)。转印有蛋白的硝酸纤维素膜先在 TBS缓冲液 (加入 3% BSA) 中印迹反应1 h,然后用His-tag 单克隆抗体 (1∶2 000稀释) 印迹杂交反应 3 h。印迹膜冲洗后,依据Amersham提供的方法,应用ECL技术,用二级抗体 (Horseradish peroxidase-conjugated goat antimouse IgG) 检测结合于印迹膜上蛋白的初级抗体。
1.5 总脂肪酸提取和气相色谱 (GC) 检测脂肪酸成分及含量
烟叶和茎杆样品的总脂肪酸的提取依据Dahmer等[30]方法进行。取10~20 mg 样品放入3 mL含有 2% (V/V) 硫酸甲醇溶液的玻璃试管中,同时加入十七烷酸甘油三酯 (C17∶0) 作为内标 (10 µg/10 mg样品),充分研磨后,80 ℃热处理使样液体积减至0.4 mL。加入1 mL含有0.01% (W/V) 丁化羟基甲苯 (BHT) 的己烷,混匀后离心。取上层 (含有脂肪酸甲酯 (FAME) 的己烷层) 用于Hewlett-Packard 5 890A气相色谱仪 (0.25 mm i.d. ×0.33 μm×10 m FFAP 柱,火焰离子化检测器) (Palo Alto,CA) 检测各种脂肪酸。检测程序 (炉温) 设置为,起始温度120 ℃,1 min,按12 /min ℃增温至210 ℃,保持 3 min。然后转为按5 /min℃加热至235 ℃,保持8 min。进样口和检测器的温度分别是220 ℃和250 ℃。运载气体为氦气,气体流速为10 mL/min。
烟草种子脂肪酸分析参照 Li等[31]的方法,并稍作修改。取10 mg干种子放入6 cm长预干燥的玻璃中,向试管中加入以下溶液:1 mL现配的含 5% (V/V) 硫酸的甲醇,25 µL含 0.2%BHT 的甲醇,10 µg C17∶0 (作内标),300 µL 甲苯助溶剂。充分混合后,90 ℃~95 ℃加热1.5 h。冷却到室温后,加入1.5 mL 0.9% NaCl (W/V) 和1 mL己烷。混匀后稍离心,取上层液用于 GC测试FAMEs。GC测试条件设置同上。
所有数据都进行统计学分析,差异显著性用t-test 检验。
2 结果与分析
2.1 转基因烟草植株的测定
采用农杆菌介导烟草叶盘转化法,共获得了137株潮霉素抗性T0代烟草植株。取T0代植株的叶片分别提取核基因组 DNA,用 Southern blotting和PCR分别鉴定ScΔ9D基因的整合。从仅有一条杂交片段的T0株系上收获T1代种子。T1代种子在含有抗生素培养基上萌发,用Northern blotting 检测T1代株系ScΔ9D基因表达。从高表达的 T1代株系收获 T2代种子。用PCR和Real-time PCR分别检测T2代株系ScΔ9D基因的整合及表达。在T2代株系中检出12株空载体 (对照) 和 80株ScΔ9D转基因。叶片样品定量 PCR表明转基因株系间ScΔ9D表达量有差异,但统计分析未达极显著水平 (P<0.01) (图2)。分别选择ScΔ9D表达量高且相似的两类亚细胞定位表达的转基因株系各 15个株系用于后续分析。
2.2 ScΔ9D蛋白的亚细胞定位
为了对质体表达及细胞质表达的 ScΔ9D蛋白质进行亚细胞定位,本实验选用T2代转基因烟叶作为样品,按照蔗糖密度梯度分别制备叶绿体、微粒体、细胞核和总细胞蛋白。使用蛋白质印迹 (Western blotting) 杂交方法,鉴定 ScΔ9D蛋白的表达及定位情况。结果发现,在35S-TP-ScΔ9D转化的烟草样品中,ScΔ9D 蛋白只在叶绿体和总细胞蛋白样品中检测到 (图3)。相反,35S-ScΔ9D转化的烟草样品中,该蛋白质却只在微粒体蛋白和总细胞蛋白样品中检测到(图3)。显然,35S-ScΔ9D转化的烟草,其 ScΔ9D仅在细胞质内质网 (ER) 上表达,这与该蛋白在其酵母细胞中细胞质表达定位一致。35S-TPScΔ9D转化的烟草细胞中,在转运肽 (TP) 指导下,成熟的ScΔ9D酶蛋白仅在叶绿体/质体中表达和行使功能。
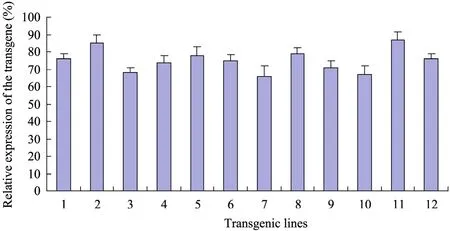
图2 T2转基因烟草株系叶片组织中ScΔ9D mRNA的表达Fig. 2 Expression of ScΔ9D mRNA in the T2 transgenic tobacco leaves. The ScΔ9D mRNA expression was measured by quantitative real-time PCR using SYBR Green I and 18S RNA was used as internal gene reference. RNA samples were prepared from the randomly selected transgenics. RNA samples loaded in Lane 1−6 were from the cytosol-targeting expression lines of the gene while Lane 7−12 were from the plastid-targeting expression lines.
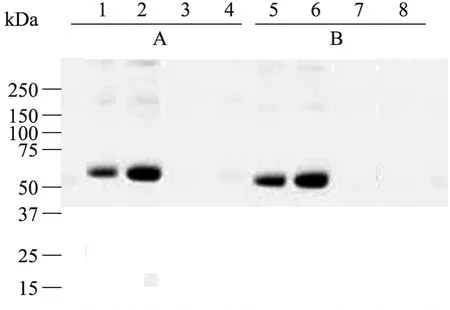
图3 Western blotting检测T2代转基因烟草ScΔ9D酶蛋白的亚细胞定位Fig. 3 Subcellular localization of the ScΔ9D protein in the transgenic tobacco by Western blotting. (A) Protein samples prepared from the ScΔ9D plastid-targeting expression lines. (B) Protein samples prepared from the ScΔ9D cytosol-targeting expression lines. The proteins in Lane 1 and 5 were from the whole cell fractions. The proteins in Lane 2 and 7 were from chloroplast fractions.The proteins in Lane 3 and 6 were from microsome fraction. The proteins in Lane 4 and 8 were from nuclei fractions.
2.3 ScΔ9D转基因烟叶组织中脂肪酸组成的变化
为了鉴别质体和细胞质定位表达 ScΔ9D对营养组织中脂质合成的影响差异,我们应用气相色谱首先对转基因烟草植株叶片组织中脂肪酸成分及其含量进行测定。
如表2所示,在所测试的样品中 16-和 18-碳脂肪酸都发生了一些显著的改变。植物叶片通常情况下合成积累8%左右的特有脂肪酸16∶3。与对照和野生型相比,16∶3在 ScΔ9D表达的烟叶中含量减少,但统计分析未达显著水平(P<0.05)。然而,在质体和细胞质内质网定位表达 ScΔ9D的烟叶中,饱和棕榈酸 (16∶0) 从对照和野生型植株的 18%左右分别减低为 11.1%和12.6%。相反,质体和细胞质定位表达ScΔ9D则使单不饱和棕榈油酸 (16∶1Δ9) 含量分别增至 21.7%和 8.3%。空载体转基因和野生型烟叶仅含微量的棕榈油酸 (<0.51%)。对各转基因株系脂肪酸组成变化的统计分析显示 (表3),烟叶脂肪酸成分中,伴随16∶0含量降低,16∶1Δ9含量相应增高,二者为负相关关系。ScΔ9D细胞质表达株系的 16∶0和 16∶1Δ9相关系数r=−0.77**,ScΔ9D 质体表达株系的相关系数r=−0.81**,达极显著水平 (P<0.01)。这两种16碳脂肪酸含量的变化表明 ScΔ9D在高等植物细胞的细胞质内质网上和质体内均能行使功能,催化16∶0生成16∶1Δ9,且在质体内效应高于在细胞质ER上的效应。
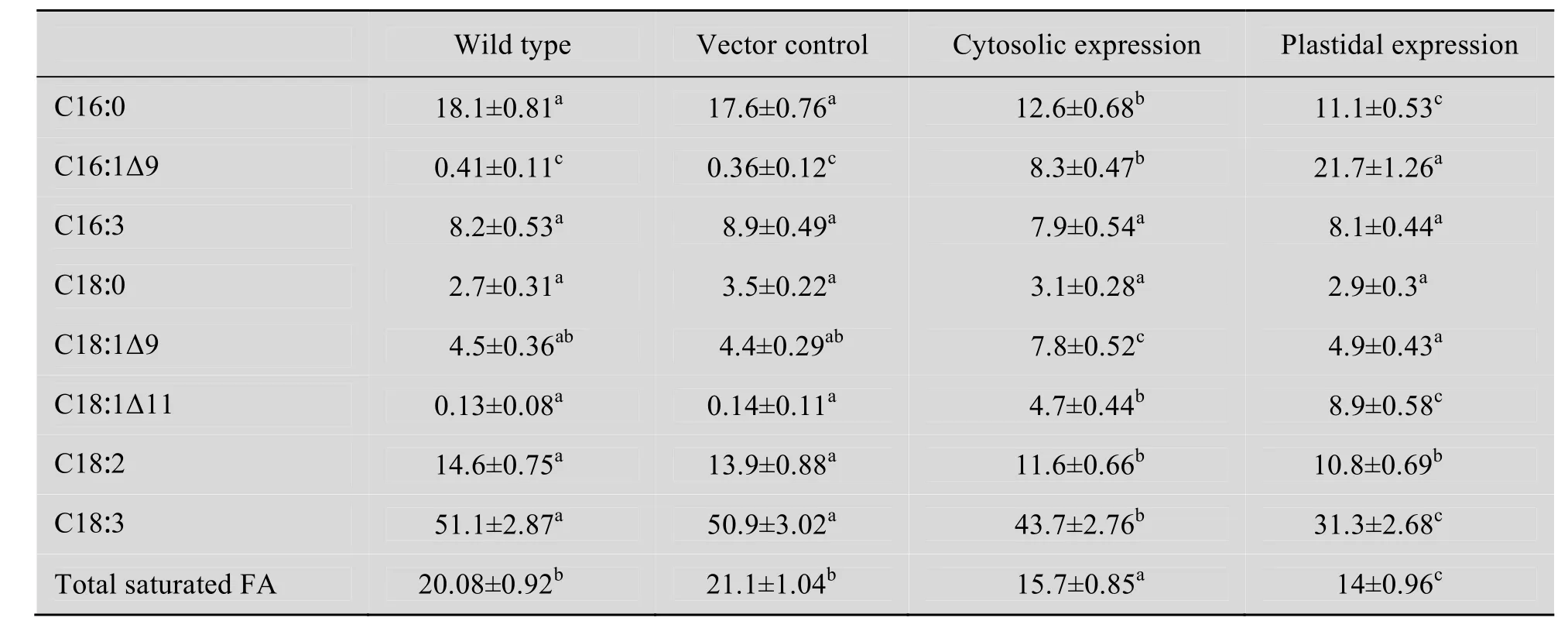
表2 ScΔ9D转基因烟草和对照株系叶片组织中各脂肪酸的含量 (%)Table 2 Fatty acid content (%) in the leaves of ScΔ9D-transgenic tobacco and the controls
与16碳脂肪酸变化相似,转基因烟叶组织中18-碳脂肪酸的比例也都发生了改变 (表2)。尤其是顺式异油酸 (18∶1Δ11) 合成和积累都显著增加,在ScΔ9D细胞质表达株系中含量达4.7%,在ScΔ9D质体表达株系的含量为8.9%。但在对照植物中 18∶1Δ11含量却很少 (<0.15%)。此外,18∶1Δ11含量增加的烟叶组织中 16∶1Δ9也增加。18∶1Δ11和16∶1Δ9含量呈正相关性,与16∶0含量为负相关 (表3)。这表明转基因植株中的16∶0生成16∶1Δ9的同时伴有18∶1Δ11的生成。显然,18∶1Δ11是 16∶1Δ9的碳链延长产物。与棕榈酸 (16∶0) 不同,另一种重要饱和脂肪酸即硬脂酸 (18∶0) 的含量在所有检测的材料中未见明显改变。与对照烟叶相比,ScΔ9D细胞质表达的烟叶中,单不饱和油酸(18∶1Δ9) 的水平从野生型的4.5%增加至7.8%。ScΔ9D质体定位表达的烟叶组织中该脂肪酸含量却未观察到明显提高。与油酸在所测材料中的变化不同,多不饱和脂肪酸即亚油酸 (18∶2∆9,12) 和亚麻酸 (18∶3∆9, 12, 15) 在细胞质和质体定位表达 ScΔ9D的两种转基因烟叶组织中的含量均减少,尤其是18∶3降低了7.4%和20%。两种多不饱和脂肪酸和16∶0含量变化表现为正相关,而与16∶1 Δ9含量则为负相关 (表3)。
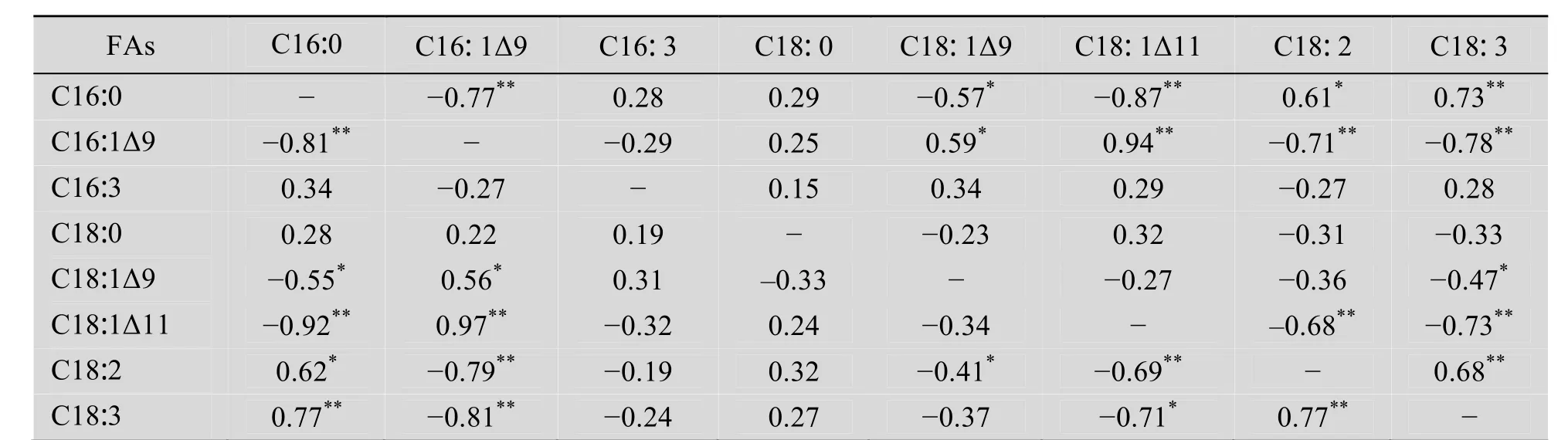
表3 ScΔ9D转基因烟草叶片组织中各脂肪酸含量的相关系数 (r)Table 3 Correlation coefficient (r) between the proportion of fatty acids (FAs) in the ScΔ9D-transgenic tobacco leaves (n=15)
2.4 ScΔ9D 转基因烟草茎组织中脂肪酸成分的变化
ScΔ9D的表达也导致转基因烟草茎组织中脂肪酸成分及含量的明显改变 (表4)。16∶0 含量降低,而 16∶1Δ9合成显著增加。ScΔ9D细胞质和质体定位表达的转基因烟草茎组织中16∶1Δ9含量分别高达7.1%和17.3%。16∶0和16∶1Δ9含量负相关 (质体表达材料为r=−0.92**,细胞质表达材料为r=−0.86**) (表5)。与叶片情形相似,转ScΔ9D基因烟草茎组织中18∶1Δ11与 16∶0和 16∶1Δ9含量也分别表现为负相关和正相关。这又一次表明酰基-Δ9脱氢酶在高等植物细胞的质体内以及细胞质ER上均能催化16∶0生成16∶1Δ9,进而在另一种延长酶作用下生成 18∶1Δ11。其他几种脂肪酸即18∶0、18∶1Δ9、18∶2和 18∶3在茎组织中合成积累模式与烟叶组织的相似。
2.5 ScΔ9D转基因烟草种子脂肪酸成分变化
如表6所示,在对照和野生型烟草种子中未检测出 16∶1Δ9和 18∶1Δ11,在转ScΔ9D基因烟草种子中,这两种脂肪酸含量分别为 2.0%左右和0.4%左右,相应地16∶0含量减少1%左右。这种差异在 ScΔ9D细胞质和质体定位表达的转基因烟草间不明显。其他16碳和18碳脂肪酸的合成积累在对照和转基因株系间亦无显著差异。可见,35S驱动ScΔ9D表达改变烟草种子脂肪酸组成作用有限。
2.6 ScΔ9D超表达的去饱和效应及其对饱和脂肪酸含量的影响
为进一步分析酵母酰基-Δ9脱氢酶在高等植物细胞质内质网上和质体内的催化效率,应用公式[16∶1Δ9/(16∶0 + 16∶1Δ9)]×100 来计算棕榈酸 (16∶0) 的去饱和指数 (Index of 16∶0 desaturation)。该指数可反映16∶0被去饱和的比例。与对照植株相比,ScΔ9D转基因植株的16∶0去饱和指数平均值提高了 39~66倍 (表 7)。ScΔ9D细胞质ER表达的烟草叶片和茎组织中,16∶0去饱和指数分别为39.71和30.21。ScΔ9D质体定位表达的烟草叶片和茎组织的16∶0去饱和指数分别高达66.15和54.92,远高于非转基因烟草叶片和茎组织的去饱和指数 (~2)。显然,在转基因烟草叶片和茎组织中,酵母酰基-Δ9脱氢酶在质体中的催化效率高于在细胞质内质网上的催化效率。在种子中质体表达和细胞质表达材料的16∶0去饱和指数分别为17.59和18.75,二者间无差异,但明显低于茎叶组织中 ScΔ9D表达材料的指数值。再次说明组成型表达ScΔ9D在种子中作用欠佳。
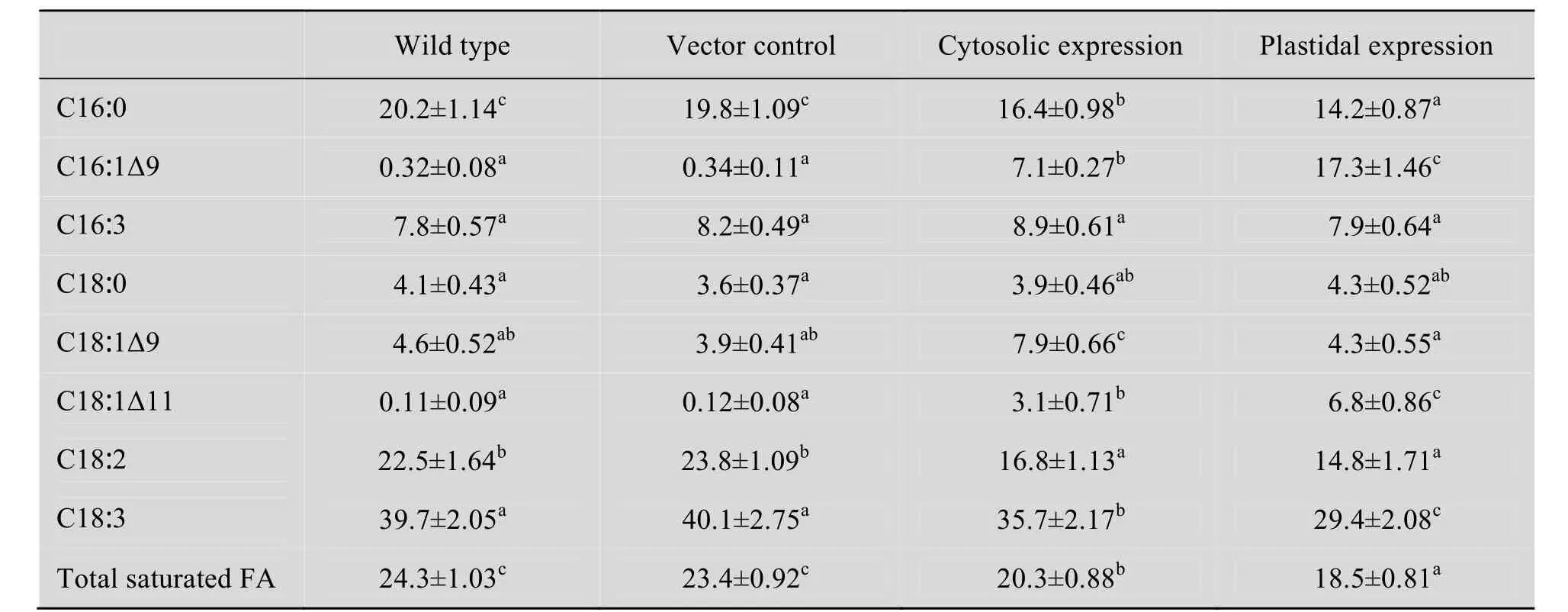
表4 ScΔ9D转基因烟草和对照株系茎组织中各脂肪酸的含量 (%)Table 4 Fatty acid content (%) in the stem tissues of ScΔ9D-transgenic tobacco and the controls

表5 ScΔ9D转基因烟草茎组织中各脂肪酸含量的相关系数(r)Table 5 Correlation coefficient (r) between the proportion of fatty acids (FAs) in the ScΔ9D-transgenic tobacco stems (n=15)

表6 ScΔ9D转基因烟草和对照株系种子中各脂肪酸的含量(%)Table 6 Fatty acid content (%) in the seeds of ScΔ9D-transgenic tobacco and the controls
饱和脂肪酸含量亦是评价酰基脱氢酶催化效率的一个指标。由表 2、4和6可知,ScΔ9D的两种亚细胞定位表达都会导致烟草叶片,茎和种子中饱和脂肪酸 (16∶0) 含量减少,尽管18∶0含量无明显变化。ScΔ9D质体定位表达的烟草饱和脂肪酸含量低于 ScΔ9D细胞质定位表达的饱和脂肪酸含量。这又说明质体定位表达的ScΔ9D酶催化效率更高。
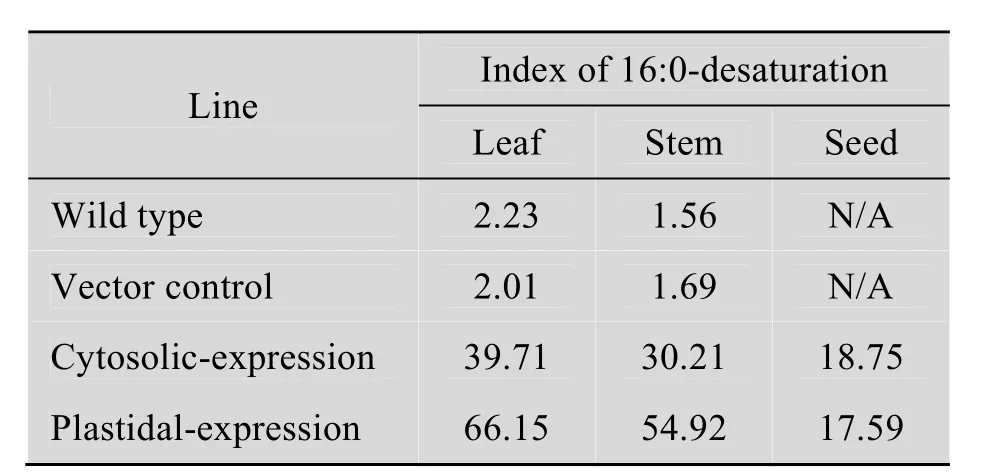
表 7 ScΔ9D转基因烟草和对照植株棕榈酸 (16∶0)的去饱和指数Table 7 Index of 16:0-desaturation of the ScΔ9D transgenics and the control tobacco
3 讨论
应用代谢工程提高普通油料作物种子合成积累棕榈油酸的常规技术策略是在种子中超表达异源脂酰-CoA-Δ9脱氢酶,或者脂酰-ACP-Δ9脱氢酶[9,12,15-19]。与前人仅在细胞质中表达脂酰-CoA-Δ9脱氢酶不同,本研究在烟草营养组织器官中分别进行细胞质内质网和质体 (叶绿体) 定位表达酵母脂酰-CoA-Δ9脱氢酶 (ScΔ9D),以期分析这两种不同亚细胞定位表达 ScΔ9D的催化效率及其对植物油脂代谢和脂肪酸组成的影响。本实验数据表明,组成型超表达编码酵母脂酰-CoA-Δ9脱氢酶的cDNA克隆,能将烟草叶片及茎组织中部分棕榈酸 (16∶0) 转化成棕榈油酸(16∶1Δ9),16∶0 的去饱和指数大幅增高 (表 2,4和 7)。尤其是质体定位表达的 ScΔ9D 催化16∶0生成16∶1Δ9的效率显著高于细胞质内质网定位表达的 ScΔ9D。在酵母细胞中,脂酰-CoA-Δ9脱氢酶定位于细胞质内质网催化 16∶0生成16∶1Δ9。与酵母细胞不同,高等植物细胞具有专门进行光合作用的细胞器即叶绿体。在高等植物细胞中,棕榈酸 (16∶0) 是在叶绿体 (质体) 内从头合成的,这样便为质体定位表达的酵母脂酰-CoA-Δ9脱氢酶就近提供了较多的底物16∶0,进而提高了ScΔ9D的催化效率。由此推测,一些在细胞质起作用的酶蛋白也可在质体内行使功能,甚至催化效率更高,使目标化合物合成积累更多。与本研究这一发现相似的是,近年来一些研究将一个甚至多个细胞质型酶蛋白导入叶绿体,获得目标化合物高水平合成[32]。例如,高等植物细胞的甲戊二羟酸途径由6个酶蛋白组成,这一途径在细胞质中运行。Kumar等[33]在烟草叶绿体中成功地定位表达了这一完整的细胞质代谢途径,极大地提高了烟叶组织中甲羟戊酸、胡萝卜素、鲨烯、甾醇和三酰甘油的合成积累量。
本研究另一个发现是,ScΔ9D转基因烟草茎叶组织和种子中均检测到含量较高的顺式-十八碳烯酸 (18∶1Δ11),但非转基因和空载体对照植株几乎检测不到这种稀有脂肪酸 (表2,4和6)。更为重要的是,18∶1Δ11含量与 16∶1Δ9含量呈正相关,而与16∶0含量呈负相关 (表3和5),这表明18∶1Δ11是16∶1Δ9的碳链延长产物。与之相似的发现也在其他一些研究中获得印证。例如,组成型表达哺乳动物脂酰-CoA-Δ9脱氢酶的转基因烟草茎叶组织[18]以及组成型表达猫爪花 (草)Doxantha unguis-catiL.脂酰-ACP-Δ9 脱氢酶的转基因拟南芥Arabidopsis thaliana和油菜Brassica napusL.种子中[12]均发现积累较多的16∶1Δ9和18∶1Δ11。本文实验数据还显示,与细胞质定位表达 ScΔ9D的转基因植株相比,质体定位表达 ScΔ9D转基因植株茎叶组织中18∶1Δ11的含量更高。可能原因是,在质体内由于 ScΔ9D 催化 16∶0生成大量的 16∶1Δ9。16∶1Δ9是行使脂肪酸碳链延伸功能的酮酯酰-ACP合成酶 (KAS II) 的作用底物。足量16∶1Δ9的提供显然增强了该酶活性,进而催化生成较多的18∶1Δ11。
本文对转基因烟草植株的脂肪酸组成及其含量的统计分析表明,与对照烟草植株相比,ScΔ9D细胞质ER定位表达也导致烟草茎叶组织中油酸 (18∶1Δ9) 含量增高,但ScΔ9D质体定位表达则未引起转基因烟草茎叶组织中油酸含量的明显变化 (表2和4)。出现这样的结果是可以理解的。离体生化实验已证明酵母脂酰-CoA-Δ9脱氢酶对底物16∶0和18∶0具有同等效率的催化活性[34]。与在酵母中的功能相似,细胞质ER定位表达的ScΔ9D不仅催化16∶0生成16∶1Δ9,亦能催化 18∶0形成 18∶1Δ9。因此,与对照相比,ScΔ9D细胞质ER定位表达的组织中18∶1Δ9含量升高。如上所述,棕榈酸 (16∶0)从头合成是在质体中发生的。与胞质相比,叶绿体/质体内含有较高水平的16∶0,这显然有利于导入的外源酵母Δ9D酶催化16∶0生成16∶1Δ9的酶活性表达。这种变化未影响到质体内源脂酰-Δ9脱氢酶催化底物18∶0生成18∶1Δ9的活性。因而与对照相比,18∶1Δ9含量未发生明显改变。转脂酰-Δ9脱氢酶导致 16∶1Δ9和 18∶1Δ9含量共升高,有利于增强植物油抗氧化性[16,18]。
在转ScΔ9D基因烟草组织中,随着16∶1Δ9和18∶1Δ11的增加,多不饱和脂肪酸18∶2和18∶3含量均减少 (表2,4和6)。目前还不清楚这一现象是否与单不饱和脂肪酸和饱和脂肪酸的比率有关。一个可能的解释是,植物细胞具有一个非常精细的机制能感知和调节细胞内总脂肪酸不饱和的程度。Moon等[18]发现,尽管脂酰-Δ9脱氢酶转基因烟草植株组织中,单不饱和脂肪酸含量增加,饱和脂肪酸含量降低,但与对照相比,每个甘油脂分子所含双键的平均数量与对照植株没有明显差异。因此,在超表达酵母 Δ9脱氢酶的转基因烟草组织中,18∶2和18∶3水平的降低可解释为是高等植物细胞对单不饱和脂肪酸含量增加的应答回补机制,这样可确保细胞内总脂肪酸的不饱和键数量相对稳定。一些珍稀脂肪酸植物代谢工程研究揭示,在靶标脂肪酸(如环氧化脂肪酸) 合成步骤的下游存在某种回补机制可改变其他脂肪酸组成及含量以响应靶标脂肪酸的积累[35]。
应当指出,表达不同的脂酰-Δ9脱氢酶除导致16∶1Δ9合成量提高外,对其他脂肪酸组成及含量的影响有较大的差异。例如,在拟南芥和油菜中组成型表达猫爪草脂酰-ACP-Δ9脱氢酶cDNA,未引起转基因种子中总饱和脂肪酸含量明显减少,甚至饱和脂肪酸 18∶0含量反而升高[12]。然而,本文数据显示,酵母Δ9脱氢酶亚细胞定位表达未引起18∶0含量明显改变,而且总饱和脂肪酸含量显著降低。这种不一致性可能与所表达的脂酰-Δ9脱氢酶来源及活性,所用启动子和亚细胞表达以及宿主的不同有关。
比较转基因烟草叶片和茎组织 16∶1Δ9合成和其他脂肪酸含量变化 (表 2和 4) 发现,细胞质定位表达 ScΔ9D的叶片和茎组织间的差异明显小于质体定位表达 ScΔ9D所产生的差异。质体定位表达 ScΔ9D 的烟草叶片组织 16∶1Δ9的合成量显著高于茎组织中16∶1Δ9的积累量,这可能是叶肉细胞比茎组织薄壁细胞含有较丰富的叶绿体所致。另外,组成型超表达ScΔ9D的烟草种子16∶1Δ9合成量低,其他脂肪酸含量变化程度 (表 6) 也显著小于茎叶组织中的改变。这也许是 35S驱动的ScΔ9D表达载体不像在茎叶组织中那样高效,也可能受不同植物种子的发育进程和油脂合成途径调控机制的影响。例如,35S驱动脂酰-Δ9脱氢酶表达可使拟南芥种子脂肪酸组成发生显著的改变[12],但在大豆体细胞胚中效果不明显[18]。
综上所述,组成型超表达酵母脂酰-CoA-Δ9脱氢酶 (ScΔ9D) 可使烟草茎叶组织中 ω-7脂肪酸 (16∶1Δ9和18∶1Δ11) 含量明显提高。而且,ScΔ9D在质体中定位表达的效果远高于细胞质定位表达,表明胞质型脂酰-CoA-Δ9脱氢酶能在植物细胞叶绿体中行使催化16∶0生成16∶1Δ9的功能。一些叶绿体定位表达的酵母脂酰Δ9脱氢酶转基因烟草株系的茎叶组织总脂肪酸中ω-7脂肪酸含量高达20%以上。这些转基因烟草株系生长发育表型与非转基因对照烟草植株无异。然而,转基因烟草茎叶组织的含油量并未提高,约2%~4%。新近一些油脂代谢工程有望培育出烟叶组织含油量>10%的品系[36]。将本文建立的提高烟草茎叶组织16∶1Δ9和18∶1Δ11含量的技术路径与提高烟叶等营养器官总含油量代谢工程技术结合,有望培育获得植物营养器官棕榈油酸和总含油量均高的新型烟草,专用于生产优质生物柴油。
[1]Durrett TP, Benning C, Ohlrogge J. Plant triacylglycerols as feedstocks for the production of biofuels. Plant J, 2008, 54(4): 593−607.
[2]Wu YM, Mao X, Wang SJ, et al. Systematic metabolic engineering of ω-7 fatty acids in plants.Chin Bull Bot, 2011, 46(5): 575−585 (in Chinese).
吴永美, 毛雪, 王书建, 等. 植物ω-7脂肪酸的系统代谢工程. 植物学报, 2011, 46(5): 575−585.
[3]Welters HJ, Diakogiannaki E, Mordue JM, et al.Differential protective effects of palmitoleic acid and cAMP on caspase activation and cell viability in pancreatic beta-cells exposed to palmitate.Apoptosis, 2006, 11(7): 1231−1238.
[4]Maedler K, Oberholzer J, BucherP, et al.Monounsaturated fatty acids prevent the deleterious effects of palmitate and high glucose on human pancreatic beta-cell turnover and function.Diabetes, 2003, 52(3): 726−733.
[5]Georgel P, Crozat K, Lauth X, et al. A Toll-like receptor 2-responsive lipid effector pathway protects mammals against skin infections with gram-positive bacteria. Infect Immun, 2005, 73(8):4512−4521.
[6]Misra A, Singhal N, Khurana L, et al. The metabolic syndrome and type 2 diabetes in developing countries: Role of Dietary Fats and Oils. J Am Coll Nutr, 2010, 29(3): 289S−301S.
[7]Akazawa Y, Cazanave S, Mott JL, et al.Palmitoleate attenuates palmitate-induced Bim and PUMA up-regulation and hepatocyte lipoapoptosis.J Hepatol, 2010, 52(4): 586−593.
[8]Meier MAR. Metathesis with Oleochemicals: new approaches for the utilization of plant oils as renewable resources in polymer science. Macromol Chem Phys, 2009, 210(13-14): 1073 −1079.
[9]Nguyen HT, Mishra G, WhittleE, et al. Metabolic engineering of seeds can achieve levels of omega-7 fatty acids comparable with the highest levels found in natural plant sources. Plant Physiol, 2010,154(4): 1897−1904.
[10]Rybak A, Fokou PA, Meier MAR. Metathesis as a versatile tool in oleochemistry. Eur J Lipid Sci Tech, 2008, 110(9): 797−804.
[11]Knothe G. Biodiesel derived from a model oil enriched in palmitoleic acid, Macadamia nut oil.Energ Fuel, 2010, 24 (3): 2098−2103.
[12]Bondaruk M, Johnson S, Degafu A, et al.Expression of a cDNA encoding palmitoyl-acyl carrier protein desaturase from cat's claw(Doxantha unguis-catiL.) inArabidopsis thalianaandBrassiea napusleads to accumulation of unusual unsaturated fatty acids and increased stearic acid content in the seed oil. Plant Breeding,2007, 126(2): 186−194.
[13]Ohlrogge J, Browse J. Lipid biosynthesis. Plant Cell, 1995, 7(7): 957−970.
[14]Marillia EF, Giblin EM, Covello PS, et al. A desaturase-like protein from white spruce is a Delta(9) desaturase. FEBS Lett, 2002, 526(1/3):49−52.
[15]Choudhary ML, Chin CK, Polashock JJ, et al.Agrobacterium-mediated transformation of petuniahybrida with yeast Delta-9 fatty-acid desaturase.Plant Growth Regul, 1994, 15(2): 113−116.
[16]Grayburn WS, Hildebrand DF. Progeny analysis of tobacco that express a mammalian Delta-9 desaturase. J Am Oil Chem Soc, 1995, 72(3):317−321.
[17]Wang C, Chin CK, Chen A. Expression of the yeast Delta-9 desaturase gene in tomato enhances its resistance to powdery mildew. Physiol Mol Plant P,1998, 52(6): 371−383.
[18]Moon H, Hazebroek J , Hildebrand DF, . Changes in fatty acid composition in plant tissues expressing a mammalian Delta 9 desaturase. Lipids, 2000,35(5): 471−479.
[19]Xing JS, Chin CK. Modification of fatty acids in eggplant affects its resistance toVerticillium dahliae. Physiol Mol Plant P, 2000, 56(5):217−225.
[20]Stukey JE, McDonough VM, Martin CE. The OLE1 gene ofSaccharomyces cerevisiaeencodes the delta 9 fatty acid desaturase and can be functionally replaced by the rat stearoyl-CoA desaturase gene. J Biol Chem, 1990, 265(33):20144−20149.
[21]Polashock JJ, Chin CK, Martin CE. Expression of the yeast Delta-9 fatty-acid desaturase in nicotiana-tabacum. Plant Physiol, 1992, 100(2):894−901.
[22]Kaup MT, Froese CD, Thompson JE. A role for diacylglycerol acyltransferase during leaf senescence. Plant Physiol, 2002, 129(4): 1616−1626.
[23]Kinney AJ, Cahoon EB, Hitz WD. Manipulating desaturase activities in transgenic crop plants.Biochem Soc T, 2002, 30(6): 1099−1103.
[24]Schardl CL, Byrd AD, Benzion G, et al. Design and construction of a versatile system for the expression of foreign genes in plants. Gene, 1987, 61(1): 1−11.
[25]Junghans H, Metzlaff M. A simple and rapid method for the preparation of total plant DNA.Biotechniques, 1990, 8(2): 176.
[26]Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2–∆∆CTmethod. Methods, 2001, 25:402−408.
[27]Roughan PG, Holland R, Slack CR. The Role of chloroplasts and microsomal fractions in polar-lipid synthesis from acetate-1-C-14 by cell-free preparations from spinach (Pinacia-Oleracea)leaves. Biochem J, 1980, 188(1): 17−24.
[28]Yu KS, McCracken CT, Li RZ, et al.Diacylglycerol acyltransferases from Vernonia and Stokesia prefer substrates with vernolic acid.Lipids, 2006, 41(6): 557−566.
[29]Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 1976, 72: 248−254.
[30]Dahmer ML, Fleming PD, Collins GB, et al. A rapid screening technique for determining the lipid composition of soybean seeds. J Am Oil Chem Soc,1989, 66(4): 543− 548.
[31]Li YH, Beisson F, Pollard M, et al. Oil content ofArabidopsisseeds: the influence of seed anatomy,light and plant-to-plant variation. Phytochemistry,2006, 67(9): 904−915.
[32]Wu SQ, Schalk M, Clark A, et al. Redirection of cytosolic or plastidic isoprenoid precursors elevates terpene production in plants. Nat Biotechnol, 2006,l24: 1441−1447.
[33]Kumar S, Hahn FM, Baidoo E, et al. Remodeling the isoprenoid pathway in tobacco by expressing the cytoplasmic mevalonate pathway in chloroplasts. Metab Eng, 2012, 14(1): 19−28.
[34]Bossie MA, Martin CE. Nutritional regulation of yeast delta-9 fatty acid desaturase activity. J Bacteriol, 1989, 171(12): 6409−6413.
[35]Li RZ, Yu KS, Wu YM, et al. Vernonia DGATs can complement the disrupted oil and protein metabolism in epoxygenase-expressing soybean seeds. Metab Eng, 2012, 14(1): 29−38.
[36]Andrianov V, Borisjuk N, Pogrebnyak N, et al.Tobacco as a production platform for biofuel:overexpression ofArabidopsisDGAT and LEC2 genes increases accumulation and shifts the composition of lipids in green biomass. Plant Biotechnol J, 2010, 8(3): 277−287.
September 27, 2012; Accepted: February 22, 2013
Runzhi Li. Tel: +86-354-6288374; E-mail: rli2001@hotmail.com
Expression of yeast acyl-∆9 desaturase for fatty acid biosynthesis in tobacco
Jin’ai Xue, Xue Mao, Yongmei Wu, Zhirong Yang, Xiaoyun Jia, Li Zhang, Jiping Wang,Aiqin Yue, Xiping Sun, and Runzhi Li
Institute of Molecular Agriculture and Bioenergy,Shanxi Agricultural University,Taigu030801,Shanxi,China
Palmitoleic acid (16:1Δ9), an unusual monounsaturated fatty acid, is highly valued for human nutrition,medication and industry. Plant oils containing large amounts of palmitoleic acid are the ideal resource for biodiesel production. To increase accumulation of palmitoleic acid in plant tissues, we used a yeast (Saccharomyees cerevisiae)acyl-CoA-Δ9 desaturase (ScΔ9D) for cytosol- and plastid-targeting expression in tobacco (Nicotiana tabacumL.). By doing this, we also studied the effects of the subcellular-targeted expression of this enzyme on lipid synthesis and metabolism in plant system. Compared to the wild type and vector control plants, the contents of monounsaturated palmitoleic (16:1Δ9)andcis-vaccenic (18:1Δ11) were significantly enhanced in theScΔ9D-transgenic leaves whereas the levels of saturated palmitic acid (16:0) and polyunsaturated linoleic (18:2) and linolenic (18:3) acids were reduced in the transgenics. Notably,the contents of 16:1Δ9 and 18:1Δ11 in the ScΔ9D plastidal-expressed leaves were 2.7 and 1.9 folds of that in the cytosolic-expressed tissues. Statistical analysis appeared a negative correlation coefficient between 16:0 and 16:1Δ9 levels.Our data indicate that yeast cytosolic acyl-CoA-Δ9 desaturase can convert palmitic (16:0) into palmitoleic acid (16:1Δ9) in high plant cells. Moreover, this effect of the enzyme is stronger with the plastid-targeted expression than the cytosol-target expression. The present study developed a new strategy for high accumulation of ω-7 fatty acids (16:1Δ9 and18:1Δ11) in plant tissues by protein engineering of acyl-CoA-Δ9 desaturase. The findings would particularly benefit the metabolic assembly of the lipid biosynthesis pathway in the large-biomass vegetative organs such as tobacco leaves for the production of high-quality biodiesel.
Acyl-CoA-Δ9 desaturase, subcellular-targeting expression, palmitoleic acid, ω-7 fatty acid,Saccharomyees cerevisiae, tobacco
Supported by: National Natural Science Foundation of China (Nos. 30971806, 31201266), Key Project of Chinese Ministry of Education (No.2002-03), Natural Science Foundation of Shanxi (No. 2010011038-1), Program for the Innovative Talents of Higher Learning Institutions of Shanxi(No. 201003), Breeding Fund of Shanxi Agricultural University (No. 2005041).
国家自然科学基金 (Nos. 30971806, 31201266),国家教育部科技重点项目 (No. 2002-03),山西省自然科学基金 (No. 2010011038-1),山西省高等学校优秀青年学术带头人支持计划 (No. 201003),山西农业大学育种基金 (No. 2005041) 资助。
时间:2013-03-22 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20130322.1435.001.html
(本文责编 陈宏宇)
