兼性厌氧芽胞杆菌TSH1丁醇代谢途径中关键酶的检测
2013-09-03段晓瑞王根宇刘宏娟薛建伟张建安
段晓瑞,王根宇,刘宏娟,薛建伟,张建安
1 太原理工大学精细化工研究所,山西 太原 0300242 清华大学核能与新能源技术研究院,北京 100084
兼性厌氧芽胞杆菌TSH1丁醇代谢途径中关键酶的检测
段晓瑞1,2,王根宇2,刘宏娟2,薛建伟1,张建安2
1 太原理工大学精细化工研究所,山西 太原 030024
2 清华大学核能与新能源技术研究院,北京 100084
段晓瑞, 王根宇, 刘宏娟, 等. 兼性厌氧芽胞杆菌 TSH1丁醇代谢途径中关键酶的检测. 生物工程学报, 2013, 29(5):620−629.
Duan XR, Wang GY, Liu HJ, et al. Key enzymes in butanol fermentation by a facultative anaerobeBacillussp. TSH1. Chin J Biotech, 2013, 29(5): 620−629.
传统的丁醇生产菌均严格厌氧,本实验室分离了一株兼性厌氧的芽胞杆菌TSH1 (Bacillussp. TSH1),丁醇梭菌具有相似的丁醇代谢通路及产物。通过研究乙醇和丁醇生成途径中关键酶的活性,分析乙醇脱氢酶、丁醇脱氢酶及丁醛脱氢酶的活性变化与产物生成的关系。结果表明,在发酵初期,3种酶的活性均迅速升高并在21 h前达到最大值,丁醇、乙醇浓度也逐渐增加,乙醇脱氢酶在12 h酶活达到最大值0.054 U/mg,丁醛脱氢酶在21 h酶活达到最大值0.035 U/mg,丁醇脱氢酶则在15 h酶活达到最大值0.055 U/mg。24 h后,3种酶活均开始下降,并维持在较低水平,而这段时间内产物浓度仍持续增长直至发酵结束。研究结果深化了对微生物丁醇代谢机理的认识,并为进一步研究芽胞杆菌丁醇代谢途径提供参考。
芽胞杆菌TSH1,丁醇发酵,乙醇脱氢酶,丁醇脱氢酶,丁醛脱氢酶
丁醇是一种极具潜力的新型生物燃料,与乙醇相比较,具有与汽油更为接近的辛烷值和热值。同时,丁醇具有抗爆性能好、不腐蚀管道、安全性高、和汽油的混合比高等优点,可以用于制取酯类、塑料增塑剂,还可用于医药、喷漆以及用作溶剂。在能源和环境问题日益严峻的背景下,由于以上诸多优点,一度兴盛并衰退的生物丁醇产业重新引起了各国研究学者和企业的兴趣。
目前,丙酮丁醇梭菌Clostridium acetobutylicum菌种选育和发酵工艺的改进已经取得较大的进步[1]。但目前大部分丁醇发酵菌株均为严格厌氧型,对仪器设备有很严格的要求。本实验室利用梭菌强化培养基,从玉米粉中筛选出一株产丁醇的芽胞杆菌,该菌株可在微氧条件下,以葡萄糖或淀粉为碳源发酵生成丁醇,代谢过程与丙酮丁醇梭菌的代谢过程基本一致。气相色谱-质谱联用仪 (GC-MS) 分析结果表明,TSH1菌株发酵液中主要产物为丁醇、乙醇和丙酮,此外,还有少量的乙酸和丁酸。将其原生质体进行辐照诱变后,利用梭菌强化培养基筛选出一株丁醇产量较高且遗传性状稳定的兼性厌氧菌株[2]。
为了对芽胞杆菌Bacillussp. TSH1继续进行改进以进一步提高其产量和得率,需要对该菌株丁醇代谢通路中关键酶的种类、活性及其变化有清晰的了解。酶是细胞内生物化学反应的催化剂,其存在与否及活性的高低影响发酵产物的形成和产量[3]。丁醇发酵主要分为产酸期和产溶剂期,在溶剂生成的阶段,丁醛脱氢酶是由丁酰辅酶A转化为丁醛的关键酶,为NADH依赖型。丁醇脱氢酶是由丁醛转化为丁醇的关键酶,为NADPH依赖型。乙醇脱氢酶是由乙酰辅酶A生成乙醛再进而生成乙醇的关键酶[1]。在丙酮丁醇梭菌中,醛脱氢酶和醇脱氢酶并不是单一的酶,而是由多个同工酶组成,这些酶都具有醇脱氢酶活性,共同催化乙醇、丁醇的生成[4-7]。基因组方面的研究表明,共有6个基因编码醇脱氢酶,这些编码产物包括2个具有双功能的醛、醇脱氢酶和4个单一功能的醇脱氢酶[8]。随着分子生物学技术发展,从核酸水平和蛋白水平对单个基因及蛋白的研究更加便利。但是酶是细胞功能的最终执行者,正是这些同工酶的共同作用,决定了乙醇、丁醇的合成速度和效率,而这是单个基因和蛋白表达难以阐释的。因此,研究细胞的整体酶活性水平对于研究丁醇发酵的进程具有重要的意义。
Bacillussp. TSH1与丙酮丁醇梭菌有相同的发酵产物,推测由相似的酶进行催化,因此,本文借鉴丙酮丁醇梭菌的研究,对Bacillussp.TSH1丁醇发酵过程中丁醛、丁醇、乙醇合成的关键酶的活性进行了研究,分析了产丁醇和其他溶剂代谢途径中乙醇脱氢酶,丁醛脱氢酶,丁醇脱氢酶这3种酶在发酵过程中的变化规律,对进一步解析Bacillussp. TSH1丁醇和乙醇合成代谢途径及调控机制奠定了基础,也对该菌株在蛋白水平的表达分析提供了参考。
1 材料与方法
1.1 材料
菌种Bacillus. sp. TSH1为清华大学核能与新能源技术研究院新能源研究所保藏;玉米粉购自北京市昌平区虎峪村;三羟甲基氨基甲烷(Tris)、考马斯亮蓝G250购自北京鼎国生物技术有限责任公司;牛血清蛋白 (BSA)、二硫苏糖醇(DTT)、NADH钠盐、NADPH钠盐、丁酰辅酶A均购自Sigma公司;盐酸氨基脲购自国药集团化学试剂有限公司;丁醛为化学纯;葡萄糖、乙醛,盐酸,磷酸等均为分析纯。
1.2 设备
759S紫外分光光度计为上海菁华科技仪器有限公司生产;电热恒温培养箱为北京中兴伟业仪器有限公司生产的DH-500AB (303-3AB);5 L发酵罐为德国Sartorius的Biostat○RBpuls;气相色谱和液相色谱分别为日本岛津公司的GC 2010和LC 20AD;超声波细胞粉碎机为宁波新芝生物科技股份有限公司的JY 92-Ⅱ;冷冻离心机为Sigma公司的2-16PK和Himac公司的CR22G。
1.3 培养基和缓冲液
P2半合成培养基 (g/L):葡萄糖 36.3,酵母浸粉1.0。
缓冲液配方 (g/L):K2HPO450.0,KH2PO450.0,CH3COONH4220.0,过滤灭菌。
微量元素液配方 (g/L):MgSO4·7H2O 20.0,MnSO4·H2O 1.0,NaCl 1.0,FeSO4·7H2O 1.0,对氨基苯甲酸0.1,维生素B1 0.1,生物素0.001,过滤灭菌。
接种前以1%的比例将缓冲液和微量元素液加入P2半合成培养基中[9-11]。
1.4 方法
1.4.1 菌种培养
菌种活化培养:将1 mL冻存的菌种Bacillussp. TSH1在超净台中接入15 mL 5%的玉米培养基中,电热恒温培养箱中37 ℃静置培养24 h。
摇瓶扩大培养:将充分活化的菌种以体积比7%的接种量接种于200 mL P2培养基中,电热恒温培养箱中37 ℃静置培养24 h。
发酵罐培养:将扩大培养后的菌种接入发酵罐中 (5 L发酵罐装3 L P2半合成培养基),接种量为7%,37 ℃静置发酵,自然pH,从发酵9 h起,每隔3 h取一次样至发酵结束。
1.4.2 样品处理
将样品4 ℃、10 000 r/min离心10 min,弃上清;5 mL 0.1 mol/L Tris-HCl缓冲液 (pH 7.5)清洗,上述条件离心后,重悬于1 mL缓冲液 (含1 mmol/L DTT),于冰浴中进行细胞的循环破碎,超声功率200 W,每次工作30 s,间隔10 s,6次循环。破碎后4 ℃、10 000 r/min离心15 min,上清液即为酶粗提液[12]。蛋白含量的测定采用Bradford 法[13]。
1.4.3 酶活检测
乙醇脱氢酶的反应体系为 1 mL,含50 mmol/L Tris-HCl缓冲液 (pH 7.5),1 mmol/L DTT,0.2 mmol/L NADH,5.1 mmol/L乙醛,测定波长为340 nm[14]。
丁醛脱氢酶的反应体系为 0.87 mL,含67 mmol/L Tris-HCl (pH 6.0),1 mmol/L DTT,0.27 mmol/L NADH,72 mmol/L 盐酸氨基脲,0.2 mmol/L丁酰辅酶A,测定波长为365 nm。
丁醇脱氢酶的反应体系为 0.86 mL,含77 mmol/L Tris-HCl缓冲液 (pH 7.8),0.23 mmol/L NADPH,11 mmol/L丁醛,测定波长为365 nm[15]。
三种反应体系中均含有细胞提取物 (含0.5 mg蛋白质)。30 ℃,每30 s测定一次吸光度的变化,测12 min,测定均在空气中进行。脱氢酶与底物的反应在2 mm光程的石英比色杯中进行,从加入底物开始,测定紫外分光光度计在相应波长下吸收值的变化[16-18]。依据NAD(P)H的摩尔消光系数计算酶的比活。

式中,ΔOD:吸收值每分钟降低的平均值(min−1);V:反应体系的体积 (L);ε:摩尔消光系数;εNADH (365 nm)=1760 L/(mol·cm);εNADPH (365 nm)=1 753 L/(mol·cm);C:测定中所加入酶蛋白的量 (mg);0.2:比色杯的光程(cm);106:摩尔转化为微摩尔的系数。
1.4.4 溶剂产量的测定
溶剂产量的测定以异丁醇为内标物,发酵液12 000 r/min离心5 min,取上清液,按发酵液:异丁醇:H2O=1∶1∶2 (V/V/V) 混合后采用气相色谱仪进样检测。色谱柱为 KB-5MS,25 m×0.53 mm×1.00 μm;检测器 FID;进样温度 240 ℃;检测温度 260 ℃;柱温 80 ℃ (保温 5 min) ~120 ℃(保温3 min);载气为N2,流速2.5 mL/min,进样量1 μL。根据气相色谱保留时间和峰面积信息对溶剂进行定性和定量。根据标准曲线和进样量计算发酵液中溶剂含量[19]。
2 结果与分析
2.1 Bacillus sp. TSH1发酵结果
Bacillussp. TSH1是兼性厌氧的芽胞杆菌,可有氧生长、微氧发酵,这一发现不同于传统的梭状芽胞杆菌必须在严格厌氧条件下的丁醇发酵 (即传统ABE发酵)。由于操作不需要专门的厌氧设备,使操作大大简化,而且节约了设备成本。接种过程在超净台 (有氧环境) 进行,发酵过程在5 L的发酵罐中进行,恒温37 ℃下,监控不同发酵阶段的pH值并间隔取样,测定OD值以及底物和产物的浓度。菌体生长曲线,pH值与底物和产物的浓度变化如图 1所示。在36.33 g/L的初糖浓度下,溶剂在12 h开始产生,同时伴随pH的下降,进入产酸期。24 h后,溶剂产量迅速增加,进入产溶剂期。葡萄糖在33 h全部消耗,同时pH达到最低点,OD达到最大值。发酵在36 h终止,此时,菌种的OD值降低到最大值的一半,丁醇、丙酮和乙醇的比例约为7∶2∶1。丁醇的得率为 19.6%,终产量为7.13 g/L,占ABE总量的70%。该结果与Danie等对C. acetobutylicumATCC 824的研究结果相似[20]。
2.2 乙醇脱氢酶活性变化
乙醇脱氢酶是由乙酰辅酶 A生成乙醛再进而生成乙醇的关键酶。如图2所示,发酵初期的9 h到12 h,菌体内存在的乙醇脱氢酶活性迅速升高,并在12 h时达到最大值0.054 U/mg,乙醇产量没有明显增长。随着发酵时间的进行,在12 h到 24 h,乙醇脱氢酶活性迅速下降到0.01 U/mg,相比最大值丧失了81%的活性。24 h后直到发酵结束时,菌体内乙醇脱氢酶活性维持在 0.006~0.01 U/mg。这段时间内尽管酶活性不高,但乙醇产量迅速增加,在发酵结束时,乙醇产量为1.09 g/L。
2.3 丁醛/醇脱氢酶活性变化
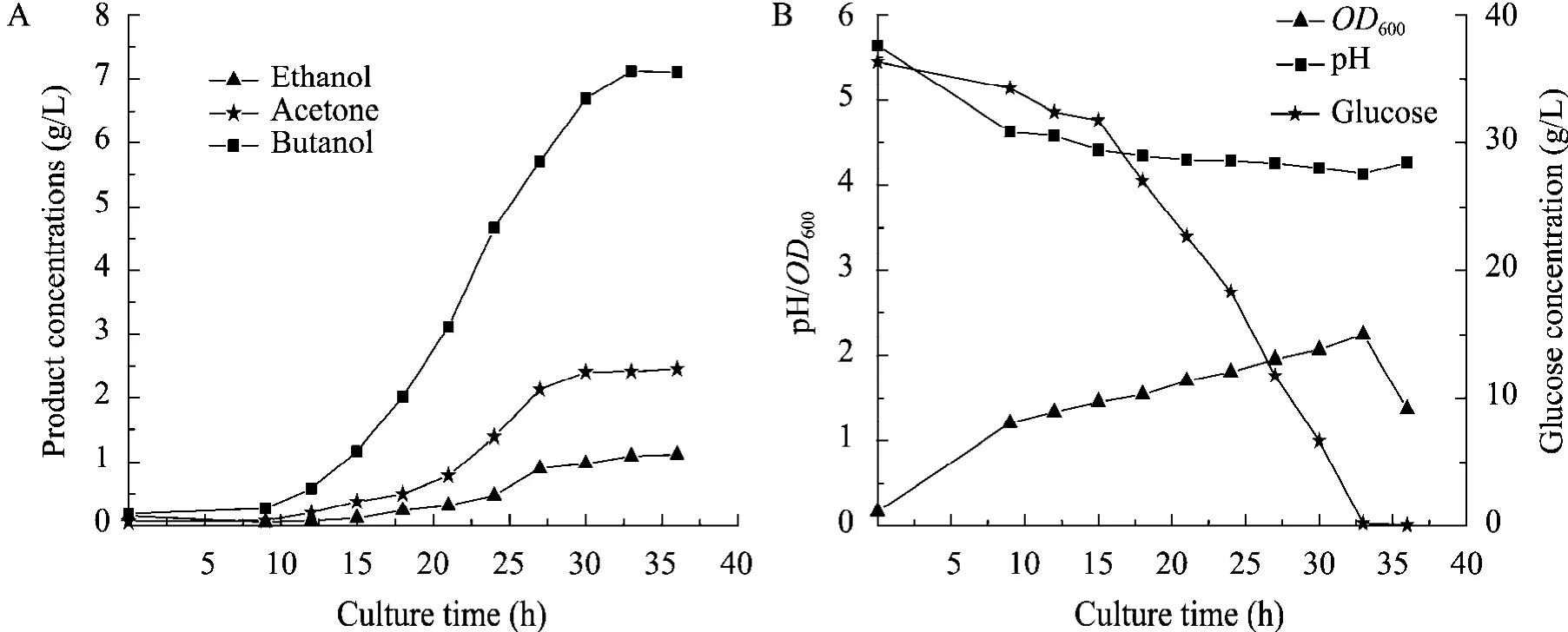
图1 Bacillus sp. TSH1发酵结果 (A:丁醇、丙酮和乙醇的合成;B:细胞生长、葡萄糖消耗和pH的变化)Fig. 1 Fermentation results of Bacillus sp. TSH1. (A) Syntheses of butanol, acetone and ethanol. (B) Variations of OD600, pH and glucose concentration.
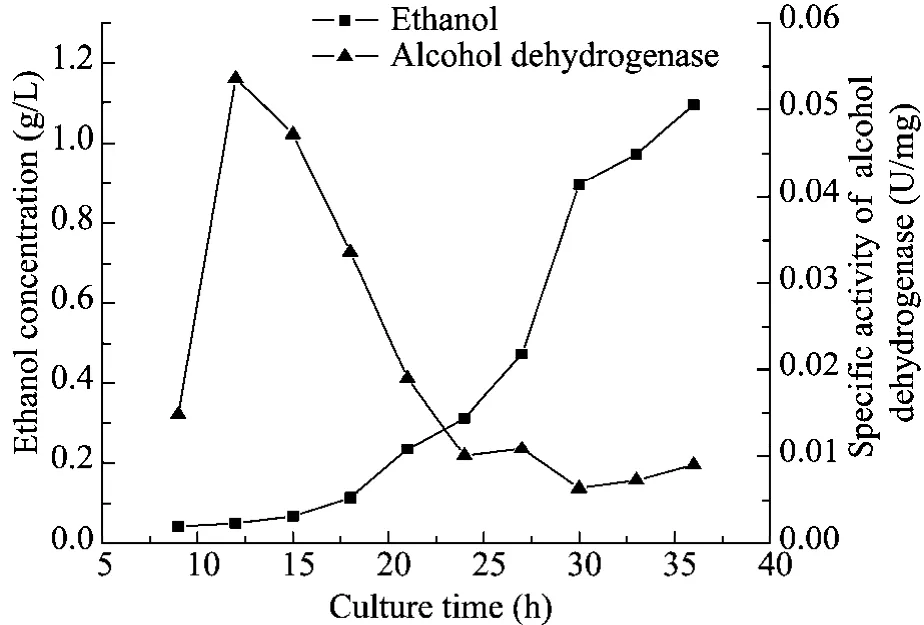
图2 乙醇脱氢酶活性与乙醇产量的变化Fig. 2 Changes about specific activity of alcohol dehydrogenase and concentration of ethanol.
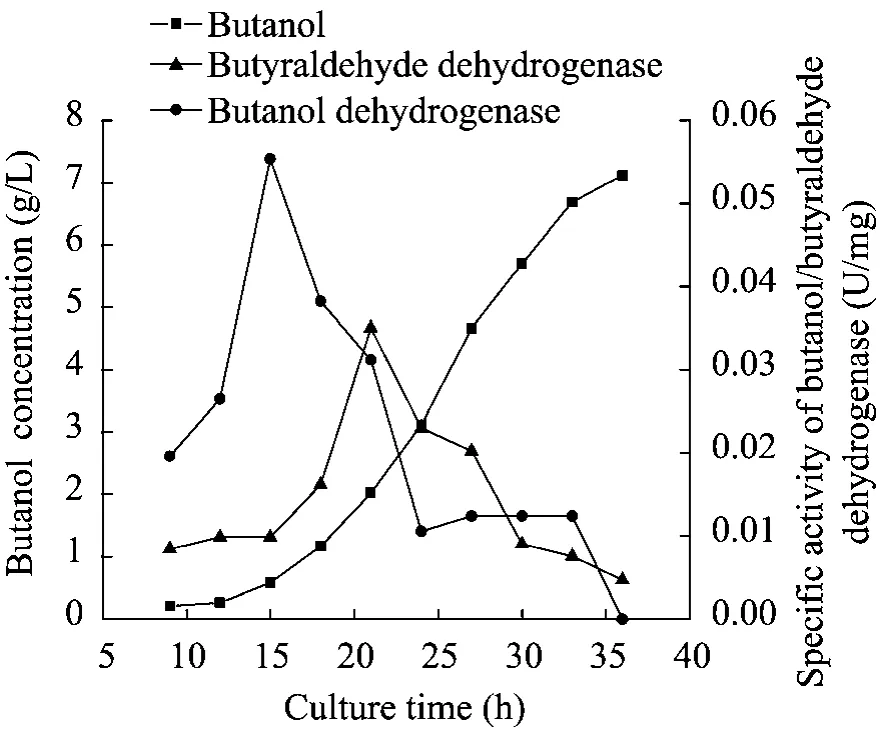
图3 丁醛/丁醇脱氢酶和丁醇产量的关系Fig. 3 Relationships among specific activities of butanol dehydrogenase, butyraldehyde dehydrogenase and butanol concentration.
丁醛脱氢酶是由丁酰辅酶 A转化为丁醛的关键酶,为 NADH依赖型。丁醇脱氢酶是由丁醛转化为丁醇的关键酶,为NADPH依赖型。如图3所示,在发酵的初始阶段,两种酶的酶活均随发酵时间延长逐渐增大,丁醇脱氢酶活性的变化要明显大于丁醛脱氢酶,在发酵进行到 15 h时,丁醛脱氢酶的活性基本没有发生改变,但丁醇脱氢酶的活性已经达到最大值0.055 U/mg,此时,丁醇产率也从发酵初期的缓慢增长变为迅速上升。15 h后,丁醛脱氢酶的活性开始增加并在21 h达到最大值0.035 U/mg,此时丁醇脱氢酶的活性只有最大值的44%,21 h后,两种酶的活性均逐渐迅速下降且在发酵结束时基本失活。这段时间内,尽管丁醇的产量在增加,但是产率逐渐减慢,发酵终止时丁醇的产量为7.13 g/L。Peter Diirre等对C. acetobutylicumDSM 1732进行了研究,丁醛脱氢酶的活性在丁醇产量开始增加时达到最大值,而丁醛脱氢酶则在发酵完全进入产溶剂期后才达到最大值[12]。
3 讨论
国内外一些学者从不同的产丁醇菌株出发对其进行改造后,丁醇产量或得率等有所提高[21],但均为严格厌氧菌,对设备要求严格。王风芹等从种植怀地黄的土壤中通过富集培养和分离纯化等得到一株产丁醇的兼性厌氧菌Bacillussp.C2,以 7%玉米醪液为原料,丁醇产量可达11.2 g/L[22]。本实验室自行分离得到的Bacillussp.TSH1以 5%玉米醪液为原料,丁醇产量可达11.39 g/L。不同的丁醇发酵菌株的特性对比如表1所示。
Qureshi等曾对C. beijerinckiiBA 101发酵生产丁醇的经济性进行评估。当每吨玉米的价格为79.23美元时,在ABE生产能力为153 000 t的工厂中,生产设备成本和总成本分别为 33.47×106和110.46×106美元。当ABE得率为0.42 (gABE/g葡萄糖) 时,丁醇的价格预计为0.34美元/kg[27]。
筛选得到的TSH1菌株是兼性厌氧菌,对形态学、生理生化特性研究及16S rRNA测序,表明该菌株为芽胞杆菌。Bacillussp. TSH1与丙酮丁醇梭菌 ATCC824等严格厌氧菌的发酵过程和代谢产物类似,故推测溶剂产生也由类似的关键酶催化完成。从本研究结果可以看出,Bacillussp.TSH1具有乙醇脱氢酶、丁醛脱氢酶以及丁醇脱氢酶,可以实现由乙醛到乙醇,以及丁酰辅酶A到丁醛再到丁醇的转化,从而证明了该菌株产溶剂代谢途径的存在,在菌株Bacillussp. TSH1的发酵工艺已经得到优化且代谢通路已经明确的情况下,分析这3种酶在发酵过程中的酶活变化规律,对进一步解析Bacillussp. TSH1丁醇和乙醇合成代谢途径及调控机制奠定了基础,也对Bacillussp. TSH1在蛋白水平的表达分析提供了参考。

表1 不同丁醇发酵菌株的对比Table 1 Comparisons of different butanol-forming strains
本文检测乙醇脱氢酶所用辅酶为NADH,在乙醇刚开始生成时,比活即达到最高,相对9 h增加了2.6倍。丁醛脱氢酶所用辅酶也是NADH,在发酵进行到产溶剂期后比活达到最大值,相比9 h增加了 3.16倍,而丁醇脱氢酶辅酶则使用NADPH,在产酸期比活就已经达到最大值,较其他两种酶而言增加最少,相对9 h增加了1.82倍。其他研究者对不同菌种的丁醛脱氢酶和丁醇脱氢酶也做过检测,分别使用不同的细胞破碎方法,离心条件以及不同的底物和辅酶进行反应[12]。具体结果比较如表2所示。
从Bacillussp. TSH1与其他菌株脱氢酶活的比较结果可以看出,在底物及辅酶类型相同时,Bacillussp. TSH1中丁醇脱氢酶及丁醛脱氢酶的最大酶活结果与其他菌株相似,与预期结果一致,即尽管菌株对氧的耐受性不同,相同的反应由相似的酶进行催化。
从Bacillussp. TSH1中脱氢酶的比活与溶剂产生的关系上看,3种酶在发酵开始即迅速升高,但是溶剂在缓慢生成。在酶活下降之后,溶剂的产量仍在增加,这是因为检测的酶活性是瞬时的,而乙醇产量是累积的,因此即使在后期酶活较低的情况下,产物的浓度也在不断升高。另外,本文所检测的为酶的比活力,而从OD值可以看出 (图1B),在发酵开始至结束之前的33 h,OD值一直在持续升高,表明发酵液中细胞浓度在不断增大,因而,发酵后期单位体积的蛋白浓度也较高,单位发酵液中总的酶活性可能保持恒定水平。所以,在发酵后期,总体的酶活水平仍可以维持溶剂产量的持续增长。
另外,由于丁醇对细胞的毒性,当发酵液中丁醇的质量浓度增大到11 g/L时,细胞因受到丁醇的抑制而不能生长[33],因此,高丁醇耐受性菌种的选育以及诱变菌株的丁醇代谢途径中关键酶的测定也是该课题未来进行研究的重要
内容[34-35]。
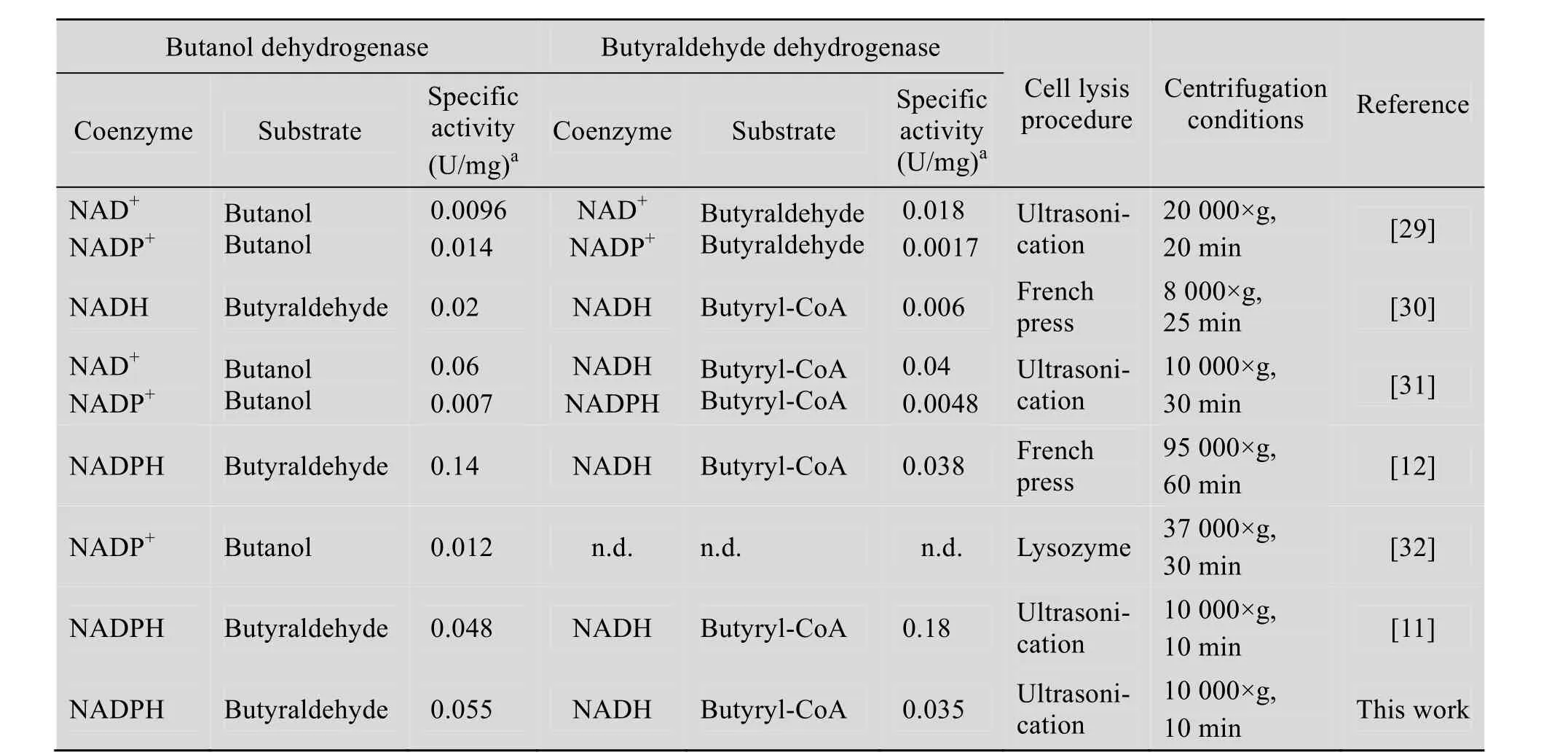
表2 不同文献报道的丁醛脱氢酶和丁醇脱氢酶的比活及测定条件比较Table 2 Comparisons of specific activity and measurement conditions of butanol dehydrogenase and butyraldehyde dehydrogenase as reported in the literatures
[1]Jin XQ, Wang GL, He BF, et al. Research progress and high yield strategy of acetone-butanol fermentation. Chem Ind Eng Prog, 2007, 26(12):1727−1732 (in Chinese).
靳孝庆, 王桂兰, 何冰芳, 等. 丙酮丁醇发酵的研究进展及其高产策略. 化工进展, 2007, 26(12):1727−1732.
[2]Liu Y, Liu HJ, Zhang JA, et al. Mutation ofCl.beijerinckiiprotoplasts by60Co-γ irradiation. J Chem Eng, 2009, 10(60): 2549−2554 (in Chinese).
刘娅, 刘宏娟, 张建安, 等.60Co-γ对Cl.beijerinckii原生质体的辐照诱变. 化工学报,2009, 10(60): 2549-2554.
[3]Gao XF , Zhao H , Zhang GH, et al. Genome shuffling ofClostridium acetobutylicumCICC 8012 for improved production of acetone-butanol-ethanol (ABE). Curr Microbiol,2012, 65(2): 128−132.
[4]Walter KA, Bennett GN, Papoutsakis ET.Molecular characterization of twoClostridium acetobutylicumATCC 824 butanol dehydrogenase isozyme genes. J Bacteriol, 1992, 174(22):7149−7158.
[5]Petersen DJ, Welch RW, Rudolph FB, et al.Molecular cloning of an alcohol (butanol)dehydrogenase gene cluster fromClostridium acetobutylicumATCC 824. J Bacteriol, 1991,173(5): 1831−1834.
[6]Welch RW, Rudolph FB, Papoutsakis ET.Purification and characterization of the NADH-dependent butanol dehydrogenase fromClostridium acetobutylicum(ATCC 824). Arch Biochem Biophys, 1989, 273(2): 309−318.
[7]Fontaine L, Meynial SI, Girbal L, et al. Molecular characterization and transcriptional analysis of adhE2, the gene encoding the NADH-dependent aldehyde/alcohol dehydrogenase responsible for butanol production in alcohologenic cultures ofClostridium acetobutylicumATCC 824. J Bacteriol, 2002, 184(3): 821−830.
[8]Nölling J, Breton G, Omelchenko MV, et al.Genome sequence and comparative analysis of the solvent-producing bacteriumClostridium acetobutylicum. J Bacteriol, 2001, 183(16):4823−4838.
[9]Lee J, Blaschek HP. Glucose uptake inClostridium beijerinckiiNCIMB 8052 and the solvent-hyper producing mutant BA101. Appl Environ Microbiol,2001, 11: 5025–5031.
[10]Chen CK, Blaschek HP. Examination of physiological and molecular factors involved in enhanced solvent production byClostridium beijerinckiiBA101. Appl Environ Microbiol, 1999,5: 2269−2271.
[11]Thaddeus E, Qureshi N, Blaschek HP. Production of acetone-butanol-ethanol(ABE) in a continuous flow bioreactor using degermed corn andClostridium beijerinckii.Process Biochem, 2007,42(1): 34-39.
[12]Diirre P, Kuhn A, Gottwald M. Enzymatic investigations on butanol dehydrogenase and butyraldehyde dehydrogenase in extracts ofClostridium acetobutylicum.Appl Microbiol Biotechnol, 1987, 26: 268−272.
[13]Wang XP, Xing SL. Determination of protein quantitation using the method of coomassie brilliant blue. Tianjin Chem Ind, 2009, 23(3):40−41 (in Chinese).
王孝平, 邢树礼. 考马斯亮蓝法测定蛋白含量的研究. 天津化工, 2009, 23(3): 40−41.
[14]Stephen FH, Zhu CX. Butanol-ethanol dehydrogenase and butanol-ethanol-isopropanol dehydrogenase: different alcohol dehydrogenases in two strains ofClostridium beijerinckii(Clostridium butylicum). Appl Environ Microbiol, 1987, 53(4):697−703.
[15]Diirre P, Kuhn A, Gottschalk G. Treatment with allyl alcohol selects specifically for mutants ofClostridium acetobutylicumdefective in butanol synthesis. FEMS Microbiol Lett, 1986, 36: 77−81.
[16]Yao WB. Introduction of Biotechnology Pharmaceutical. Beijing: China Medical Science Press, 2003, 125−127 (in Chinese).
姚文兵. 生物技术制药概论. 北京: 中国医药科技出版社, 2003, 125−127.
[17]Girbal L, Soucaille P. Regulation of solvent production inClostridium acetobutylicum. Trends Biotechnol, 1998, 16 (1): 11−16.
[18]Yan RT, Zhu CX, Golemboski C. Expressing solvent-forming enzymes and onset of solvent production in batch cultures ofClostridium beijerinkii(Clostridium butylicum). Appl Environ Microbiol, 1988, 54: 642−648.
[19]Parekh M, Formanek J, Blaschek HP. Development of a cost-effective glucose-corn steep medium for production of butanol byClostridium beijerinckii. J Ind Microbiol Biotechnol, 1998, 21: 187–191.
[20]Petersen DJ, Bennett GN. Enzymatic characterization of a nonmotile, nonsolventogenicClostridium acetobutylicumATCC 824 mutant.Curr microbiol, 1991, 23(11): 253−258.
[21]Annous BA, Blaschek HP. Isolation and characterization ofClostridium acetobutylicummutants with enhanced amylolytic activity. Appl Environ Microbiol, 1991, 57(9): 2544−2548.
[22]Wang FQ, Xie H, Chu LR, et al. Screening and identification of aBacillusstrain producing butanol. Microbiol China, 2010, 37(1): 7−11 (in Chinese).
王风芹, 谢慧, 楚乐然, 等. 产丁醇芽孢杆菌的分离,筛选与鉴定. 微生物学通报, 2010, 37(1):7−11.
[23]Lin YL, Blaschek HP. Butanol production by a butanol-tolerant strain ofClostridium acetobutylicumin extruded corn broth. Appl Environ Microbiol, 1983, 3(3): 966-973.
[24]Lee J, Jang YS, Choi SJ, et al. Metabolic engineering ofClostridium acetobutylicumATCC 824 for Isopropanol-Butanol-Ethanol fermentation.Appl Environ Microbiol, 2012, 78(5): 1416−1423.
[25]Gu Y, Hu SY, Chen J, et al. Ammonium acetate enhances solvent production byClostridiumacetobutylicumEA 2018 using cassava as a fermentation medium. J Ind Microbiol Biotechnol,2009(36): 1225–1232.
[26]Jiang Y, Xu C, Dong F, et al. Disruption of the acetoacetate decarboxylase gene in solvent-producingClostridium acetobutylicumincreases the butanol ratio. Metab Eng, 2009,11(4/5): 284-191.
[27]Qureshi N, Blaschek HP. ABE production from corn: a recent economic evaluation. J Ind Microbiol Biotechnol, 2001, 27: 292–297.
[28]Chen CK, Blaschek HP. Acetate enhances solvent production and prevents degeneration inClostridium beijerinckiiBA101. Appl Microbiol Biotechnol, 1999, 52(2): 170−173.
[29]Petitdemange H, Cherrier C, Bengone JM, et al.Study of the NADH and NADPH-ferredoxin oxidoreductase activities inClostridium acetobutylicum. Can J Microbiol, 1977, 23(2):152−160.
[30]Gerckens B. Studies on the growth and solvent production ofClostridium acetobutylicum[D].Germany: University of Gottingen, 1980.
[31]Andersch W, Bahl H, Gottschalk G. Level of enzymes involved in acetate, butyrate, acetone and butanol formation byClostridium acetobutylicum.Appl Microbiol Biotechnol, 1983, 18: 327−332.
[32]George HA, Chen JS. Acidic conditions are not obligatory for onset of butanol formation byClostridium beijerinckii(Synonym,C. butylicum).Appl Environ Microbiol, 1983, 46(2): 321−327.
[33]Linden JC, Moreira AR, Lenz TG. Comprehensive Biotechnology. Oxford: Pergamon Press, 1985.
[34]Zhou X, Traxler RW. Enhanced butanol production and reduced autolysin activity after chloramphenicol treatment ofClostridium acetobutylicumATCC 824. Appl Microbiol Biotechnol, 1992, 37(3): 293−297.
[35]Westhuizen A, Jones DT, Woods DR. Autolytic activity and butanol tolerance ofClostridium acetobutylicum. Appl Environ Microbiol, 1982, 44:1277−1281.
September 25, 2012; Accepted: March 11, 2013
Jian’an Zhang. Tel/Fax: +86-10-89796086; E-mail: zhangja@tsinghua.edu.cn
国家自然科学基金 (No. 21176141),清华大学自主科研计划 (No. 2012THZ02289) 资助。
Key enzymes in butanol fermentation by a facultative anaerobeBacillussp. TSH1
Xiaorui Duan1,2, Genyu Wang2, Hongjuan Liu2, Jianwei Xue1, and Jian’an Zhang2
1Institute of Fine Chemical,Taiyuan University of Technology,Taiyuan030024,Shanxi,China
2Institute of Nuclear and New Energy Technology,Tsinghua University,Beijing100084,China
Bacillussp. TSH1 is a butanol-producing microorganism newly isolated in our laboratory; it can grow and ferment under facultative anaerobic conditions, while sharing similar fermentation pathways and products withClostridium acetobutylicum.To illustrate the relationships between the products and the enzyme activities inBacillussp. TSH1, key butanol- and ethanol-forming enzymes were studied, including butyraldehyde dehydrogenase, butanol dehydrogenase and alcohol dehydrogenase. The activities of the three enzymes increased rapidly after the initiation of fermentation. Activities of three enzymes peaked before 21 h, and simultaneously, product concentrations also began to increase gradually. The maximum activity of alcohol dehydrogenase was 0.054 U/mg at 12 h, butyraldehyde dehydrogenase 0.035 U/mg at 21 h and butanol dehydrogenase 0.055 U/mg at 15 h. The enzyme activities then decreased, but remained constant at a low level after 24 h, while the concentrations of butanol, acetone, and ethanol continued increasing until the end of the fermentation. The results will attribute to the understanding of the butanol metabolic mechanism, and provide a reference for further study of a facultativeBacillusmetabolic pathway.
Bacillussp. TSH1, butanol fermentation, alcohol dehydrogenase, butanol dehydrogenase, butyraldehyde dehydrogenase
Supported by: National Natural Science Foundation of China (No. 21176141), Tsinghua University Initiative Scientific Research Program (No.2012THZ02289).
(本文责编 郝丽芳)
