家蝇蛹甘露糖结合凝集素的结构及免疫调节作用
2013-09-03王春玲夏焱张士娇王利蕊曹小红
王春玲,夏焱,张士娇,王利蕊,曹小红
天津科技大学食品工程与生物技术学院 教育部食品营养与安全重点实验室,天津 300457
家蝇蛹甘露糖结合凝集素的结构及免疫调节作用
王春玲,夏焱,张士娇,王利蕊,曹小红
天津科技大学食品工程与生物技术学院 教育部食品营养与安全重点实验室,天津 300457
王春玲, 夏焱, 张士娇, 等. 家蝇蛹甘露糖结合凝集素的结构及免疫调节作用. 生物工程学报, 2013, 29(5): 601−611.
Wang CL, Xia Y, Zhang SJ, et al. Structure and immunomodulation activity of a novel mannose binding lectin from housefly pupae. Chin J Biotech, 2013, 29(5): 601−611.
分析了一种分子量为24 kDa,具有免疫活性的新型家蝇蛹甘露糖结合凝集素 (MBL-1) 的结构,为深入研究其结构与功能之间的关系提供依据。首先通过凝胶电泳及Schiff’s染色确定此新型家蝇蛹凝集素具有糖链结构。通过β-消除反应、红外光谱、原子力显微镜和蛋白N端测序仪对其结构进行分析。结果表明MBL-1是一种存在N-糖苷键,蛋白含量为97.20%、糖含量为2.55%,直径60~100 nm的椭球状蛋白单体,肽链N-端封闭。MTT实验证明 MBL-1可以明显促进巨噬细胞的增殖且具有浓度依赖性,扫描电镜观察结果表明,MBL-1作用后的巨噬细胞形态呈现活化状态。可见,分离纯化出的MBL-1是一种具有明显的免疫调节活性的新型凝集素,为开发天然免疫增强剂和进一步分析其结构及其作用机制提供了参考。
家蝇蛹,凝集素,结构分析,免疫调节
昆虫没有完善统一的免疫体系,缺乏B和T淋巴细胞,但许多昆虫的抗菌力却很强。最典型的例子是家蝇,从幼虫到成虫出没于杂菌横生的环境,却不受病原菌的侵袭,其独特的免疫防御机制已成为国内外研究的热点[1-4]。
凝集素是一类糖结合蛋白,在家蝇的免疫防御系统中起着重要作用[5-8]。由于家蝇个体较小等原因,导致对其研究大多还停留在免疫应答的诱导、粗提物的理化生物学性质等阶段[9-11]。因此对家蝇凝集素进行系统的分离纯化、结构分析显得尤为重要。本文从家蝇蛹体内分离纯化出一种具有明显免疫调节活性的新型甘露糖结合凝集素,并对其结构和免疫调节活性进行了研究,为进一步研究其构效关系和揭示家蝇的抗病机理提供了一定的理论依据。
1 材料与方法
1.1 材料和仪器
家蝇来自天津市卫生疾病防治中心;高速冷冻离心机 (Eppendorf);凝胶成像仪 (Bio-Rad);酶联检测仪 (FL340);红外光谱 (德国布鲁克);原子力显微镜 (JEOL);蛋白测序仪 (AB I491A);SU1510扫描电镜 (日本日立);CO2培养箱 (Thermo)。
1.2 试剂
考马斯亮蓝 R 2250 (USB);希夫试剂Schiff’s Reagent (Sigma);MTT (Sigma);单糖标准品 (Genview);其他试剂均为国产分析纯。
1.3 家蝇蛹凝集素的分离纯化
参照本实验室前期研究方法[12]粗提家蝇蛹血淋巴,通过Con A-Sepharose 4B亲和层析,在亲和层析中,先用结合缓冲液以1 mL/min的流速冲洗,直至基线水平为零。将洗脱液换成0.2 mol/L的 D-甘露糖溶液,对凝集素进行解吸附。收集Con A-Sepharose 4B亲和层析后的甘露糖洗脱峰,利用DEAE弱阴离子交换层析进行进一步分离纯化,梯度洗脱条件依次为:0.005 mol/L,0.01 mol/L,0.02 mol/L NaCl溶液为梯度洗脱液,每梯度洗脱时间为30 min。利用MTT实验检测分离各组分的免疫调节活性。
1.4 SDS-PAGE电泳
取适量家蝇蛹凝集素加入上样缓冲液,煮沸5 min,8 000 r/min 离心 5 min,备用。参照SDS-PAGE电泳步骤,采用12%分离胶,5%浓缩胶,蛋白质标准样与样品在80 V,2 h条件下电泳。凝胶分别用考马斯亮蓝R 2250和periodic acid-schiff’s (PAS) 染色,糖蛋白染色参考相关文献方法[13]。
1.5 家蝇蛹凝集素蛋白和糖含量测定
采用考马斯亮蓝G 2250法,以牛血清白蛋白 (BSA) 为标准蛋白。经考马斯亮蓝工作液处理后,检测595 nm的吸光值,绘制OD595标准蛋白浓度曲线。取1 mg样品经考马斯亮蓝工作液同样处理后,测定595 nm处的吸光值,并在标准曲线上找出对应的蛋白质浓度,计算待测样品的浓度,得出蛋白的含量。
采用苯酚-硫酸法[14]对家蝇蛹凝集素中糖含量进行测定。
1.6 家蝇蛹凝集素的β-消除反应
2 mg家蝇蛹凝集素溶于 2 mL 0.2 mol/L NaOH溶液中,于45 ℃下保温30 min。通过全波长扫描测定碱处理前后紫外吸收光谱的变化[15]。
1.7 家蝇蛹凝集素的红外光谱检测
称取1 mg样品,加入150 mg干燥的KBr粉末,在红外灯下于玛瑙研钵中充分研磨均匀,装入压片模具中,用油压机在抽真空状态下以27 MPa的压力压制2 min,然后用镊子小心取下厚度约1 mm的压片,装入样品架;将样品架置于样品窗口,进行红外扫描测定。
1.8 原子力显微镜 (Atomic force microscope,AFM) 扫描分析家蝇蛹凝集素
取云母片,剪成适宜大小,撕去云母片表层直至出现光亮平整的表面。用超纯水配制浓度为50 μg/mL的凝集素溶液,滴加至云母片表面,于干燥器中室温晾干。原子力显微镜下观察,选择轻敲模式并记录结果。
1.9 家蝇蛹凝集素的蛋白N-端测序
10 μg的家蝇蛹凝集素样品经过SDS-PAGE后显示为一条较清晰的条带,经过染色、转膜等预处理经蛋白质测序仪测定 N-末端氨基酸的序列,采用 Edman降解法[16],在 ABI PROCISETM494cLC蛋白测序仪中完成序列测定。本过程由中国科学院上海蛋白质组研究分析中心完成。
1.10 家蝇蛹凝集素的基质辅助激光解吸电离飞行时间质谱 (MALDI-TOF-MS)
电泳后的胶条用胰蛋白酶进行水解,取0.75 μL与基质 (现配现用的 10 mg/mL的 α-氰基-4-羟基肉桂酸) 等体积混合,将其点在靶上,室温干燥。将靶装入质谱仪中进行检测。本过程由上海基康生物技术有限公司完成。
1.11 MBL-1对巨噬细胞增殖及吞噬活性的影响
取96孔板,每孔中加入100 μL的5×105个/mL巨噬细胞悬液。5%CO2、37 ℃培养贴壁4 h,弃上清,每孔加入不同浓度的MBL-1,每孔终体积为200 μL,MBL-1的终浓度分别为0、5、10、20、40、80 μg/mL,每一浓度6个复孔。并设空白对照组及阳性对照组,阳性对照组加入终浓度为5 μg/mL的脂多糖 (LPS) 。置于5%CO2、37 ℃培养48 h。培养结束后,每孔加入20 μL 5 mg/mL的MTT溶液,于5%CO2、37 ℃继续培养4~6 h。结束后,弃去上清,每孔加入150 μL二甲基亚砜 (DMSO),振荡10 min,结晶物完全溶解后,测定OD570。
不同浓度的MBL-1处理细胞培养48 h后,弃上清后每孔加入过膜后的100 μL 0.1%中性红生理盐水溶液,继续培养4 h,倾去上清,室温PBS洗涤3遍。然后每孔加入200 μL细胞裂解液 (体积分数为 50%的乙酸和体积分数为 50%的无水乙醇)。室温静置1 h,待细胞溶解后检测OD540。
1.12 MBL-1作用巨噬细胞后的扫描电镜分析
将无菌处理后的盖玻片平放于6孔细胞培养板中,加入细胞密度为 1×105/mL的鼠腹腔巨噬细胞,贴壁后加入MBL-1,给药浓度为40 μg/mL,培养48 h后取出盖玻片,PBS洗涤2次,用2.5%的戊二醛于4 ℃固定1 h,PBS洗涤3次,1%锇酸固定1 h,逐级酒精脱水,叔丁醇干燥,离子喷镀仪喷金后进行扫描电镜观察[17]。
2 结果
2.1 家蝇蛹凝集素的分离纯化
家蝇蛹经研磨,浸提后进行亲和层析,由于D-甘露糖溶液与Con A-Sepharose 4B上结合的凝集素竞争性洗脱,且 D-甘露糖与凝集素结合能力大于Con A-Sepharose 4B,亲和组分被洗脱下来。大约在100~108 min时出现洗脱峰,收集洗脱峰,利用10 kDa的滤膜进行超滤处理并低温冷冻干燥得家蝇蛹凝集素粗品。
通过 SDS-PAGE电泳及高效液相色谱法结果显示Con A-Sepharose 4B亲和层析后的家蝇蛹凝集素粗品成分并不单一,因此通过DEAE弱阴离子层析进行进一步分离纯化。分离结果如图2所示,收集 3个洗脱峰分别命名为 MBL-1、MBL-2、MBL-3,以10 kDa超滤膜进行脱盐后,低温冷冻干燥。
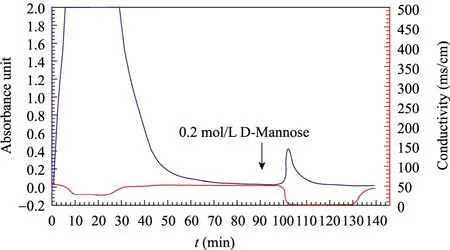
图1 家蝇蛹提取液的Con A-Sepharose 4B亲和层析图Fig. 1 Affinity chromatography of crude extract of Musca domestica pupae on Con A-Sepharose 4B.

图2 家蝇蛹凝集素分离纯化的DEAE-离子交换图Fig. 2 Anion exchange chromatography of Musca domestica pupae lectin on DEAE-Sepharose.
为进一步确定研究组分,通过 MTT检测MBL-1、MBL-2、MBL-3三个组分的活性,结果显示 MBL-1的免疫调节活性较其他两个组分要高,因此选择MBL-1来进行进一步的研究分析。
2.2 MBL-1的电泳分析
MBL-1的 SDS-PAGE电泳检测结果如图 3所示,为单一蛋白条带,说明 MBL-1不含有亚基结构,MBL-1表观分子质量约为24 kDa。
目前分离到的大多数凝集素都带有糖链,为验证 MBL-1是否含有糖类成分,对其进行了希夫试剂糖染色实验。如图4所示,电泳后凝胶经过希夫试剂染色后,可看到有明显的红色,说明MBL-1含有糖链,是一种糖蛋白。
2.3 MBL-1的蛋白含量和含糖量测定
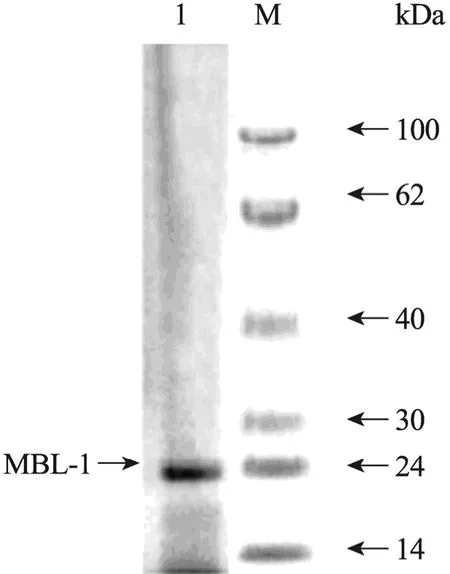
图3 MBL-1的SDS-PAGE电泳图Fig. 3 SDS-PAGE electrophoresis of MBL-1. 1:sample in the presence of β-mercaptoethanol; M: protein marker.

图4 MBL-1 Native-PAGE电泳图Fig. 4 Native-PAGE electrophoresis of MBL-1. 1:sample stained by CR-250; 2: sample stained by periodic acid-shiff’s reagent.
通过考马斯亮蓝蛋白测定试剂盒于分光光度计测得空白管OD值为0.258,标准管OD值为0.364,测定管OD值为0.441,计算得出MBL-1蛋白含量为97.20%。
通过苯酚-硫酸法测定MBL-1的含糖量,样品所测得的吸光度为 0.224,样品浓度为4 mg/mL,依据标准曲线可以算出MBL-1糖含量为2.55%。
2.4 MBL-1的β-消除反应
形成 O-糖苷键的苏氨酸和丝氨酸上的糖链经稀碱处理后很容易解离,且解离后的苏氨酸和丝氨酸形成α-氨基丁烯酸和α-氨基丙烯酸,这两种氨基酸衍生物在240 nm均存在特征吸收。没有和糖链相连的苏氨酸和丝氨酸在经过稀碱处理后则不会形成这两种氨基酸衍生物,在240 nm处就不会产生特征吸收。而 N-糖苷键不会被稀碱从蛋白上解离,因此通过检测稀碱处理后的蛋白质部分是否含糖,可间接判断有无 N-糖若键的存在[18-19]。结果如图5所示,与碱处理前相比处理后的 MBL-1的光密度值整体因糖的水解而增加,但在240 nm处并没有突然明显的增大趋势,即未出现羟基不饱和氨基酸的特征吸收,因而可推断MBL-1中不含O-糖苷键,经β-消除反应后的凝集素通过苯酚硫酸法检测含有糖成分,推断MBL-1中糖肽的结合方式为N-糖苷键。
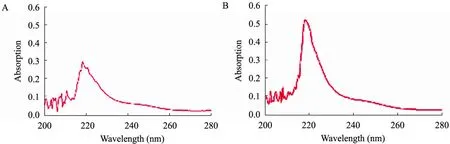
图5 NaOH处理前后MBL-1的紫外吸收状况Fig. 5 UV absorption of MBL-1 before and after treated with NaOH. (A) Before being treated with NaOH. (B) After being treated with NaOH.
2.5 MBL-1的红外光谱测定
红外光谱测定结果见图6,参考文献[20-21]对其进行分析,3 298 cm-1附近的一个较宽的吸收峰为O-H的伸缩振动吸收峰,且存在着分子间氢键;2 962 cm−1附近的一组峰为C-H键的特征吸收;1 656 cm−1处较强的吸收峰及1 400 cm−1到1 200 cm−1间一些较弱的吸收是多糖的特征吸收;1 398 cm−1附近的一些峰是C-H的变角振动;1 656 cm−1处较强的吸收峰及1 539 cm−1处较弱的吸收峰为蛋白质的特征吸收,1 600~1 700 cm−1处吸收峰为酰胺Ⅰ谱带,通过 Peakfit软件分析其结构主要为β-折叠。
2.6 MBL-1的原子力显微镜扫描分析
与红外光谱、核磁共振、色质联用、X射线衍射等现代测试技术相比,原子力显微镜可得到上述方法无法获得的生物大分子表面形态学直观信息。原子力显微镜扫描结果如图 7所示,MBL-1为椭球状蛋白单体,其蛋白直径约在60~100 nm之间,可能由于糖链较短,图上并不能看到明显的糖链结构。
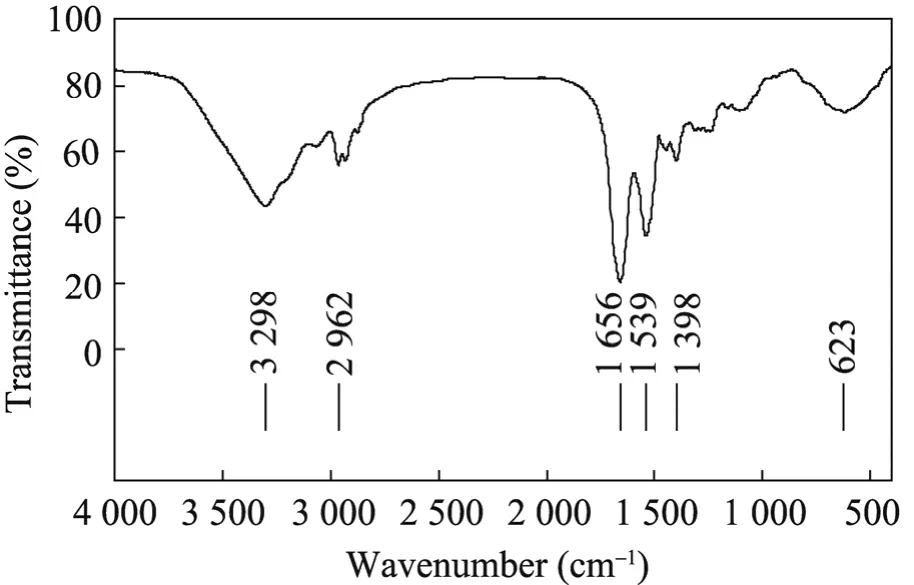
图6 MBL-1的红外光谱分析Fig. 6 IR analysis of MBL-1 sample.

图7 MBL-1的原子力显微镜分析Fig. 7 AFM analysis of MBL-1.
2.7 MBL-1蛋白N-端测序
蛋白质测序仪测得MBL-1的结果如图8所示,其中图8B为标准的PTH氨基酸色谱图,标明了 20种标准氨基酸的保留时间,图 8A是MBL-1的PTH氨基酸色谱图,但图中并没有出现任何的信号峰,因此,推测MBL-1肽链N-端封闭。
2.8 MBL-1的MALDI-TOF-MS检测
由图9和表1可知,MBL-1的肽段序列与来源为家蝇的谷胱甘肽硫转移酶1 (GST-θ) 具有较高的相似性。其分子量为24 kDa,蛋白等电点为7.63。谷胱甘肽转硫酶是一组多功能同工酶,广泛分布于哺乳动物、植物、鸟类、昆虫、寄生虫及微生物体内,其主要功能是催化某些内源性或外来有害物质的亲电子基团与还原型谷胱甘肽的巯基进行偶联,通过增加其疏水性使其易于穿越细胞膜。

图8 MBL-1肽链N-末端测定色谱图Fig. 8 Chromatograms of MBL-1 peptide chain N-terminal. 1: a chromatogram of sample PTH amino acid; 2: a chromatogram of standard PTH amino acid.

图9 MBL-1的肽指纹图谱分析Fig. 9 PMF analysis of MBL-1.
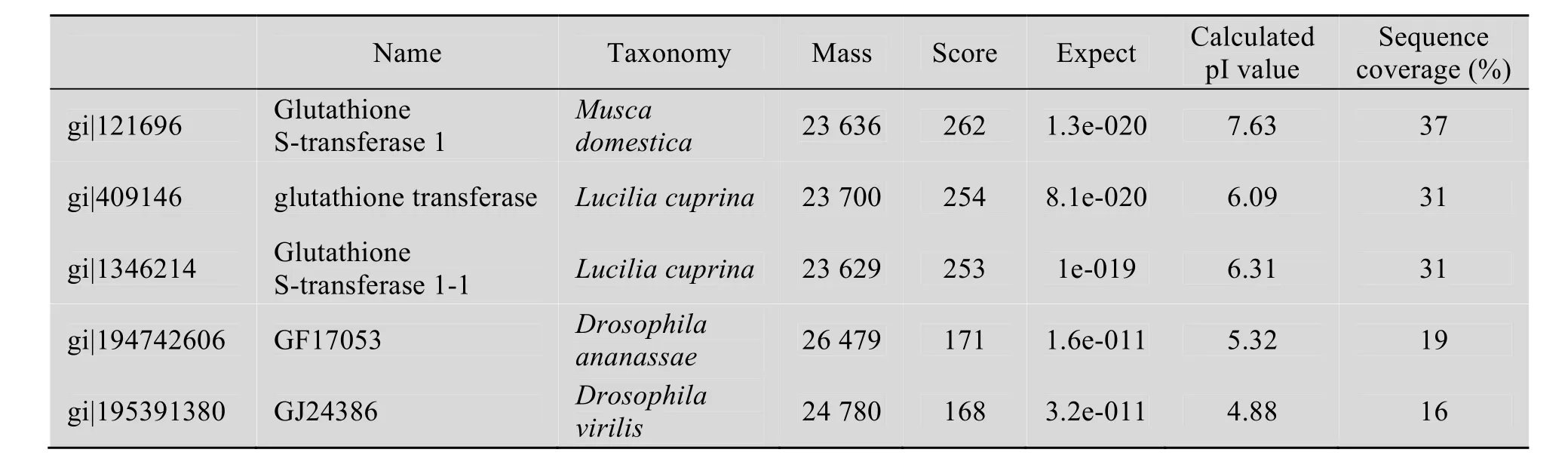
表1 肽段匹配表Table 1 Match of peptide sequences from MBL-1
2.9 MBL-1对巨噬细胞增殖及吞噬活性的影响
通过MTT法检测MBL-1对小鼠腹腔巨噬细胞增殖活性的影响 (图10),不同浓度的MBL-1作用于鼠腹腔巨噬细胞,作用48 h,随着MBL-1浓度的增加,细胞增殖活性不断增强,说明在一定范围内,鼠腹腔巨噬细胞的增殖活性与MBL-1的剂量浓度呈依赖关系。且与空白对照组相比,MBL-1在浓度为 5 μg/mL时对巨噬细胞的增殖即有极显著的作用。由于80 μg/mL与40 μg/mL时作用效果相差不大,选择40 μg/mL为最佳作用浓度。
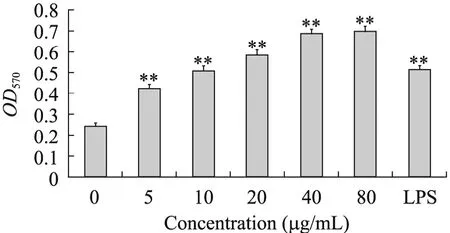
图10 MBL-1作用浓度对巨噬细胞增殖指数的影响Fig. 10 Effect of MBL-1 concentation on proliferation index of macrophages. LPS (5 μg/mL) as the positive control. 0 μg/mL as a control; ** P≤0.01 vs control group.
通过测定小鼠腹腔巨噬细胞吞噬中性红的能力,可以判定 MBL-1对巨噬细胞吞噬能力的影响。如图11所示,巨噬细胞在MBL-1的作用下,吞噬能力明显增强,随着作用浓度的增加,巨噬细胞的吞噬活性也显著增加。结果表明MBL-1可以刺激小鼠腹腔巨噬细胞,使其进一步分化成熟,吞噬能力明显增强。
2.10 巨噬细胞在 MBL-1作用后的扫描电镜分析

图11 MBL-1作用浓度对巨噬细胞吞噬活性的影响Fig. 11 Effect of MBL-1 concentation on phagocytic activity of macrophages. LPS (5 μg/mL) as the positive control. * P≤0.05; ** P≤0.01 vs control group.
加入40 μg/mL的MBL-1培养48 h后,通过扫描电镜观察巨噬细胞的外部形态,如图 12所示,MBL-1可以激活巨噬细胞,激活的巨噬细胞和未激活的巨噬细胞之间存在着明显差异。如图12A所示,未激活的巨噬细胞一般呈圆形、椭圆形等,鲜少有突起。激活的巨噬细胞体积增大,胞体铺展,呈椭圆、菱形或梭形等不规则的形状,表面突起可呈叶状或皱摺状,表现出了更大的膜活性 (图12B),实验结果表明巨噬细胞在MBL-1作用下,外部形态已经呈现明显的活化特征。

图12 MBL-1作用巨噬细胞的电镜扫描Fig. 12 Scanning electron micrographs of macrophages treated with MBL-1. 1: control group; 2: macrophages treated with 40 μg/mL MBL-1 for 48 h.
3 讨论
MBL-1是本研究室分离纯化得到的一种具有明显免疫调节活性的凝集素,分子量为24 kDa。对兔血红细胞的凝集效价为 256,其凝血活性在0~40 ℃和pH 6.0~9.0范围内保持相对稳定,D-甘露糖是其凝血活性的糖抑制剂,表明MBL-1是一种 D-甘露糖结合的凝集素。该类凝集素还未见相关报道,因此是一种新型家蝇蛹凝集素。
由于是一种新的凝集素,需要进一步研究其可能的生理功能,因此我们有必要对其结构进行分析。实验结果表明 MBL-1是一种糖蛋白,分析氨基酸组成的测试是蛋白质化学的重要内容。真核生物中约有80%的可溶性蛋白质是N-末端封闭的,Tasumia等[22]在测定凝集素AJL-1的N-末端序列时也出现了 N端封闭的情况。所谓 N端封闭,仅仅是对 Edman测序原理而言的,常常是由于氨基末端的谷氨酸暴露于酸性环境中所形成。由于MBL-1的蛋白测序结果为N-端封闭,我们后期拟寻求更合理有效的测序方法,如可将蛋白质化学降解或酶切分离后分析。测得家蝇蛹凝集素的碱基序列后可通过分子生物学方法对其进行克隆,使其在微生物体内表达,省去大规模饲养和诱导的不便[23]。
糖链在其发挥生理功能方面起着重要作用,结果表明MBL-1是一种存在N-糖苷键,原子力显微镜扫描结果显示MBL-1为椭球状蛋白单体,可能由于糖链较短,图上并不能看到明显的糖链结构。
家蝇缺乏特异性很高的免疫系统,凝集素在其非专一性免疫防御与异体识别机制中起着重要的作用,参与了细胞免疫和体液免疫,与家蝇的抗菌作用密切相关。因此研究家蝇凝集素的免疫调节活性对于认识家蝇蝇免疫防御的分子机理有着重要意义。巨噬细胞遇到外源性因素作用时其形态、功能会受到影响[24-25],MBL-1能够明显促进鼠巨噬细胞的增殖,并使巨噬细胞形态呈现明显的活化特征,表明其具有较强的免疫调节活性,至于其具体的免疫调节作用分子机理,还有待于进一步深入研究。
[1]Wang W, Feng J, Wang ZT, et al. Preliminary study on anti-baculovirus mechanism of feeding housefly larvae (Musca domestica) and population infection model of outbreaking epidemic disease of shrimp (Panaeus chinensis). Chin J Appl Ecol,2002, 13(6): 728−730 (in Chinese).
王娓, 冯江, 王振堂, 等. 对虾暴发性流行病的群体感染及投饲蝇幼的抗病机制研究. 应用生态学报, 2002, 13(6): 728−730.
[2]Meylaers K, Clynen E, Daloze D, et al.Identification of 1-lysophosphatidylethanolamine(C16:1) as an antimicrobial compound in the housefly,Musca domestica. Insect Biochem Molec,2004, 34(1): 43−49.
[3]Cao XH, Huo Z, Lu MF, et al. Purification of lectin from larvae of the fly,Musca domesticaand in vitro anti-tumor activity in MCF-7 cells. J Insect Sci, 2010, 10(164): 1536−2442.
[4]Bulet P, Hetru C, Dimarcq JL, et al. Antimicrobial peptides in insects: structure and function. Dev Comp Immunol, 1999, 23(4/5): 329−344.
[5]Jiang Y, Wu MR, Lei CL, et al. Kinetics of the inducible lectin from hemolymph of house fly(Musca domesticavicina macquart). J Huazhong Univ Agric, 1998, 17(2): 130−137 (in Chinese).
姜勇, 吴明荣, 雷朝亮, 等. 家蝇血淋巴凝集素诱导动力学的研究. 华中农业大学学报, 1998,17(2): 130−137.
[6]Cao XH, Chen Y, Zhang Y, et al. Isolation and Characterization ofMusca domesticapupae lectin.Prog Biochem Biophys, 2003, 30(3): 442−446 (in Chinese).
曹小红, 陈一, 张燕, 等. 家蝇蛹凝集素的分离工艺和性质的初步研究. 生物化学与生物物理进展, 2003, 30(3): 442−446.
[7]Cao XH, Chen Y, Zhang Y, et al. Purification,immunoactivity and antibacterial activity of a kind ofMusca domesticapupae lectin. Chin J Microbiol Immunol, 2003, 23(10): 805−808 (in Chinese).
曹小红, 陈一, 张燕, 等. 家蝇蛹凝集素的纯化及其免疫调节和抑菌作用. 中华微生物学和免疫学杂志, 2003, 23(10): 805−808.
[8]Van Damme EJM, Barre A, Rouge P, et al. A lectin and a related non-carbohydrate-binding protein are the two most prominent protein in the bark of yellow wood (Cladrastis lutea). Plant Mol Biol,1995, 29(3): 579−598.
[9]Cançado FC, Valério AA, Marana SR, et al. The crystal structure of a lysozyme c from house flyMusca domestica, the first structure of a digestive lysozyme. J Struct Biol, 2007, 160 (1): 83−92.
[10]Bo M, Zhou L. Some structure information and biological activities of an antibacterial protein fromMusca domestica(House Fly). Chin J Biochem Mol Biol, 2002, 18(5): 633−637 (in Chinese).
柏鸣, 周立. 家蝇抗菌蛋白的部分结构信息及生物学活性. 中国生物化学与分子生物学报, 2002,18(5): 633−637.
[11]Hou LX, Shi YH, Zhai P, et al. Antibacterial activity andin vitroanti-tumor activity of the extract of the larvae of the housefly (Musca domestica). J Ethnopharmacol, 2007, 111(2):227−231.
[12]Cao XH, Mao DZ, Wang CL, et al.Immunomodulation effect ofMusca domesticahemolymph and its extraction. Cell Mol Immonol,2009, 25(9): 801−804 (in Chinese).
曹小红, 毛德志, 王春玲, 等. 家蝇蛹血淋巴及其提取物的免疫调节作用. 中国免疫学杂志.2009, 25(9): 801−804.
[13]Nie S, Xie MY, Fu ZH, et al. Study on the purification and chemical compositions of tea glycoprotein. Carbohyd Polym, 2008, 71(4):626−633.
[14]Tanjj T, Ohashi-Kobayashi A, Nator S. Participation of a galactose-specific C-type lectin inDrosophilaimmunity. Biochem J, 2006, 396: 127−138.
[15]Mirgorodskaya E, Hassan H, Clausen H, et al. Mass spectrometric determination of O’glycosylation sites using beta-elimination and partial acid hydrolysis. Anal Chem, 2001, 73(6): 1263−1269.
[16]Gourdine JP, Smith-Ravin EJ. Analysis of a cDNA-derived sequence of a novel mannose-binding lectin, codakine, from the tropical clamCodakia orbicularis. Fish Shellfish Immun,2007, 22 (5): 498−509.
[17]Fayez A, Hani A, Atallah R. Site investigation on medical waste management practices in Northern Jordan. Waste Manage, 2007, 28 (2): 450−458.
[18]Shin SW, Park DS, Kim SC, et al. Two carbohydrate recognition domains ofHyphantria cunealectin bind to bacterial lipopolysaccharides through O-specific chain. FEBS Lett, 2000, 467(1): 70−74.
[19]Rittidach W, Paijit N, Utarabhand P. Purification and characterization of a lectin from the banana shrimpFenneropenaeus merguiensishemolymph.BBA-Gen Subjects, 2007, 1770(1): 106−114.
[20]Aebersold R, Mann M. Mass spectrometry-based protemics. Nature, 2003, 422(6928): 198−207.
[21]Absar N, Hasan S, Arisaka F. Purification,characterization and N-terminal sequences alignment of a mannose specific protein purified from Potca fish,Tetraodon patoca. Protein J, 2008,27(2): 97−104.
[22]Tasumia S, Yang WJ, Usami T, et al.Characteristics and primary structure of a galectin in the skin mucus of the Japanese eel,Anguilla japonica. Dev Comp Immunol, 2004, 28(4):325−335.
[23]Luo T, Yang HJ, Li F, et al. Purification,characterization and cDNA cloning of a novel lipopolysaccharide-binding lectin from the shrimpPenaeus monodon. Dev Comp Immunol, 2006, 30(7): 607−617.
[24]Almog T, Naor Z. Mitogen activated protein kinases (MAPKs) as regulators of spermatogenesis and spermatozoa functions. Mol Cell Endocrinol,2008, 282(12): 39−44.
[25]Gordon S. The role of the macrophage in immune regulation. Res Immunol, 1998, 149(7/8): 685−688.
November 15, 2012; Accepted: March 4, 2013
Chunling Wang. Tel/Fax:+86-22-60601428; E-mail: wangchunling@tust.edu.cn
Structure and immunomodulation activity of a novel mannose binding lectin from housefly pupae
Chunling Wang, Yan Xia, Shijiao Zhang, Lirui Wang, and Xiaohong Cao
Key Laboratory of Food Nutrition and Safety,College of Food Engineering and Biotechnology,Tianjin University of Science &Technology,Ministry of Education,Tianjin300457,China
We purified a novel mannose binding lectin formMusca domesticapupae by affinity chromatography on Con A-Sepharose 4B and DEAE weak anion-exchange chromatography. By SDS-PAGE, MBL-1 yielded a single band with the molecular weight of 24 kDa. It was a glycoprotein detected by periodic acid-schiff’s staining reaction, with 97.36% protein and 2.1% oligosaccharide. Meanwhile, the results of β-elimination reaction, infrared spectroscopy, atomic force microscopy and protein sequencing instrument show that MBL-1 was an ellipsoidal-shaped monomer with 60−100 nm in diameter.N-glycoside bond linked oligosaccharide chain and the N-terminal blocked peptide chain. Further study suggested that MBL-1 promote the proliferation of macrophage in a concentration-dependent manner. The scanning electron microscope analysis shows that MBL-1 promoted the activation of macrophages. These results show that MBL-1 purified fromMusca domesticapupae possesses immune regulation effect, serving a reference basis to develop natural immune-modulator.
Musca domesticapupae, lectin, structure analysis, immunomodulation
Supported by: Key Projects in the National Science and Technology Pillar Program during the Twelveth Five-Year Plan Period (No.2012BADB33B04), National Natural Science Foundation of China (No. 31000768).
“十二五”国家科技支撑计划 (No. 2012BADB33B04),国家自然科学基金 (No. 31000768) 资助。
时间:2013-04-10 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20130410.0950.001.html
(本文责编 郝丽芳)
