重组牛源荚膜A型多杀性巴氏杆菌脂蛋白E的免疫保护性研究
2013-08-30牛思博姜志刚德艳艳
牛思博,姜志刚,德艳艳,于 力
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/大动物病研究室,黑龙江哈尔滨 150001)
多杀性巴氏杆菌(Pasteurella mutocida)是巴氏杆菌科巴氏杆菌属中具有异质性特征的病原菌群,根据菌体表面的荚膜多糖的抗原特异性将该菌分为A、B、D、E和F 5个荚膜型[1]。该菌为条件致病菌,主要引起家养和野生动物以败血及呼吸系统疾患为主要特征的疾病[2]。每个荚膜型的宿主嗜性、致病特点都不尽相同,不同荚膜血清型之间的交叉保护性较差。
荚膜A型多杀性巴氏杆菌主要侵害肉牛及奶牛的呼吸系统,以牛的巴氏杆菌肺炎为特征。该病呈散发或地方性流行,2006年以来对我国养牛业的危害极其严重[1,3]。2008年本实验室在国内首次报道分离出牛源荚膜A型多杀性巴氏杆菌,至2012年,该病在我国至少有10个省区发生与流行[4]。由于以往我国主要流行由荚膜B型多杀性巴氏杆菌引起的牛出血性败血症,而牛源荚膜A型多杀性巴氏杆菌肺炎作为一种新发疫情,亟待研究有效的疫苗进行防控。
脂蛋白E(PlpE)是巴氏杆菌的一种膜脂蛋白,具粘附宿主细胞的作用。研究表明,溶血性曼氏杆菌(M.haemolytica)的PlpE在牛体内可诱导较高滴度的抗体[5],经大肠杆菌表达的重组PlpE(rPlpE)与商品化溶血性曼氏杆菌疫苗联合免疫小鼠可提升该疫苗的免疫保护力[5-6]。由此推测,多杀性巴氏杆菌的PlpE也是一种保护性抗原。
本研究将牛源荚膜A型多杀性巴氏杆菌PM-HLJ株的PlpE进行原核表达,并将重组蛋白免疫小鼠进行免疫原性评价,以确定多杀性巴氏杆菌PlpE的免疫保护性,为开发安全有效的荚膜A型多杀性巴氏杆菌新型疫苗奠定基础。
1 材料和方法
1.1 菌株,质粒载体及实验动物 牛源荚膜A型多杀性巴氏杆菌PM-HLJ株由本实验室分离鉴定并保存。感受态细胞DH5α和pMD18-T载体购自TaKaRa公司,BL21(DE3)购自天根生化科技有限公司,pET-30a(+)载体为本实验室保存。6周龄雌性BALB/c小鼠购自中国农业科学院哈尔滨兽医研究所实验动物中心。
1.2 主要试剂 ExTaqDNA聚合酶及各种限制性内切酶均购自TaKaRa公司,T4 DNA连接酶购自NEB公司,IPTG和HRP标记的His(HRP-IgG)单克隆抗体(MAb)以及兔抗鼠IgG(HRP-IgG)均购自Sigma公司,Ni-NTA琼脂糖填料购自QIAGEN公司。
1.3 引物的设计及合成 根据GenBank中登录的荚膜A型多杀性巴氏杆菌PlpE基因序列(EF219455)设计一对测序引物:Seq-F:5'-ATGAAACAAATCG TTTTAAAAAC-3',Seq-R:5'-TTATTGTGCTTGGTG ACTTTTTTCAGC-3';及一对表达引物Exp-F:5'-C GGAATTCATGAAACAAATCGTTTTAAAAAC-3'(EcoRⅠ),Exp-R:5'-GCGTCGACTTATTGTGCTTG GTGACTTTTTTCAGC-3'(SalⅠ)。
1.4 基因克隆与序列测定 采用煮沸法提取荚膜A型多杀性巴氏杆菌PM-HLJ株的基因组DNA作为PCR模板,用测序引物对PlpE基因进行PCR扩增。反应条件为94℃5 s;94℃40 s、60℃45 s、72℃60 s,共30个循环;72℃10 Min。回收扩增产物,将其克隆于pMD18-T载体中,重组质粒由北京六合华大基因科技股份有限公司测序。
1.5 重组蛋白的表达和提纯 将用表达引物扩增产物克隆入表达载体pET-30a(+),转化大肠杆菌BL21(DE3)。提取重组质粒,双酶切鉴定,序列测定验证阅读框是否正确及有无突变出现。
将重组质粒转化大肠杆菌BL(DE3),接种含卡纳霉素的LB培养基中培养至OD600nm值为0.6,以终浓度为0.2 mmol/L的IPTG于16℃诱导表达16 h,将培养物离心后进行超声破碎,离心收集上清用于鉴定可溶性蛋白的表达效果。按Ni-NTA琼脂糖纯化系统的使用说明书纯化目的蛋白,并使用BCA蛋白测定试剂盒测定蛋白的浓度。
1.6 rPlpE的SDS-PAGE检测和western blot鉴定通过SDS-PAGE电泳对rPlpE的表达与纯化进行检测。分别以His(HRP-IgG)MAb(1∶2 500)和 PM-HLJ小鼠多克隆抗血清(1∶100)为一抗,以兔抗鼠IgG(HRP-IgG)二抗,通过底物DAB显色,进行重组蛋白的western blot鉴定。
1.7 荚膜A型多杀性巴氏杆菌灭活疫苗的制备PM-HLJ菌种以2%体积接种于BHI液体培养基中,于37℃、75 r/m in培养16 h,经菌落计数后,以0.2%甲醛溶液,于37℃灭活24 h,将灭活培养物接种BHI平板培养基进行灭活检验后,与15%体积的法国佐剂(MONTANIDE ISA 15A VG)充分混合,制备灭活疫苗。
1.8 小鼠免疫保护试验 将40只BALB/c小鼠随机分成8组(A-H),每组5只,采用腹腔途径免疫乳化后的rPlpE(15%体积的法国佐剂)。A-E组rPlpE的免疫剂量分别为5μg、10μg、20μg、30μg、40μg、60μg,G组免疫PM-HLJ灭活疫苗,剂量为1×107cfu,H注射PBS作为空白对照组。首次免疫后14 d进行二次免疫。采集一免前、一免后14 d和二免后14 d小鼠尾静脉血并分离血清,包被rPlpE,通过间接ELISA检测免疫小鼠血清中针对重组蛋白IgG的产生动态。于二免后21 d经腹腔注射PM-HLJ活菌(30 cfu)进行攻毒。记录小鼠死亡数和免疫保护率。
2 结 果
2.1 PM-HLJ株PlpE基因的克隆及测序 PCR扩增获得到预期大小约为1100 bp的PlpE基因片段(图1)。序列分析显示,PM-HLJ株PlpE基因编码的氨基酸序列与荚膜A型多杀性巴氏杆菌P-1059株(EF219455)PlpE的序列一致性高达95.83%。
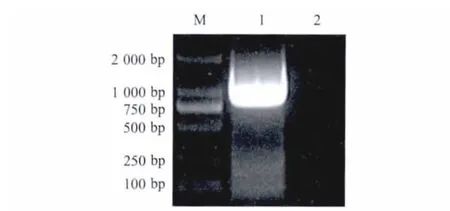
图1 PlpE基因的PCR扩增结果Fig.1 PCR amplification of PlpE gene
2.2 rPlpE的表达与鉴定 重组菌株经IPTG诱导表达后进行SDS-PAGE检测,结果显示,重组蛋白分子量约为45 ku,与预期大小相符,重组蛋白以可溶形式表达。目的蛋白采用镍离子亲和层析纯化。以His MAb以及小鼠全菌体多抗分别作为一抗对纯化的rPlpE蛋白进行western blot鉴定。结果显示,在45 ku处分别出现明显的免疫特异性反应条带,表明重组蛋白与His MAb以及小鼠多抗均具有良好的反应原性(图2)。
2.3 免疫小鼠针对rPlpE的IgG抗体检测 间接ELISA结果显示(图3),各免疫组小鼠在一次免疫后均产生了针对重组蛋白的IgG抗体,二次免疫后抗体水平均明显升高。5μg和10μg rPlpE免疫组产生了低水平的IgG抗体,而60μg rPlpE免疫组和灭活苗免疫组的抗体水平最高,OD450nm值可达到1.5。
2.4 rPlpE蛋白的免疫保护性 二免后21 d小鼠腹腔途径注射3MLD(30 cfu)的PM-HLJ活菌,结果显示,接种5μg、10μg rPlpE免疫组的小鼠未产生对PM-HLJ攻击的保护力,20μg、30μg和40μg免疫组对小鼠保护率分别为20%、40%和80%,60μg免疫组小鼠可以完全抵抗PM-HLJ的攻击。全菌体灭活疫苗对照组可以完全抵抗PM-HLJ的攻击(表1)。结果表明,牛源荚膜A型多杀性巴氏杆菌的rPlpE对小鼠具有免疫保护效力。
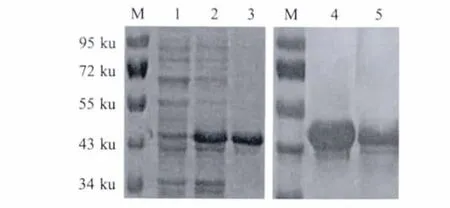
图2 rPlpE蛋白的SDS-PAGE(A)及western blot(B)分析Fig.2 SDS-PAGE and western blot analysis of expressed rPlpE
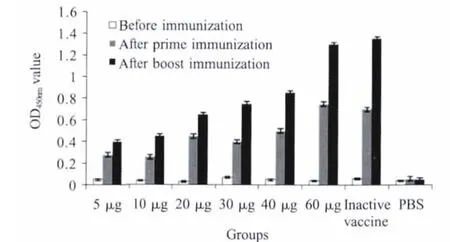
图3 间接ELISA检测小鼠血清中抗rPlpE IgG抗体Fig.3 Detection of IgG antibodies against rPlpE in sera ofm ice by indirect ELISA

表1 rPlpE免疫小鼠对PM-HLJ攻击的保护作用Table 1 Protection of themice inoculated w ith recombinant PlpE against PM-HLJ challenge
3 讨 论
Pandher等报道,胸膜肺炎放线杆菌的外膜脂蛋白A(Om lA)与溶血性曼氏杆菌的PlpE氨基酸序列同源性仅为18%,但均为保护性抗原[7]。荚膜A型多杀性巴氏杆菌与溶血性曼氏杆菌,胸膜肺炎放线杆菌均属于巴氏杆菌科[8],而已发表全基因组序列的荚膜A型多杀性巴氏杆菌pm-70株的PlpE与溶血性曼氏杆菌PlpE的同源性为24.3%。因此推测,荚膜A型多杀性巴氏杆菌的PlpE也为保护性抗原。本研究结果也显示,免疫60μg rPlpE可使小鼠完全抵抗30 cfu(3MLD)PM-HLJ的攻击,与灭活PM-HLJ(5×107cfu)对照组的保护率同为100%。表明牛源荚膜A型多杀性巴氏杆菌的PlpE具有免疫保护效力。
目前,多杀性巴氏杆菌PlpE作为一种免疫保护性抗原,其免疫原性与蛋白结构的相关性尚不清楚。研究表明,溶血性曼氏杆菌PlpE和放线杆菌Om lA具有独特的共同结构,PlpE和Om lA在多肽链的氨基端存在一连串的丝氨酸和甘氨酸残基,推测这一独特结构与PlpE和Om lA的免疫保护性相关[11]。然而,多杀性巴氏杆菌PlpE的氨基端不具有上述两种蛋白的特殊结构[8]。因此推测溶血性曼氏杆菌PlpE和放线杆菌Om lA的免疫保护性机制不适用于多杀性巴氏杆菌PlpE。Singh等预测,PlpE多肽链的疏水区可能具有抗原性[9]。然而,由于多杀性巴氏杆菌菌体蛋白复杂,并且缺乏有效的提取、鉴定以及晶体结构解析单一菌体膜蛋白的方法,因此还不能对此假设进行验证。
目前,牛巴氏杆菌肺炎防控技术的研究主要针对荚膜A型多杀性巴氏杆菌灭活疫苗和减毒活疫苗。全菌体灭活疫苗具有明显的血清型和荚膜型特异性,并且由于大量无关抗原的存在,导致机体产生不良反应。弱毒疫苗虽能提供一定程度的同源和异源保护,但存在毒力返强等安全隐患[10]。亚单位疫苗作为一种新型疫苗,与传统全菌体灭活疫苗和减毒活疫苗相比具有安全性高、纯度高、稳定性好等优点。本研究表明,PM-HLJ的rPlpE针对同种荚膜型多杀性巴氏杆菌具有免疫保护性,可以作为荚膜A型多杀性巴氏杆菌的免疫原。进一步研究可通过rPlpE与多杀性巴氏杆菌灭活疫苗联合免疫,以弥补单一免疫原rPlpE造成的免疫效力不足,同时减少灭活疫苗因大量无关抗原产生的副反应。
[1]Rim ler R B,Rhoades K R,Serogroup F.A new capsule serogroup ofPasteurella multocida[J].Clin Microbiol,1987,25:616-618.
[2]Carter G R.Studies onPasteurella multocida.I.A haemagglutination test for the identification of serological types[J].Am Vet Res,1955,16:481-484.
[3]Davies R L,MacCorgwodale R,Reilly S.Characterisation of bovine strains ofPasteurella multocidaand comparison with isolates of avian,ovine and porcine origin[J].Vet Microbiol,2004,99(2):145-158.
[4]马文戈,于力.牛源荚膜血清A型多杀性巴氏杆菌的分离鉴定[J].中国预防兽医学报,2008,30(10):747-750.
[5]Ayalew S,Blackwood E R,Confer A W.Sequence diversity of the immunogenic outer membrane lipoprotein PlpE fromMannheim ia haemolyticaserotypes 1 and 6[J].Vet Microbiol,2006,114:260-268.
[6]Confer A W,Ayalew S,Panciera R J,et al.RecombinantMannheimia haemolyticaserotype 1 outer membrane protein PlpE enhances commercial M.haemolytica vaccine-induced resistance against serotype 6 challenge[J].Vaccine,2006,24:2248-2255.
[7]Gerlach-F G,Anderson C,Klashinsky S,et al.Molecular characterization of a protective outer membrane lipoprotein(Om1A)fromActinobacillus pleuropneumoniaeserotype 1[J].Infect Immun,1993,61:65-72.
[8]Seydel A,Gounon P,Pugsley A P.Testing the'+2'rule for lipoprotein sorting in theEscherichia colicell envelope w ith a new genetic selection[J].Mol Microbiol 1999,34:810-21.
[9]Ajay P S,Satparkash S,Rajeev R,et al.Molecular heterogeneity ofPlpEgene in Indian isolates ofPasteurella multocidaand expression of recombinant PlpE in vaccine strain ofP.multocidaserotype B:2[J].Vet Sci,2010,11(3):227-233.
[10]Sinps K P,Hirsh D C,Kasten R W,et al.Differentiation of field isolates ofPasteurellamultocidaserotype 3,4 from live vaccine strain by genotypic characterization[J].Avi Dis,1990,34:419-424.
