猪细环病毒两种基因型双重PCR检测方法的建立
2013-08-30钞安军王子馨王淑娟朱前磊吴宇阳卢权威陈红英
李 坤,钞安军,王子馨,王淑娟,2,朱前磊,2,吴宇阳,卢权威,陈红英*
(1.河南农业大学牧医工程学院,河南郑州 450002;2.河南省畜牧局,河南郑州 450003)
细环病毒(Torque teno virus,TTV)是近年来发现的一种新型人畜共患病毒,广泛感染人类、非人灵长类动物、家养及野生动物[1]。猪TTV分为两个基因型,即PTTV1和PTTV2,二者核苷酸同源性低于50%[2]。自1999年Leary首次报道在美国猪血清中检测到TTV以来,美国、加拿大、泰国、韩国、意大利、捷克、法国及西班牙等国家的猪群中相继检测到PTTV1和PTTV2,感染率24%~100%[3]。M cKeown等首次报道在我国猪群中检测到PTTV[4]。王礞礞等对2008年~2009年采集自我国6个省份发病猪和健康猪共258份临床样本进行检测,PTTV1、PTTV2的感染率分别为37.6%、82.6%,二者混合感染率为38.4%[5]。最近,Wu等对采自我国7个不同品种猪群的208份血清样本进行检测,结果显示各品种猪群中均存在PTTV1和PTTV2[6]。表明PTTV在我国猪群中普遍存在,已成为一个不容忽视的新病原,建立快速检测PTTV1和PTTV2的方法尤为必要。
由于还没有建立适合在体外培养PTTV的细胞系,目前对该病毒的检测主要根据已发表的PTTV基因序列采用PCR方法进行[7]。PTTV1和PTTV2在基因结构上均含有非编码区(UTR),UTR在PTTV中均比较保守,可以用于PTTV1和PTTV2的分型和鉴定。本研究建立了一种快速检测PTTV1和PTTV2的双重PCR方法,为我国开展PTTV的流行病学调查及相关研究奠定基础。
1 材料和方法
1.1 病毒株 猪细小病毒(PPV)7909标准株购自中国兽药监察所;猪圆环病毒2型(PCV2)由河南农业大学兽医微生物室保存;采用PCR方法对河南省动物性食品安全重点实验室保存的病料进行扩增和测序,从鉴定为阳性的病料中选出两个样本分别作为PTTV1和PTTV2的标准阳性对照。
1.2 主要试剂 2×PCRTaqMix购自北京美莱博医学科技有限公司;DNA Marker DL2000、pMD18-T载体、Proteinase K、IPTG和X-gal等购自宝生物工程(大连)有限公司。
1.3 DNA的提取 取500 mg组织(脾脏、肝脏、淋巴结等)样品进行研磨,1 ML PBS液稀释;或取400μL抗凝血反复冻融3次,6 000 r/m in离心20m in。取300μL上清液,加入等体积裂解液(100 mmol/L NaCl;10mmol/L Tris-CI,pH8.0;25mmol/L EDTA,pH8.0;0.5%(m/v)SDS;200μg/mL Proteinase K)混匀,55℃消化1.5 h。采用常规的酚/氯仿抽提其DNA。
1.4 引物设计 根据GenBank中登录的Sd-TTV31株(AB076001)和 Sd-TTV2p株(AY823991)非编码区基因序列,使用软件Oligo 7.0设计2对引物,引物P1/P2(5'-TTATTCGCTTCGCTCGCACCAC-3'/5'-CGTA CAGTCGCTAGACAGTTCT-3')扩增PTTV1,扩增片段长度为 324 bp;引物 P3/P4(5'-GATGCAGACG AATGGCTGAGT-3'/5'-TATGGCTCCAGTCACAACCT C-3')扩增PTTV2,扩增的片段为522 bp。引物均由上海生工生物工程技术服务有限公司合成。
1.5 单项PCR扩增 PTTV1型和PTTV2型的单项PCR扩增反应均采用 25μL反应体系:2×PCRTaqMix 8μL,上、下游引物(25 pmol/μL)各 0.5μL,模板3μL,加双蒸水至25μL。反应程序为:94℃5m in;94℃30 s、59℃(PTTV1型)或61℃ (PTTV2型)30 s、72℃ 50 s,共35个循环;72℃ 10 min。PCR产物经1.0%琼脂糖凝胶电泳检测。
1.6 双重PCR扩增 在PTTV1型和PTTV2型单项PCR扩增的基础上,进行双重PCR扩增条件优化,分别对双重PCR反应体系中退火温度、引物间比例、模板量、Taq酶浓度等条件进行预试验,最终确定最佳的双重PCR方法的扩增条件。
1.7 双重PCR的特异性试验 分别提取PTTV1、PTTV2、PCV2和PPV DNA、PTTV1和PTTV2混合DNA,按优化的双重PCR反应条件分别进行扩增,并设无模板系统阴性对照。
1.8 双重PCR的灵敏度试验 用紫外分光光度计分别测定PTTV1和PTTV2重组质粒样本(pMD-PTTV1和pMD-PTTV2)DNA的OD值,计算重组质粒DNA的纯度和浓度,换算为PTTV1和PTTV2的拷贝数。用去离子水将重组质粒等体积混合模板作10倍系列稀释,取2μL每个稀释度质粒DNA,分别进行双重PCR扩增。
1.9 双重PCR的重复性试验 采用P1/P2、P3/P4混合引物,对采自不同地区的含PTTV1和PTTV2的3份病料样品DNA进行双重PCR检测,并做3次重复。
1.10 临床应用 对采自河南省内的20份PCV2阳性猪组织(肺、肝、淋巴结等)病料和某规模化猪场24份临床健康育肥猪血液样品,提取模板DNA,按照建立的双重PCR扩增体系和扩增条件进行扩增,取6μL PCR扩增产物,琼脂糖凝胶电泳后进行结果判定。
2 结 果
2.1 PTTV1型PCR扩增 以PTTV1 DNA为模板进行PCR扩增,电泳结果显示,PCR扩增出一条约300 bp的DNA片段(图1),与预期结果相符。将PCR产物纯化回收后,克隆于pMD18-T载体中进行测序。序列分析表明,目的DNA片段为324 bp,与参照的Sd-TTV31株序列同源性为92.6%。
2.2 PTTV2型PCR扩增 以PTTV2 DNA为模板进行PCR扩增,电泳结果显示,PCR扩增出一条约500 bp的DNA片段(图1),与预期结果相符,经测序鉴定表明,目的DNA片段为522 bp,与参照的Sd-TTV2p株核苷酸相似性为97.3%。
2.3 双重PCR反应条件的优化结果 以混合的PTTV1和PTTV2 DNA为模板,通过对PCR反应的循环数20、25、30、35和退火温度55℃、58℃、60℃、62℃、65℃进行多次方阵试验,并调整两种引物之间浓度比例,最终确定了PTTV1和PTTV2双重PCR扩增的最佳条件。PCR反应体系为模板DNA 4μL;PTTV1的上、下游引物(引物浓度为 20 pmol/μL)各 0.5μL,PTTV2的上、下游引物(引物浓度为 40 pmol/μL)各 0.5μL,2×PCRTaqMix 12μL;dd H2O 8μL,总体积为 25μL。PCR扩增条件为:95℃5min;94℃30 s、61℃30 s、72℃30 s,30个循环;72℃10m in,4℃ 10min。
2.4 双重PCR检测 在一个PCR反应体系中同时加入引物P1/P2、P3/P4和混合DNA,按优化的双重PCR反应条件进行扩增。电泳结果显示,可以有效地扩增出PTTV1基因组中的324 bp和PTTV2基因组中的522 bp 2个片段,而PCV2和PPV DNA及阴性对照均不能扩增出目的片段,证明了PCR扩增的特异性(图 1)。
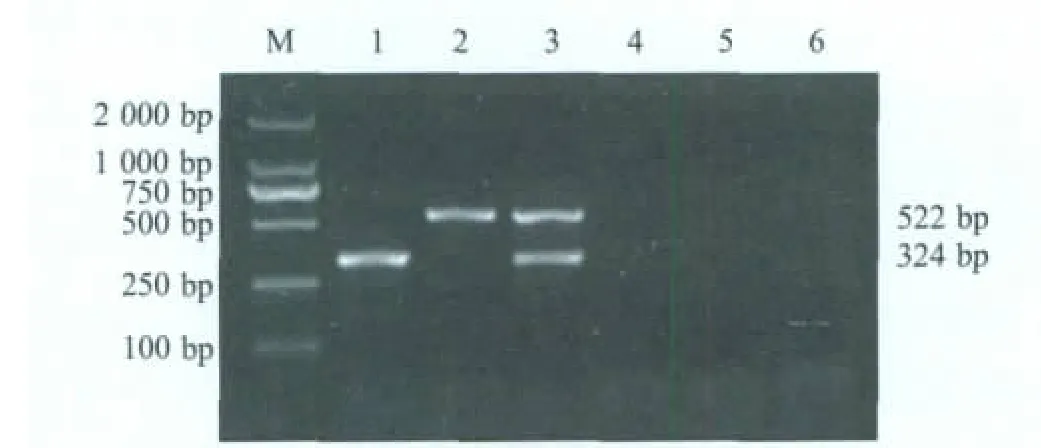
图1 PTTV1和PTTV2的双重PCR及特异性试验Fig.1 The duplex PCR and its specific tests for PTTV1 and PTTV2 detection
2.5 双重PCR的灵敏度试验 紫外分光光度计测得pMD-PTTV1和pMD-PTTV2 DNA的OD260nm和OD280nm值分别为1.93和1.87,纯度合格。pMD-PTTV1浓度为 31 ng/μL,含有 PTTV1约为 1010copies/μL。pMD-PTTV2浓度为34 ng/μL,含有PTTV2约为1010copies/μL。灵敏度试验结果显示 108稀释的质粒DNA仍能够扩增出522 bp和324 bp两条带,109稀释的质粒DNA仅能扩增出一条约522 bp的条带,而1010稀释的质粒DNA不能扩增出条带(图2)。表明双重PCR对PTTV1和PTTV2的检测极限分别为100 copies和 10 copies。
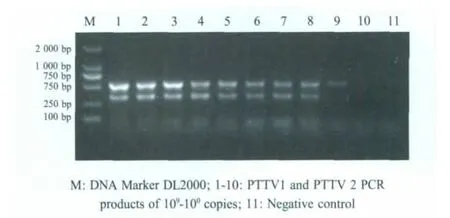
图2 双重PCR的灵敏度试验Fig.2 Sensitivity test of duplex PCR
2.6 双重PCR的重复性试验 采用P1/P2、P3/P4混合引物对来自不同地区的3份阳性病料样品提取的DNA进行3次重复PCR扩增,每次PCR扩增结果PTTV1和PTTV2均为阳性,表明该方法具有很好的可重复性。
2.7 临床应用 应用建立的双重PCR方法对采自河南省内的20份PCV2阳性组织病料(肺、肝、淋巴结等)和24份临床健康的育肥猪血液样本进行检测。结果显示:PCV2阳性病料样品中,PTTV1和PTTV2单一阳性率均为10%(2/20),二者混合感染率为5%(1/20);临床健康育肥猪血液样本中,PTTV1型和PTTV2阳性率分别为58%(14/24)和50%(12/24),二者混合感染率为 29%(7/24)。表明PTTV1和PTTV2在健康和非健康猪群中均存在。
3 讨 论
目前,用于PTTV流行病学调查的检测方法主要有常规PCR、巢式PCR、荧光PCR和滚环扩增等[8]。本研究建立的双重PCR方法具有可以同时检测两种PTTV1和PTTV2,简便、快速、经济的优点。
建立双重PCR方法的关键是对引物比例、复性温度及循环次数的优化。根据短片段优先扩增的原理,双重PCR扩增总是有利于片段较小的一方。本实验增加 PTTV2的引物浓度(40 pmol/μL),降低PTTV1的引物浓度(20 pmol/μL),获得了很好的扩增效果。由于PTTV的UTR扩增序列中G+C含量较高,在温度循环参数中,复性温度在PTTV1的PCR反应为61℃,而利用P3/P4作引物扩增PTTV2 522 bp片段时复性温度为57℃~61℃均可,因此选择双重PCR的复性温度为61℃。双重PCR结果表明30次循环已足以检出。如果条带太弱难以分辨时可以进行35次循环,但是循环次数过多,会出现非特异性条带,另外由于PCR扩增后期的“平台效应”,使得30次循环后PCR扩增效率大大减低,扩增产物量难以大量扩增,反而延长了检测时间。
我们对采自河南省内的PCV2阳性病料组织样品进行双重PCR检测,PTTV1和PTTV2单一阳性率和共感染率均低于翟少伦等报道数据[9],这可能与地域差异及样品类型不同有关。然而,对临床健康育肥猪血液样本检测数据表明TTV在健康育肥猪群中也存在较高的感染率。经临床验证,该方法检测迅速、特异性强、灵敏度高、重复性好,可以迅速检测并区分两种类型的病毒,适合PTTV1和PTTV2临床诊断及流行病学调查,具有较强的实用价值。
[1]Okamoto H,Takahashi M,Nishizawa T,et al.Genom ic characterization of TT viruses(TTVs)in pigs,cats and dogs and their relatedness with species-specific TTVs in primates and tupaias[J].JGen Virol,2002,83(6):1291-1297.
[2]Niel C,Diniz-Mendes L,Devalle S,et al.Rolling-circle amplification of Torque teno virus(TTV)complete genomes from human and swine sera and identification of a novel sw ine TTV genogroup[J].JGen Virol,2005,86(5):1343-1347.
[3]Jarosova V,Pogranichniy R,Celer V.Prevalence and age distribution of porcine torque teno sus virus(TTSuV)in the Czech Republic[J].Folia Microbiol(Praha),2011,56(2):90-94.
[4]M cKeown N E,Fenaux M,Halbur PG,et al.Molecular characterization of porcine TT virus,an orphan virus,in pigs from six different countries[J].VetM icrobiol,2004,104(1-2):113-117.
[5]王礞礞,周艳君,陈宗艳,等.我国猪群中TTV的鉴定及其分子流行病学分析[J].中国预防兽医学报,2009,31(10):751-756.
[6]Wu Zhi-wei,Wang Hong-ning,Yang Xin,et al.Molecular detection of Torque teno virus in different breeds of sw ine[J].Virol J,2011,8(1):503.
[7]Okamoto H.History of discoveries and pathogenicity of TT viruses[J].Curr Top Microbiol Immunol,2009,331:1-20.
[8]Macera L,Cortey M,Maggi F,et al.A novel rolling circle amplification assay to detect members of the fam ily Anelloviridae in pigs and humans[J].Virus Res,2011,160(1-2):424-427.
[9]翟少伦,龙进学,岳城,等.中国部分地区猪细环病毒1型和2型的分子检测[J].微生物与感染,2010,5(2):84-88.
