布鲁氏菌M 28强毒株O抗原聚合酶基因缺失株的构建及其毒力评价
2013-08-30乔祖建刘文兴覃晓琳步志高
赵 云,胡 森,乔祖建,刘文兴,覃晓琳,步志高*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部兽医公共卫生重点开放实验室,黑龙江哈尔滨 150001;2.东北农业大学动物医学学院,黑龙江哈尔滨 150030)
布鲁氏菌病(Brucellosis),是由布鲁氏杆菌(Brucella)感染引起的一种重要的人畜共患传染病。布鲁氏杆菌属于胞内寄生菌,其致病力主要表现在通过某些机制逃避或抑制巨噬细胞的杀菌作用,适应胞内环境并导致慢性感染[1]。研究表明,布鲁士杆菌菌体表面O抗原对其致病力的发挥起着关键作用。Porte等发现,猪种布鲁氏菌(Brucella suis)O抗原能够抑制其所侵染的宿主巨噬细胞吞噬体和溶酶体的融合,使布鲁氏菌能够在吞噬细胞内部逃避溶酶体的毒杀作用[2]。2004年,Ficht等发现,Brucella abortus株布鲁氏菌O抗原对于布鲁氏菌在鼠的巨噬细胞J774.A1中形成有利于其长期生存的niche结构起关键性作用[3]。
B.melitensisM5-90是一株疫苗株,由M 28人工诱变而成。王方坤等通过M 5-90及其强毒亲本株M 28全基因组测序,比对发现一处移码突变发生在编码O抗原聚合酶的BM 28_B0107(以下简称B0107)处。该突变是否对于布鲁氏菌LPS结构中O抗原合成产生影响以及其是否在M 5-90的致弱过程中起到一定作用,尚无相关报道[4]。本实验以M 28为亲本株,构建O抗原聚合酶基因缺失突变株,通过在小鼠体内致病性试验,评估其毒力下降程度,从而探索O抗原聚合酶基因在布鲁氏菌毒力发挥中的作用,为进一步弱化布鲁氏菌活疫苗毒力和研发新型基因缺失活疫苗奠定基础。
1 材料和方法
1.1 菌株、实验动物及细胞系 M28、大肠杆菌DH5α为本实验室保存;雌性BALB/c小鼠购自北京维康丽华生物有限公司;鼠腹腔巨噬细胞系RAW 264.7购自中国农业科学院哈尔滨兽医所诊断中心。
1.2 质粒和主要试剂 pMD18-T、PrimeSTARHS及相关限制性内切酶均购自TaKaRa公司;pSP72、pBlue-kanr为本实验室保存。
1.3 引物设计及合成 根据GenBank中M 28基因组(CP002460)设计扩增B0107基因两侧同源序列引物及扩增kanr表达盒引物(表1)。
1.4 同源重组序列扩增及其鉴定 根据文献[5]中方法,以M 28基因组为模板,利用高保真Prime STAR HS,左右同源重组序列引物(表1)通过PCR扩增B0107左右同源序列。PCR程序为98℃10 s;95℃10 s、58℃15 s、72℃1m in,30个循环;72℃10 Min。此外,以pBlue-kanr为模板,扩增kanr表达盒。分别将PCR产物克隆于pMD18-T载体中,对其进行序列测定。根据实验设计所得片段理论大小为左同源臂L为998 bp,kanr表达盒片段为1 258 bp,右同源臂R为1 000 bp,待缺失的B0107为1 230 bp。

表1 构建自杀质粒pSP-B0107-K和鉴定O抗原聚合酶突变株所用引物Table 1 Primers for construction recombinant plasm ids and identification of themutant strains
1.5 含有外源基因自杀质粒pSP-B0107-K的构建利用相应的限制性内切酶,将L臂、R臂、Kanr表达盒从T载体上切下,依次将L臂、Kanr及R臂插入pSP72,构建pSP-B0107-K。pSP-B0107-K结构见图1。其中Kanr基因定向插入,其使用的转录翻译的调控元件和阅读框架均来自B0107基因。
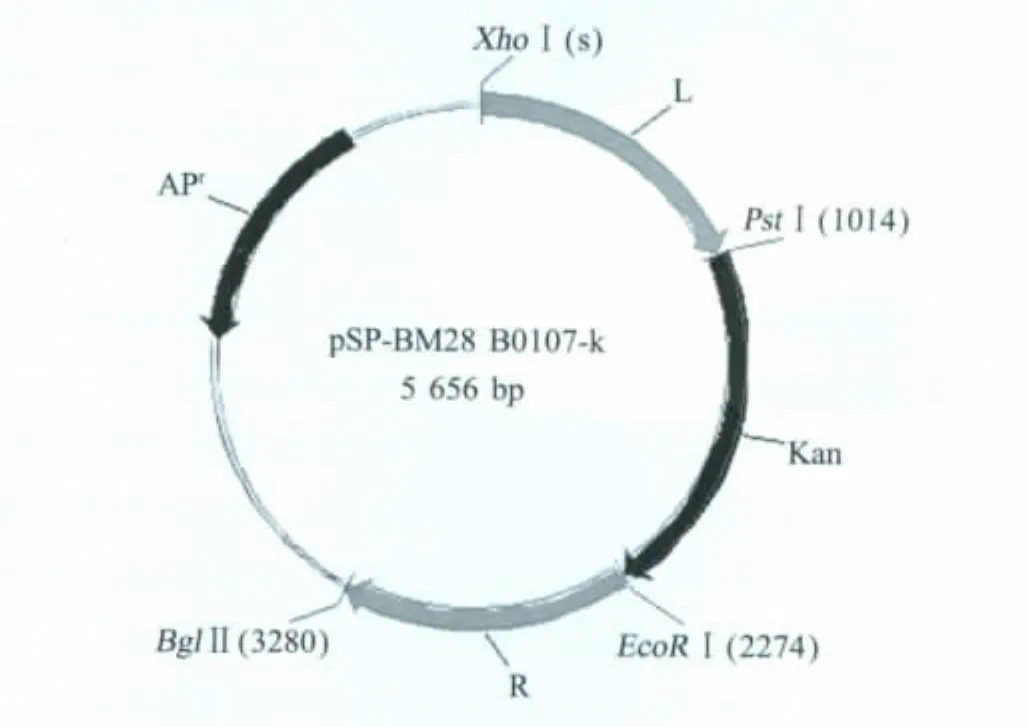
图1 同源重组质粒pSP-B0107-K示意图Fig.1 Expression elements of B0107 gene and expression elements of homologous recombinant vector pSP-B0107-K
1.6 突变株构建、筛选及卡那霉素基因表达稳定性的检测 中量制备质粒pSP-B0107-K将浓度调整为1μg/μL。将自杀质粒 pSP-B0107-K电转化 M28细菌。电转化条件为0.1 cm的转化杯,25μF,2.5 KV,400Ω,6ms。将电转化后的菌液涂布于含有卡那霉素TSB的平板上,72 h后观察菌落。将含有卡那霉素抗性的菌落在卡那霉素和氨苄青霉素的TSB平板上培养,进一步确认缺失突变株(具有卡那霉素抗性而无氨苄抗性)。将获得的缺失突变菌株在卡那霉素和氨苄青霉素的平板上传代20代,检验外源Kanr基因能否在突变株中稳定表达。
1.7 生长特性检测 为检测突变株生长力的变化,本实验取104cfu的M 28和M 28-ΔB0107接种于新鲜TSB液体培养基中,于特定时间(16 h、24 h、40 h、48 h、64 h、72 h)取少许菌液,涂板计数,绘制生长曲线。
1.8 小鼠体内致病性试验 将80只4周龄~5周龄雌性BALB/c小鼠,平均分2组。分别腹腔免疫M 28和 M28-ΔB0107,免疫剂量为 1×106cfu/只。分别在免疫后第1周、3周、6周、9周、12周时迫杀小鼠8只。无菌取脾脏称重,加入1 ML PBS匀浆。10倍系列稀释匀浆液,取100μL涂板计数。
1.9 巨噬细胞感染试验 于24孔板中培养RAW 264.7巨噬细胞,待其60%形成单层细胞。将M 28-ΔB0107及 M28按照 MOI=100接种 RAW 264.7细胞系,1 000 r/min离心10 Min,37℃吸附1 h。洗细胞,加入杀菌液(0.25%FBS、100μg/μL的gentam icin和 50μg/mL的 streptomycin),37℃作用30 Min。洗涤细胞,加入含10%FBS的DMEM 37℃维持培养。于接菌后24 h、48 h、72 h收取细胞,用1%Triton裂解细胞。涂板菌落计数。比较突变株与亲本M 28在感染过程中的繁殖数量来判定靶基因缺失对毒力造成的影响。
2 结 果
2.1 pSP-B0107-k转移载体构建及鉴定 将酶切片段L臂、Kanr表达盒、R臂依次连入pSP72构建重组转移质粒pSP-B0107-K。将pSP-B0107-K分别以相应的限制内切酶进行双酶切鉴定,依次得到约为 1 000 bp+4 800 bp, 1 250 bp+4 600 bp, 和1 000 bp+4 800 bp的片段(图 2A)。以 pSP-B0107-K为模板,以表1中所描述的引物,对L臂,Kanr,R臂通过PCR进行验证。结果显示,3条带依次显示约为1 000 bp,1 250 bp,1 000 bp(图1B)。均与预期的L臂,Kanr和R臂的长度相符。
2.2 突变菌株抗性筛选及PCR鉴定缺失 将pSP-B0107-K电转化于M 28布鲁氏菌中,经筛选培养获得到具有卡那霉素抗性的菌缺失株(M 28-ΔB0107),将其在卡那霉素和氨苄青霉素的平板上传代20代,结果显示外源Kanr基因能够在突变株中稳定表达。通过PCR(引物见表1)对M 28-ΔB0107进行缺失鉴定。结果表明,M 28菌株可以约得到1 230 bp的条带,与B0107的ORF长度一致,而M 28-ΔB0107突变株PCR泳道在约为1 230 bp处显示缺失,表明B0107基因ORF序列已删除(图2C)。
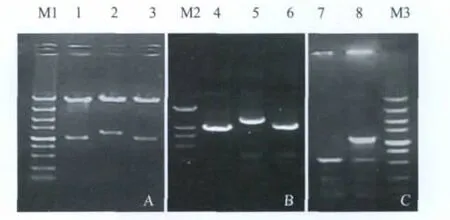
图2 pSP-B0107-K重组转移质粒及缺失菌株M 28-ΔB0107的鉴定Fig.2 Identification of plasmid pSP-B0107-K and mutant strain M28-ΔB0107
2.3 生长特性检测 于特定时间取出菌液涂板计数,结果如图3所示,M 28及M 28-ΔB0107生长曲线趋于一致。菌株间无明显差异,表明B0107属于布鲁氏菌的非必需基因。
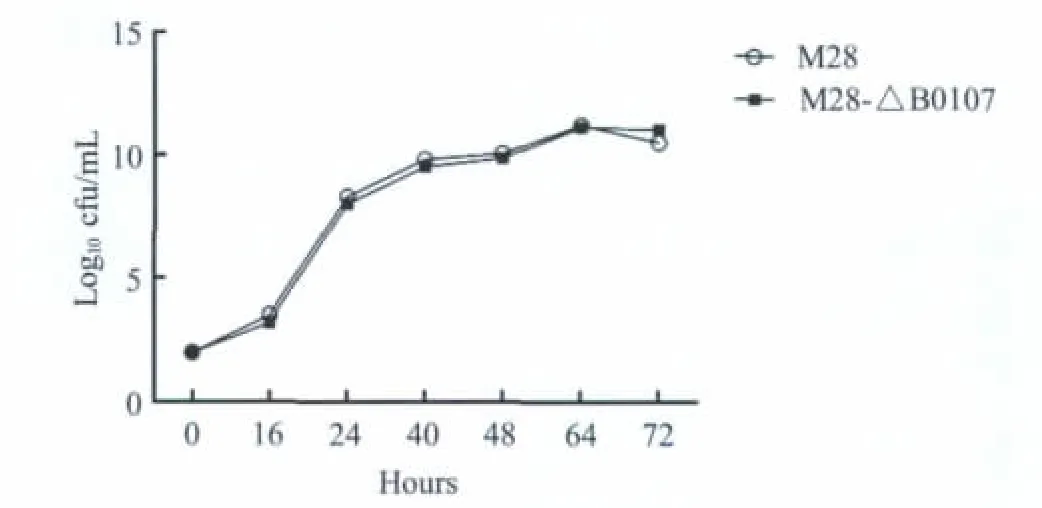
图3 突变株及其亲本株在液体培养基中的生长曲线Fig.3 Population dynam ics ofmutant strain and its parent strain
2.4 突变菌株小鼠体内毒力的测定 为了评估突变菌株毒力变化,体内增殖情况。将M 28-ΔB0107与M 28按每只小鼠1×106cfu剂量感染量免疫,比较脾脏分离细菌情况(图4)。研究表明,在第1周,亲本强毒株与M 28-ΔB0107很快定植到脾脏,在第3周,两组脾脏重量变化呈现高峰。但M 28强毒株组小鼠脾脏重量略高于M 28-ΔB0107,无显著差异。6周时,脾脏重量开始下降,病变减轻。M 28-ΔB0107组脾脏重量下降程度剧烈,t-test差异显著(p<0.05);M 28和M 28-ΔB0107脾脏分离菌数,于第1周达到高峰,而后缓慢减少,6周时,差异显著,M 28-ΔB0107菌落数量低于 M28株约 1个 Log,二者t-test差异显著(p<0.05)。
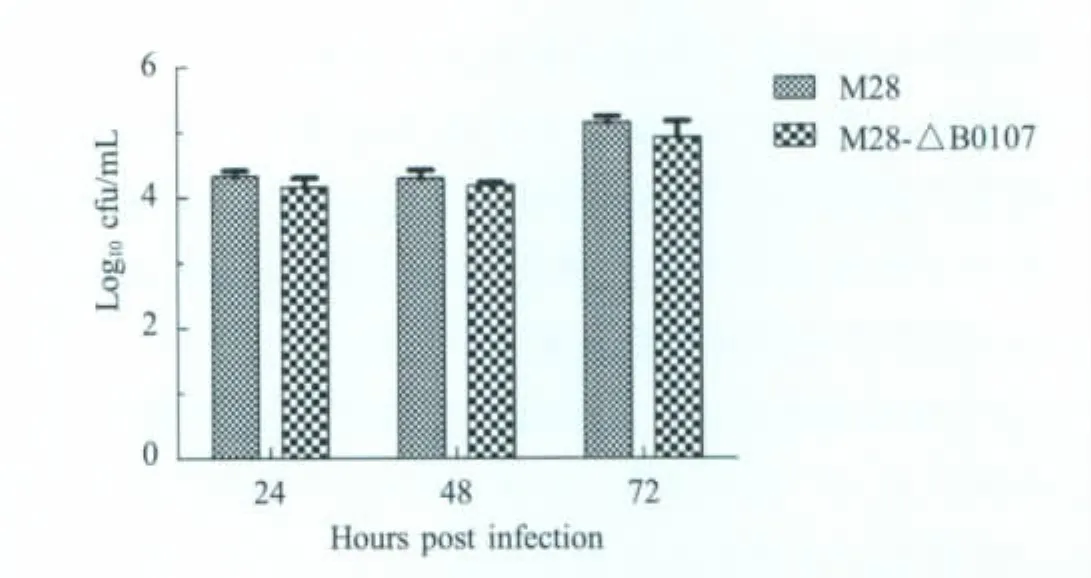
图5 突变株及其亲本株在RAW 264.7巨噬细胞中增殖情况Fig.5 Intracellular replication ofmutant strain and its virulent parent strain
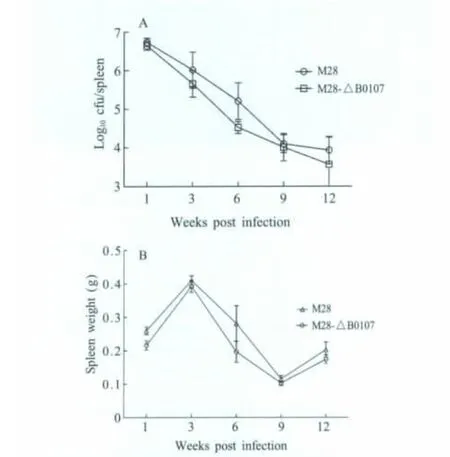
图4 M28-ΔB0107和M 28小鼠体内毒力实验中脾脏荷菌量(A)和脾脏重量变化(B)Fig.4 Bacterial counts in the spleen(A)and the change of spleen weight profiles(B)for M28 and mutant strain M28-ΔB0107 infected BALB/c Mice
2.5 巨噬细胞感染试验 将突变株M 28-ΔB0107与其亲本株M 28接种于24孔板,与24 h、48 h、72 h裂解涂板菌落计数。结果表明,突变株与强毒株均能够在RAW 264.7细胞中缓慢增长,侵入细胞数量均为每孔104cfu~106cfu,72 h达到峰值,与强毒株M 28相比,突变株细菌数量略显降低,p>0.05,差异不显著(图5)。
3 讨 论
革兰氏阴性细菌的O抗原合成过程分为3个阶段:核糖生物合成(Nucleotide sugar biosynthesis),糖类转运(Sugar Transfer)和O抗原加工(O-antigen Processing)[6]。磷酸甘露糖变位酶(pmm)参与核糖的生物合成过程,2004年,Ficht发现Pmm缺失突变株在小鼠感染试验中致病力显著下降,这表明Pmm在维持Brucella毒力方面起着重要作用[7]。转糖酶(Transglycosylase)参与O抗原合成中的糖类转运过程,Boyle等获得其突变株B.abortusRA1,证明B.abortusRA1在小鼠脾脏内部增值能力显著下降,表明参与O抗原合成中的糖类转运相关基因对于Brucella致病力的维持具有显著作用[8]。参与O抗原合成的第3阶段的包括O抗原聚合酶在内的诸多基因在布鲁氏菌毒力中的作用,尚无相关报道。本实验通过构建马耳他种M 28强毒株布鲁氏菌O抗原聚合酶突变株,并且测定其在小鼠模型中的毒力变化,阐明了O抗原聚合酶对于布鲁氏菌在宿主体内生存的作用,在革兰氏阴性细菌LPS合成相关基因O抗原聚合酶功能方面,填补了一项空白。
M 28-ΔB0107与M 28生长曲线趋于相同,表明B0107是布鲁氏杆菌的非必需基因,其缺失不会对菌体的生长产生显著影响。初步推断,用该方法构建的其他疫苗株的O抗原聚合酶缺失株既可以保留原有的生长特性,又可以具备抗性基因作为筛选标记。而将抗性基因换作其他保护性抗原,又可以使布鲁氏疫苗株具有新的免疫保护力,可用于改善现有疫苗和研发新型多用疫苗。
在小鼠致病性试验中,脾脏增重和脾内细菌增值情况表明,在一定程度上O抗原聚合酶基因的缺失对于布鲁氏菌致病力具有显著影响,其突变在M 5-90疫苗株的致弱过程中起到了一定作用。而差异最为显著时,M 28-ΔB0107菌落数量仅仅低于M 28株约1个Log,远远不及M 5-90疫苗株的致弱程度。并且,王方坤等在M 5-90和M 28感染的小鼠巨噬细胞转录组研究中发现,M 5-90中的众多突变基因中,与巨噬细胞感染相关基因的突变在M 5-90致弱过程中起着关键作用[9]。而在本实验中,M 28-ΔB0107与M 28对RAW 264.7感染能力无显著差异。这表明O抗原聚合酶的突变在M 5-90疫苗株致弱过程中起到了一定作用,但不是关键作用。关于M 5-90疫苗株的致弱机理,仍需进一步研究。
[1]张艳,陈创夫,张辉,等.布鲁氏菌M 5-90ΔWboA基因缺失株的构建及免疫效果的初步评价[J].中国预防兽医学报,2011,33(7):546-551.
[2]Porte F,Naroeni A,Ouahrani-Bettache S,et al.Role of thebrucella suislipopolysaccharide O antigen in phagosomal genesis and in inhibition of phagosome-lysosome fusion in murine macrophages[J].Infect Immun,2003,71(3):1481-1490.
[3]PeiJian-wu,Ficht T A.Brucella abortusrough mutants are cytopathic for macrophages in culture infect[J].Infect Immun,2004,72(1):440-450.
[4]Wang Fang-kun,Hu Sen,Bu Zhi-gao,et al.Complete genome sequences ofBrucella melitensisStrains M28 and M5-90,with different virulence backgrounds[J].J Bacteriol,2011,193(11):2904-2905.
[5]胡森,郑孝辉,王加兰,等.马耳它布氏杆菌bp26基因缺失株的构建及鉴定[J].中国预防兽医学报,2009,31:583-586.
[6]Samuel G,Reeves P.Biosynthesis of O-antigens:genes and pathways involved in nucleotide sugar precursor synthesis and O-antigen assembly[J].Carbohydr Res,2003,338(23):2503-2519.
[7]Allen C A,Adams L G,Ficht T A.Transposon-derivedBrucella abortusrough mutants are attenuated and exhibit reduced intracellular survival[J].Infect Immun,1998,66(3):1008-1016.
[8]M cquiston JR,Vemulapalli R,Inzana T J,et al.Genetic characterization of a Tn5-disrupted glycosyltransferase gene homolog inBrucella abortusand its effect on lipopolysaccharide composition and virulence[J].Infect Immun,1999:3830-3835.
[9]Wang Fang-kun,Hu Sen,Bu Zhi-gao,et al.Deep-sequencing analysis of the mouse transcriptome response to infection withBrucella Melitensisstrains of differing virulence[J].PLoS One,2011,6(12):e28485.
