果子狸源H5N1亚型禽流感病毒的分离及生物学特性鉴定
2013-08-30吴珊珊慈彦鹏刘丽玲田国彬曾显营陈化兰李雁冰
吴珊珊,王 飞,慈彦鹏,刘丽玲,田国彬,曾显营,陈化兰,李雁冰
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部动物流感重点开放实验室/国家禽流感参考实验室,黑龙江哈尔滨 150001)
禽流感(avian influenza,AI)是由正黏病毒科、流感病毒属的A型禽流感病毒(AIV)所引起的一种禽类感染或疾病综合征[1]。随着AIV的不断进化,其跨种属传播的能力不断增强,1997年暴发的香港H5N1亚型高致病性AIV(HPAIV)感染并致死人事件,引起了人们对其公共卫生学意义的高度重视[2]。H5N1亚型AIV对哺乳动物的感染能力、致病能力以及哺乳动物种间传播能力等方面的分子机制的研究成为近年来的研究热点[3-5]。
目前,HPAIV感染野生动物后病毒在自然界中的传播及其公共卫生意义的认识还不够深入,本实验通过对一株从野生动物果子狸体内分离的AIV分离株进行全基因序列测定及分析,并且对其进行了小鼠感染与致病性研究,为进一步研究流感病毒的跨物种传播机制奠定了基础。
1 材料和方法
1.1 病毒株、实验动物 H5N1亚型AIV分离株PC/GX/26/11(H5N1)分离自广西省靖西县野生动物果子狸体内,由国家禽流感参考实验室鉴定并保存;6周龄雌性SPF级BALB/c小鼠购自北京维通利华实验动物技术有限公司;动物试验在中国农业科学院哈尔滨兽医研究所动物生物安全三级实验室(ABSL-3)内进行。
1.2 主要试剂 RNA提取试剂TRIzol LS、鼠源反转录酶(M-MLV)、RNaseOUT购自Invitrogen公司;rTaqDNA聚合酶、DNA Marker(2000)购自宝生物工程(大连)有限公司;PCR产物纯化试剂盒购自上海华舜生物技术有限公司;测序反应试剂盒BigDye Terminator3.1购自Applied Biosystem公司。
1.3 病毒纯化、扩增 采用无菌PBS将病毒原液进行有限稀释,接种10日龄SPF鸡胚进行病毒纯化,连续纯化3代,将纯化后的病毒接种SPF鸡胚,进行病毒扩增,48 h后收获病毒,无菌分装并保存于-70℃。
1.4 序列测定和分析 提取病毒的基因组RNA,对其8个基因片段进行扩增,利用PCR产物纯化试剂盒回收PCR产物。按照Big Dye Term inator 3.1测序反应试剂盒说明书进行测序。利用DNAStar软件进行序列的拼接和分析,并对测序基因进行遗传衍化分析[3],用MEGA5.0绘制系统进化树。
1.5 对小鼠致病性试验及各脏器中病毒含量滴定测定病毒的EID50,将病毒做10倍倍比稀释,稀释度为106EID50/50μL~101EID50/50μL,将6周龄的SPF级BALB/c雌性小鼠随机分成6组,第一组8只,其余每组5只,经鼻腔接种途径接种50μL病毒悬液,连续观察14 d,并记录每天小鼠的死亡情况及存活小鼠的体重变化;另从第一组随机取出3只施以安乐死,无菌采集脑、脾、肾、肺脏及鼻甲骨,研磨、离心、收集上清,在鸡胚中进行病毒滴定,检测病毒在小鼠各组织中的复制。
2 结 果
2.1 病毒的序列测定与分析 将PC/GX/26/11(H5N1)分离株的8个基因节段测序,对每个基因进行比对分析(表1)。结果显示:其HA、NA、PA、NS基因节段与MD/VN/LBM 57/11(H5N1)具有很高的同源性,分别为99.6%、99.5%、99.2%、99.5%;PB2、PB1、M、NP 4个基因节段与人源 AIV HuB/1/10(H5N1)的同源性最高,分别为99.4%、99.0%、99.2%、99.5%。在HA蛋白水平上,HA切割位点附近的氨基酸序列为-RRRR-,符合HPAIV的特征。糖基化位点分析显示:PC/GX/26/11(H5N1)的HA蛋白中存在8个潜在糖基化位点,分别为aa26、aa 27、aa 39、aa 181、aa 209、aa 302、aa 500、aa 599。以H3亚型HA为模型比较该分离株HA受体结合位点氨基酸序列显示,该分离株存在的可能受体结合位点 分 别 为 Y98、 S136、 G143、 W153、 I155、 H183、 N186、E190、193RLYQ196、N197、K216、S221和225GQSG228(表 2)。对NA蛋白氨基酸序列分析发现,NA蛋白茎部aa 49~aa 68缺失20个氨基酸,与近年H5N1亚型AIV优势流行株缺失的特征相一致[5]。NA蛋白中含有 3个潜在的糖基化位点:88NSS90、146NGT148和235NGS237。血凝素结合位点为367SRSGFE372、400SGYS403和431PKE433。NS蛋白在aa 80~aa 84位发生缺失。M 2蛋白在发生了S31N耐药性突变(表3)。
表1 与PC/GX/26/11(H5N1)的8个基因片段同源性最高的病毒株Table 1 The reference strainsw ith themost homology to PC/GX/26/11(H5N1)

表2 HA蛋白氨基酸序列分析Table 2 The analysis of am ino acids in the HA

表3 NA、NS、M和PB2基因的氨基酸序列分析Table 3 The analysis of am ino acids in the NA,NS,M and PB2 genes
2.2 遗传进化分析 将PC/GX/26/11(H5N1)与各个分支具有代表性的参考病毒株进行同源性比较,并进行遗传衍化分析(图1),结果显示,该病毒属于Clade2.3.2分支,其8个基因节段与MD/VN/LBM 57/11(H5N1)及人源 AIV HuB/1/10(H5N1)有很高的同源性。
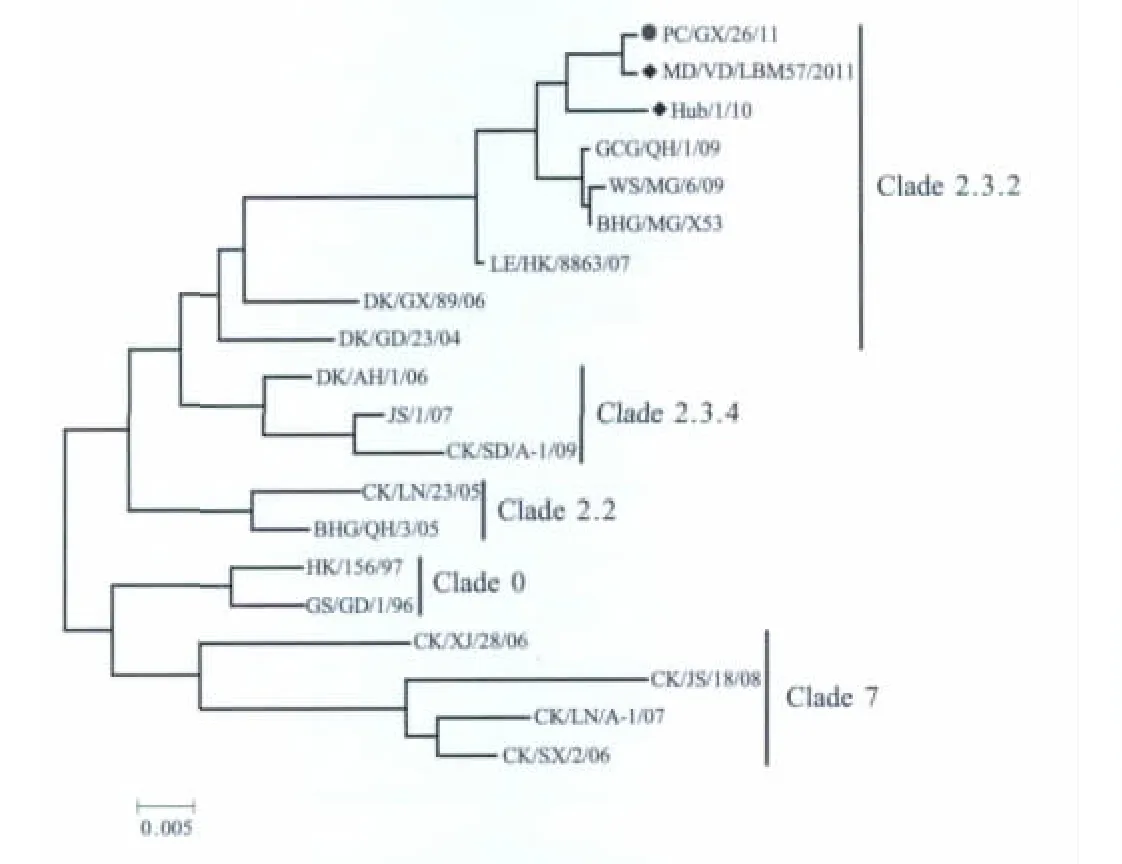
图1 H5亚型AIV HA基因核苷酸序列系统进化树Fig.1 Phylogenetic tree based on the sequence of the HA gene of PC/GX/26/11
2.3 对小鼠的致病性 小鼠通过鼻腔接种106EID50/50μL病毒后,平均体重呈先下降后又上升过程,小鼠存活率为60%(图2)。根据各组试验鼠死亡数量,计算 PC/GX/26/11(H5N1)的 MLD50为 4.9 log EID50,对小鼠呈中等致病力(图3)。
2.4 病毒在感染鼠脏器的复制 人工感染小鼠的脏器病毒滴定结果显示:感染72 h后,在小鼠的肺内和鼻甲骨中能够分离到高滴度的病毒(图4),分别达到4.6 log10EID50和3.8 log10EID50,而在脑中只检测到微量病毒,在脾和肾中有低含量的病毒复制。

图2 病毒鼻腔感染小鼠后体重变化Fig.2 Weight gains ofm ice post intranasal infection
图3 攻毒后小鼠的存活率Fig.3 Survive ofm ice post intranasal infection
3 讨 论

图4 病毒感染后第3 d脏器病毒复制Fig.4 Virus replication in tissues ofm ice at 3 days post infection
AIV为危害养禽业和人类健康的重要传染病原,由于H5亚型HPAIV的高发生病率和高死亡率受到人们的普遍关注[7]。其毒力是由多个基因决定的,HA基因占据着主导作用,病毒毒力高低与HA裂解位点氨基酸序列特征(种类和数量)有关[8]。HPAIV的HA蛋白裂解位点均具有4个~6个连续的碱性氨基酸,易被呼吸道和消化道上皮细胞中的丝氨酸蛋白酶裂解,从而引发全身性的感染而呈现高致病力;低致病力AIV的HA蛋白酶裂解位点一般只有1个碱性氨基酸,不易被蛋白酶所裂解。GX/PC/26/11(H5N1)的HA基因裂解位点附近存在4个连续的碱性氨基酸,因此易被小鼠组织细胞中的蛋白酶所裂解,病毒可以感染多种组织并进行复制和增殖。研究发现,AIV毒力的高低与NA基因茎部氨基酸的缺失与否也密切相关[6]。1997年前后分离的人和禽类H5N1代表性病毒株NA茎部均缺失19个氨基酸,2004年以后的病毒则有20个氨基酸的缺失。而2004年以后人感染HPAIV的数量剧增,表明AIV毒力的高低与NA基因茎部氨基酸的缺失与其毒力呈正相关[6]。对M基因氨基酸序列分析发现,在M 2蛋白发生了抗药性突变S31N,这与近年来分离到的H5N1 AIV出现的普遍现象一致[9],表明流感病毒在药物压力作用下,不断发生变异,形成适应环境的抗药性病毒株。
进化树分析该病毒属于Clade2.3.2分支,该分支病毒目前在我国南方活禽市场活跃,同时潜伏在散养家禽中,水禽及野鸟体内均分离到该分支病毒,而本实验室从果子狸体内分离到该分支的病毒,并且进化分析表明这株病毒的HA、NA、PA和NS基因节段与MD/Vietnam/LBM 57/11(H5N1)有很高的同源性;其他4个基因节段与人源AIV HuB/1/10(H5N1)的同源性最高,据此我们推测PC/GX/26/11可能是由MD/VN/LBM 57/11和HuB/1/10的基因重组得到的。
采用BALB/c鼠的感染试验评估该病毒对哺乳动物的感染与致病力,感染小鼠体重呈先下降后上升过程,病毒在感染第3 d小鼠的肺脏和鼻甲骨有较高滴度的存在,表明未经适应该病毒便能感染小鼠。
果子狸已被证实为SARS冠状病毒的主要宿主,本实验室于2011年在广西靖西县果子狸体内分离到一株HPAIV病毒,这显示健康果子狸等野生动物也有可能是重要病原的携带者,有必要加强对野生哺乳动物流感的监测。
[1]刘春国,刘明,张云,等.一株鹅源H5N2亚型高致病性禽流感病毒的分离鉴定及生物学特性分析[J].生物化学与生物物理进展,2009,36(1):65-71.
[2]Hatta M,Gao Peng,Halfmann P,et al.Molecular Basis for high virulence of Hong Kong H5N1 influenza A viruses[J].Science,2001,293(5536):1840-1842.
[3]Li Yan-bing,Shi Jian-zhong,Zhong Gong-xun,et al.Continued evolution of H5N1 influenza viruses in wild birds,domestic poultry,and Humans in China from 2004 to 2009[J].J Virol,2010,84:8389-8397.
[4]Maines T R,Chen Li-mei,Matsuoka Y,et al.Lack of transm ission of H5N1 avian-human reassortant influenza viruses in a ferretmodel[J].PNAS,2006,103(32)12121-12126.
[5]Gao Yu-wei,Zhang Ying,Shinya K,et al.Identification of am ino acids in HA and PB2 critical for the transm ission of H5N1 avian influenza viruses in a mammalian host[J].PLoS Pathogens,2009,5(12):e1000709.
[6]Liu J,Xiao H,Lei F,et al.Highly pathogenic H5N1 influenza virus infection in Migratory birds[J].Science,2005,309:1206.
[7]刘丽玲,李雁冰,施建忠,等.一株鸡源H6N1亚型禽流感病毒全基因的分子特征[J].中国预防兽医学报,2010,32(3):214-217.
[8]王飞,吴珊珊,慈彦鹏,等.H5N1亚型禽流感病毒A/Guangxi/1/2005株抗药机制的研究[J].中国预防兽医学报,2012,34(9):682-685.
[9]Dybing J K,Schultz-Cherry S,Swayne D E,et al.Distinct pathogenesis of Hong Kong-origin H5N1 viruses in mice compared to that of other highly pathogenic H5 avian influenza viruses[J].JVirol,2000,74(3):1443-1450.
