低氧下HIF-1α对小鼠性激素及睾丸生精细胞凋亡的影响*
2013-08-30陈香梅熊艳蕾徐成丽
陈香梅,熊艳蕾,龚 辉,徐成丽
(中国医学科学院基础医学研究所北京协和医学院基础学院,北京 100005)
随着越来越多的平原人进入高海拔地区旅游或工作,低氧对男性生殖系统的影响应得到重视。国外报道:进入5 200m高海拔低氧环境的9名男性登山员,经过7周的低氧暴露后其血浆睾酮水平显著下降[1]。6名男性暴露于2 000~5 600 m高海拔低氧环境26 d后,返回海平面地区时及1个月后其精子计数显著下降,精子畸形率显著升高;精子活率在返回海平面地区时未有显著变化,但1个月后精子活率显著下降[2]。这些由低氧引起的睾酮水平降低和精子各项指标异常均可导致男性不育。
HIF-1α在低氧条件下产生并作为蛋白调节因子与多种靶基因结合调节其转录活性,介导组织细胞产生一系列的缺氧适应性反应[3]。哺乳动物睾丸内精子的发生,存在自发的生精细胞凋亡,除正常精子发生过程中的生精细胞凋亡,在各种因素(激素回撤、热刺激、电离辐射、接触有毒物质等)刺激下也会诱导生精细胞凋亡增多,精子发生障碍。生精细胞凋亡在控制生精细胞数量上有重要作用。本文旨在探讨模拟海拔5 000 m低氧环境下,C57BL/6雄性小鼠睾丸HIF-1α对生精细胞凋亡和下丘脑-腺垂体-睾丸轴激素血清睾酮(testosterone,T)、游离睾酮(free testosterone,FT)、卵泡刺激素(follicle-stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)水平的调控作用。为了深入研究低氧环境引起男性机体睾酮水平下降和精子发育异常的机制,进行了本次实验。
1 材料与方法
1.1 建立低氧动物模型
80只SPF级18~22 g雄性C57BL/6小鼠(购自维通利华公司)随机分为低氧3、7、14和28 d组及对应的常氧组,每组10只。低氧各组小鼠饲养于SPF级动物室内的低压低氧舱(FLYDWC50-IC)中,升降速度为4~5 m/s达到模拟海拔5 000 m高度,每天除按时开舱打扫卫生、更换食物和水约40 min外连续低氧,光照12 h,自由进食进水。常氧组饲养于SPF级动物室内。
1.2 标本采集
分别于建模3、7、14和28 d后称重,取眼球血约1 ml,颈椎脱臼处死小鼠。血样品静止2 h,3 500 r/min离心15 min,收集上层血清,待测血清T、FT、FSH和LH激素浓度。取小鼠双侧睾丸称重,计算睾丸指数(睾丸指数=双侧睾丸重量/体重×100%);左侧睾丸液氮保存;右侧睾丸置于4%多聚甲醛中固定,石蜡包埋,制备连续切片。取小鼠右侧附睾,制备精子悬液。
1.3 ELISA法检测血清T,FT,FSH,LH浓度
用美国R&D公司小鼠睾酮(T)、游离睾酮(FT)、卵泡刺激素(FSH)和黄体生成素(LH)酶联免疫分析试剂盒,严格按照说明书操作检测激素浓度。
1.4 附睾精子悬液精子计数、精子活率及精子畸形率的检测
小鼠右侧附睾,置于1 ml 37℃生理盐水中,充分剪碎混匀,用200目滤网过滤,收集精子滤液。取精子滤液少许滴于载玻片上,高倍镜下随机镜检300个精子,精子活率=(运动精子数/300)×100%;取精子滤液推片做HE染色,高倍镜下随机镜检1 000个完整的精子,记录畸形精子数,精子畸形率=(畸形精子总数/1 000)×100%;取50 μ l精子滤液稀释16倍后,用细胞计数板计数悬液中的精子数。
1.5 TUNEL法检测睾丸生精细胞的凋亡指数(apoptosis index)
用德国Roche Applied Science公司TUNEL凋亡检测试剂盒(In Situ Cell Death Detection Kit,POD),严格按照说明书操作。细胞核有明显棕黄色着色即为阳性细胞,每组随机计数100个生精小管中阳性细胞个数和总细胞数,并计算凋亡指数(AI:每1 000个细胞中凋亡细胞的个数)。
1.6 Western blot检测睾丸HIF-1α的表达
β-actin(Subrray 公司 ,Sr25113)浓度 1∶1 000,HIF-1α(美国 Abcam,ab113642)浓度 1∶500,一抗均 4℃孵育过夜;HRP标记羊抗小鼠多克隆抗体(AbMax公司)浓度1∶4 000,室温孵育2 h。按增强化学发光试剂(ECL)的使用说明配制发光底物工作液,显影定影。用Image J软件对各蛋白条带进行灰度扫描,以内参蛋白β-actin为基准,计算HIF-1α的相对表达量。
1.7 统计学方法
2 结果
2.1 低氧对 C57BL/6小鼠血清T、FT、FSH、LH水平的影响
与对应的常氧组相比:低氧3 d组小鼠血清T、FT、FSH和LH水平显著升高(P<0.05);低氧7 d组小鼠血清T、FT、FSH和LH水平无显著变化;低氧14 d组小鼠血清T、LH水平显著下降(P<0.05),FT和FSH水平较常氧14 d组无明显下降;低氧28 d组小鼠血清T、FT、FSH和LH水平均较常氧28 d组无明显下降。与低氧3 d组相比,低氧7、14和28 d组小鼠血清T、FT、FSH和LH水平显著降低(P<0.05)。与低氧7 d组相比,低氧14 d组小鼠血清T显著降低(P<0.05)以及低氧28 d组小鼠血清LH显著降低(P<0.01)。与低氧14 d组相比,低氧28 d组小鼠血清FT和LH显著升高(P<0.05,表1)。
2.2 低氧对C57BL/6小鼠附睾精子计数、精子活率和精子畸形率的影响
与对应的常氧组相比:低氧3 d组附睾精子计数及精子活率无明显变化,低氧7和14 d组显著下降(P<0.05),低氧28 d组较常氧28 d组无明显下降;低氧各组附睾精子畸形率均显著升高(P<0.01)。与低氧3 d组相比,低氧7和 14 d小鼠附睾精子计数和精子活率均显著降低(P<0.01,表2)。低氧各组间小鼠附睾精子畸形率无显著变化。
2.3 低氧对C57BL/6小鼠睾丸形态的影响
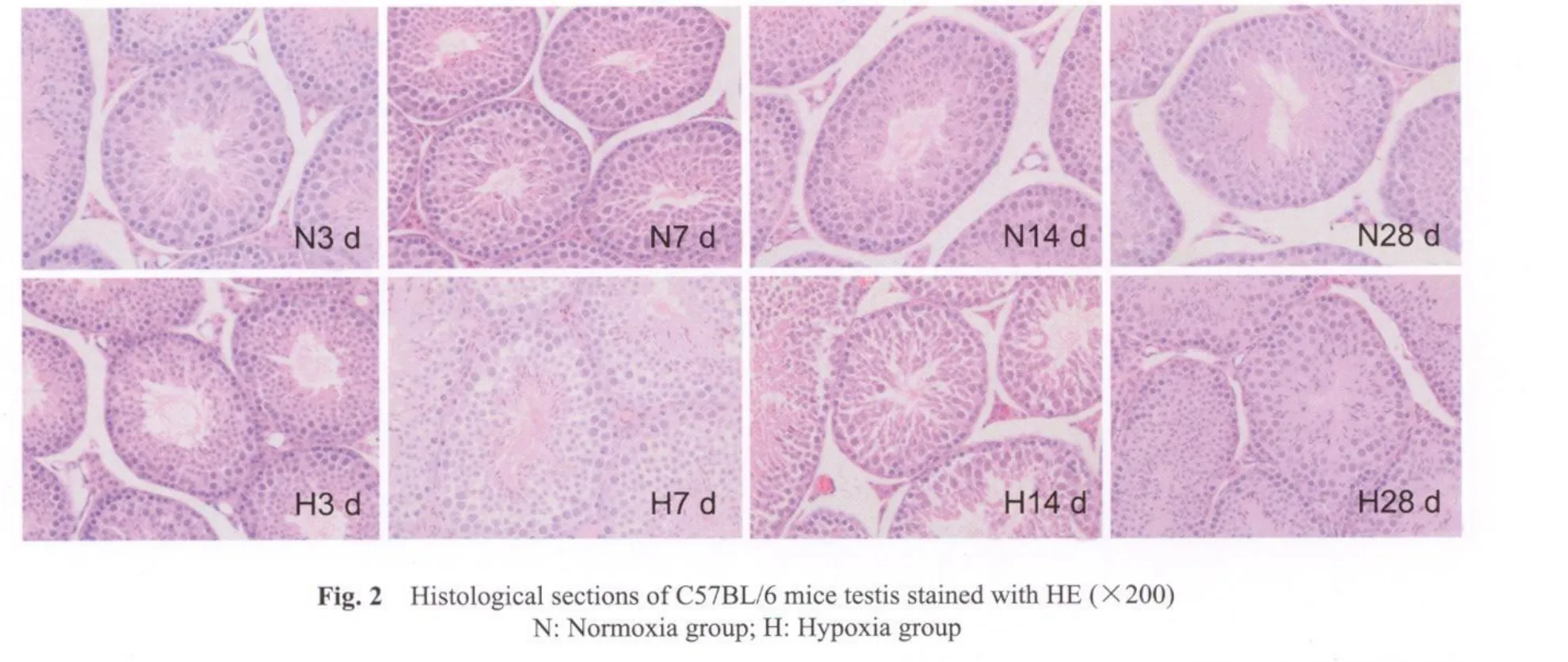
取材时见低氧各组睾丸外观呈红色充血状(图1见彩图页Ⅴ)。与对应的常氧组相比:低氧各组小鼠体重显著减少(P<0.05);低氧14和28 d组双侧睾丸重量显著下降(P<0.05);低氧3 d和7 d组睾丸指数显著升高(P<0.05),低氧14和28 d组睾丸指数较对应的常氧组无明显升高。与低氧3 d组相比,低氧各组小鼠体重显著增加(P<0.05);低氧14和28 d组睾丸指数显著降低(P<0.05)。与低氧14 d组相比,低氧28 d组小鼠体重显著增加(P<0.05,表3)。HE染色显示光镜下低氧各组间质血管扩张充血,部分区域有均匀红染的渗出液,间质水肿。低氧14 d组和28 d组生精小管出现生精上皮结构紊乱,管腔内精原细胞和精母细胞数量有不同程度的减少。低氧28 d组部分区域可见生精小管萎缩,生精细胞缺失(图2见彩图页Ⅴ)。

Tab.1 Comparison of C57BL/6 mice serum T,FT,FSH and LH level between hypoxia groups and normoxia groups(±s,n=10)

Tab.1 Comparison of C57BL/6 mice serum T,FT,FSH and LH level between hypoxia groups and normoxia groups(±s,n=10)
T:Testosterone;FT:Free testosterone;FSH:Follicle-stimulating hormone;LH:Luteinizing hormone;N:Normoxia group;H:Hypoxia group*P<0.05,**P<0.01 vs normoxia group;#P<0.05,##P <0.01 vs hypoxia group of 3 d;ΔP<0.05,Δ ΔP<0.01 vs hypoxia group of 7 d;▲P<0.05 vs hypoxia group of 14 d
Group T(nmol/l) FT(nmol/l) FSH(U/L) LH(pg/l)3 d N 34.40±7.93 2.73±0.73 2.93±0.72 318.9±82.1 H 51.19±10.32** 3.83±0.79* 4.01±0.88* 471.4±47.0**7 d N 32.15±11.18 2.62±1.10 2.89±0.74 289.3±44.0 H 31.78±8.49## 2.29±0.56## 3.00±0.68# 294.7±65.0##14 d N 32.48±9.58 2.27±0.72 3.13±0.65 284.3±65.0 H 25.14±3.25*##Δ 2.01±0.27## 2.82±0.51## 225.4±15.2*##Δ Δ 28 d N 31.85±10.14 2.60±0.93 3.21±0.76 317.0±63.0 H 28.61±5.04## 2.34±0.36##▲ 2.91±0.66## 279.7±76.2##▲
Tab.2 Comparison of C57/BL6 mice sperm count,motility rate and abnormal sperm rate between hypoxia groups and normoxia groups(±s,n=10)

Tab.2 Comparison of C57/BL6 mice sperm count,motility rate and abnormal sperm rate between hypoxia groups and normoxia groups(±s,n=10)
N:Normoxia group;H:Hypoxia group*P<0.05,**P<0.01 vs normoxia group;##P<0.01 vs hypoxia group of 3 d
Sperm motility rate(%)Abnormal sperm rate(%)Group Sperm count(×106)3 d N 8.73±0.69 15.86±2.71 0.48±0.15 H 8.54±1.39 17.07±3.48 1.07±0.21**7 d N 7.93±2.15 16.00±4.18 0.50±0.25 H 5.60±1.33*##11.53±4.14*##1.24±0.36**14 d N 8.74±1.98 17.08±4.68 0.42±0.16 H 5.53±0.87**##11.11±2.26*##1.28±0.38**28 d N 9.12±1.48 18.38±4.88 0.46±0.13 H 7.00±1.81 14.07±5.52 1.33±0.33**
Tab.3 Comparison of C57BL/6 mice body weight and both side testis between hypoxia groups and normoxia groups(±s,n=10)

Tab.3 Comparison of C57BL/6 mice body weight and both side testis between hypoxia groups and normoxia groups(±s,n=10)
N:Normoxia group;H:Hypoxia group*P<0.05,**P<0.01 vs normoxia group;#P<0.05,##P<0.01 vs hypoxia group of 3 d;△P<0.05 vs hypoxia group of 14 d
Group Body weight(g)Testisweight(g)Testisweight/body weight(%)3 d N 22.49±1.07 0.156±0.008 0.69±0.05 H 17.63±1.01** 0.148±0.019 0.84±0.08**7 d N 22.78±2.17 0.150±0.130 0.66±0.10 H 19.98±3.11*# 0.149±0.016 0.76±0.10*14 dN 23.77±0.80 0.164±0.016 0.69±0.08 H 19.46±1.33**##0.147±0.013*0.75±0.04#28 dN 24.58±1.35 0.180±0.009 0.73±0.03 H 21.51±1.98**##△0.160±0.015*0.75±0.08#
2.4 低氧对C57BL/6小鼠睾丸生精细胞凋亡的影响
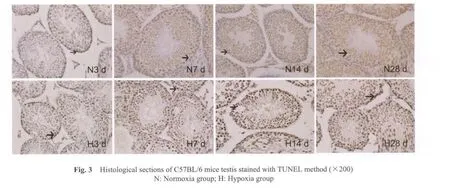
常氧组中仅有少量凋亡细胞位于生精小管基底膜附近,以精原细胞和初级精母细胞为主。与常氧组相比,低氧3 d组凋亡指数无显著变化;低氧7、14和28 d组凋亡指数显著升高(48.83±13.79vs84.50±12.50,114.00±19.05,71.67±12.13,P<0.05),凋亡细胞主要是精母细胞,也有少量圆形精子细胞凋亡。与低氧3 d组相比,低氧7、14和28 d组凋亡指数显著升高(52.83±13.29vs84.50±12.50,114.00±19.05,71.67±12.13,P<0.05)。与低氧7 d组相比,低氧14 d组凋亡指数显著升高(84.50±12.50vs114.00±19.05,P<0.05)。与低氧14 d组相比,低氧28 d组凋亡指数显著降低(114.00±19.05vs71.67±12.13,P<0.01,图 3,4图3见彩图页Ⅴ)。
2.5 低氧对C57BL/6小鼠睾丸HIF-1α表达的影响
与常氧组相比,低氧3 d组小鼠睾丸HIF-1α的蛋白表达水平无明显增加;低氧7、14和28 d组HIF-1α的蛋白表达水平明显升高(1.17±0.26vs1.38±0.20,1.65±0.27,1.71±0.29,P<0.05)。与低氧3 d组相比,低氧14和28 d组小鼠睾丸HIF-1α的蛋白表达水平显著升高(1.23±0.16vs1.65±0.27,1.71±0.29,P<0.05,图5)。

Fig.4 Apoptosis index of C57BL/6 mice testis after induction of hypoxia(±s,n=10)
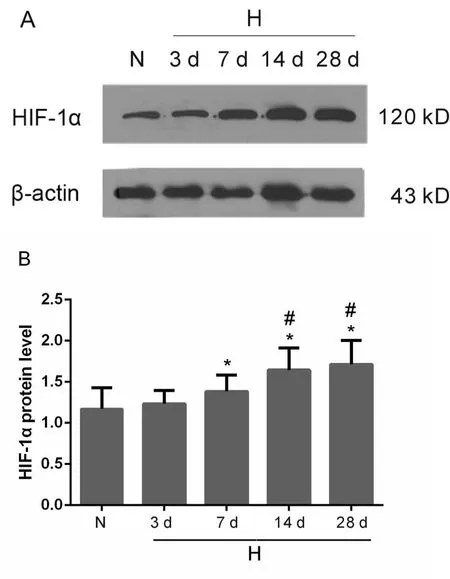
Fig.5 HIF-1αprotein expression level of C57BL/6mice testis after induction of hypoxia
2.6 性激素水平、精子各项参数、凋亡指数AI及HIF-1α表达之间的相关性分析
低氧3 d组HIF-1α的表达与T呈负相关(r=-0.999,P=0.035),其余指标之间无显著相关;低氧7 d组各指标之间无显著相关;低氧14 d组精子畸形率与AI呈正相关(r=0.933,P=0.007),其余指标之间无显著相关;低氧28 d组HIF-1α的表达与AI呈正相关(r=0.791,P=0.042),FT与精子活率呈正相关(r=0.680,P=0.044),其余指标之间无显著相关。
3 讨论
本研究采用低压氧舱模拟海拔5 000 m高原低氧环境,动态研究低氧对C57BL/6小鼠血清下丘脑-腺垂体-睾丸轴激素水平的影响。机体在高海拔急性低氧时睾酮增加,促进红细胞生成,血红蛋白增多提高氧的运输能力,与机体在高海拔地区习服与适应的过程紧密联系[4]。低氧3 d时,下丘脑-腺垂体-睾丸轴激素T、FT、FSH和LH释放增多,即急性低氧时小鼠呈应激状态,可能与机体有效适应急性低氧环境有关。随低氧时间延长机体持续高水平的睾酮会导致红细胞持续增多,降低动脉血氧饱和度,呼吸效率低下,降低通气量,最终导致慢性高原病,所以高水平的睾酮对于高海拔低氧的适应是不利的[4]。本研究显示随着低氧时间延长至14 d时小鼠下丘脑-腺垂体-睾丸轴激素水平都不同程度地降低,与机体有效适应高海拔低氧有关。国内也有研究表明模拟海拔5 000 m高原低氧30 d可抑制成年Wistar大鼠睾酮的分泌[5];模拟海拔3 000和5 000 m高原低氧14 d可抑制成年SD大鼠睾酮的分泌[6]。尽管如此,本研究低氧28 d组小鼠血清FT与精子活率呈正相关,表明慢性低氧时机体低水平的FT可导致精子活率下降,进而影响生殖功能。
低氧环境下机体低水平的性激素必然会影响睾丸的形态与功能。睾丸间质Leydig细胞分泌T后一部分入血,作用于远方的靶组织,参与对性行为的调节和雄性第二性征的维持;睾丸组织内的T作用于生精上皮,参与对精子发生的调节。在成年期,FSH和T协同作用于精原细胞,并维持生成精子的数量和质量,精子的发生主要受FSH和T这两个激素的调节。本研究发现低氧小鼠睾丸生精细胞凋亡增多,表明低氧环境下机体低水平的T和FSH可能参与了生精细胞的凋亡,影响了精子的生成。国内也有研究表明:低氧诱导成年Wistar大鼠睾丸生精细胞凋亡增多,慢性低氧(低氧30 d)引起的睾丸生精细胞凋亡增多与凋亡促进蛋白Bax表达增加有关[7]。
国外研究表明动物睾丸的微环境是相对低氧的,依据是(1)精子发生过程所需的氧耗量高,(2)睾丸组织增加血流量的调控能力较低,(3)睾丸中的氧分压相对较低[8,9]。低氧环境可进一步加重小鼠睾丸缺氧,正如本研究所示低氧各组小鼠睾丸肉眼观呈红色充血状,低氧各组睾丸指数不同程度增加,说明睾丸组织有不同程度的水肿;HE染色显示间质血管扩张充血,部分区域有均匀红染的渗出液,间质水肿。
低氧诱导因子-1(HIF-1)是由120 kD α亚单位和91-94kDβ亚单位组成的转录因子,作为组织缺氧的重要标志,可以上调细胞存活、生长、分化、及凋亡等基因的表达,以维持组织和细胞在缺氧条件下内环境的稳定,以适应缺氧。HIF-1α作为低氧应激蛋白,在组织低氧时表达增加。相关性分析表明低氧3 d组HIF-1α的表达与T呈负相关;随着低氧时间的延长HIF-1α表达逐渐增加,并维持在高水平状态,与低氧组小鼠睾丸生精细胞凋亡增多一致,表明低氧组小鼠睾丸HIF-1α的高表达可能也参与了生精细胞的凋亡,低氧28 d组HIF-1α的表达与AI呈正相关。在研究精索静脉曲张的大鼠模型中,睾丸血流瘀滞,组织发生变性,睾丸处于低氧状态,并且睾丸高表达HIF-1α,生精细胞凋亡增加,二者之间呈正相关[10]。上述均可以说明HIF-1α在睾丸组织低氧应激情况下,可能参与了生精细胞的凋亡。因此进一步的研究将会围绕HIF-1α在低氧环境下影响生精细胞凋亡的机制来展开。
[1]Benso A,Broglio F,Aimaretti G,et al.Endocrine and metabolic responses to extreme altitude and physical exercise in climbers[J].Eur J Endoc rinol,2007,157(6):733-740.
[2]Verratti V,Berardinelli F,DiGiulio C,et al.Evidence that chronic hypoxia causes reversible impairment onmale fertility[J].AsianJ Androl,2008,10(4):602-606.
[3]Bracken CP,Whitelaw ML,Peet DJ.The hypoxia-inducible factors:key transcriptional regulators of hypoxic responses[J].Cell Mol Life Sci,2003,60(7):1376-1393.
[4]Gonzales GF.Hemoglobin and testosterone:importance on high altitude acclimatization and adaptation[J].Rev Peru Med Exp Salud Publica,2011,28(1):92-100.
[5]廖卫公,高钰琪,蔡明春,等.低氧对雄性大鼠睾酮分泌及其合成相关蛋白和酶表达的影响[J].中华航空航天医学杂志,2006,17(03):191-195,242.
[6]章丽梅,潘安卿,胡健饶.慢性低氧对雄性大鼠血浆皮质酮及睾酮水平的影响[J].中国应用生理学杂志,2010,26(2):146-147,186.
[7]廖卫公,高钰琪,蔡明春,等.低氧对大鼠睾丸生殖细胞凋亡的影响[J].中华男科学杂志,2007,13(6):487-491.
[8]Setchell BP,Waites GM.Blood flow and the uptake of glucose and oxygen in the testis and epididymis of the ram[J].J Physiol,1964,171:411-425.
[9]Lysiak JJ,Kirby JL,Tremblay JJ,et al.Hypoxia-inducible factor-1alpha is constitutively expressed in murine Leydig cells and regulates 3beta-hydroxysteroid dehydrogenase type 1 promoter activity[J].J Androl,2009,30(2):146-156.
[10]Wang H,Sun Y,Wang L,et al.Hypoxia-induced apoptosis in the bilateral testes of rats with left-sided varicocele:a new way to think about the varicocele[J].J Androl,2010,31(3):299-305.
