重复性“饥饿/再投喂”对大鼠脂代谢及解偶联蛋白表达的影响*
2013-08-30冯彦红刘重斌赵惠玲王一龙陈锡文
吴 博,冯彦红,刘重斌,赵惠玲,王一龙,陈锡文△
(1.温州医学院实验动物中心,浙江温州 325035;2.石家庄市妇幼保健院,河北 石家庄 050091;3.湖州师范学院医学院生理教研室,浙江 湖州 313000)
解偶联蛋白(uncoupling protein,UCP)是一类位于线粒体内膜上的质子转运蛋白,通过消除线粒体膜电位,使底物氧化与ADP磷酸化脱偶联,减少ATP的合成,进而使能量以热能的形式释放[1]。由于UCP可能参与调节机体能量代谢,因此与肥胖发生发展的关系日益引起人们的关注。目前UCP已被列为肥胖症的候选基因[2]。研究表明,经过重复性“饥饿/再投喂”饲喂方式的处理,能激活大鼠体内瘦素(leptin)调节能量平衡以控制体重这一调节系统[3]。禁食及各种与脂代谢相关的激素水平的改变,是研究与能量代谢相关的UCP表达调控因素的有利实验条件。本研究通过观察经过重复性“饥饿/再投喂”处理大鼠摄取高脂食物(可以诱导正常鼠产生单纯性肥胖症)时,大鼠脂肪组织UCP2和肌肉组织UCP3的表达变化,旨在进一步探讨UCP对脂代谢的调节作用及其可能机制,为有效治疗肥胖提供实验依据。
1 材料与方法
1.1 材料
1.1.1 试剂 葡萄糖(Glucose)、游离脂肪酸(free fatty acid,FFA)测试盒,南京建成生物工程研究所;胰岛素(Insulin)放射免疫试剂盒,北京北方生物技术研究所;Trizol试剂盒,美国 Invitrogen公司;BcaBESTTM RNA PCR Kit Ver.1.1,大连宝生物工程有限公司;PCR引物合成,上海捷瑞生物工程有限公司;山羊抗大鼠UCP2、UCP3和GAPDH多克隆抗体,美国Santa Cruz公司;辣根过氧化物酶标记的兔抗山羊IgG,北京中杉金桥生物技术有限公司;BCA蛋白浓度测定试剂盒,碧云天生物技术研究所;ECL化学发光检测试剂盒,美国Thermo公司;其余试剂均为市售分析纯。
1.1.2 仪器 7600型全自动生化分析仪,日本日立公司;722型光栅分光光度计,上海精密科学仪器公司;SN-695B型智能放免γ测量仪,上海核所日环光电仪器有限公司;DU530型核酸蛋白测定仪,美国Beckman Coulter公司;PCR仪、凝胶成像仪和垂直板电泳槽、转移电泳槽,美国Bio-Rad公司。
1.2 动物分组与处理
SPF级健康雄性SD大鼠60只,体重180~220 g,由温州医学院实验动物中心提供,许可证号:SCNK(浙)2005-0019。将大鼠随机分为两组:实验组(repeated fasting and refeeding,RFR)25只,对其进行“重复性饥饿1天/再投喂1天,持续6周”的饲喂处理,隔天喂以基础饲料;对照组(control)35只,每天喂以基础饲料。第6周末,处死20只(RFR组和对照组各10只),RFR组剩余15只大鼠另6周改为每天喂以高脂饲料(10%猪油、2%胆固醇和88%基础饲料)(RFR-CF/HF),并将对照组剩余25只大鼠再随机分为两组,一组改用高脂饲料(HF,15只),另一组继续用基础饲料(CF,10只)喂养至12周。实验期间每周定时称量体重。第12周末,剔除RFR-CF/HF组和HF组体重增加位于各组后1/3的肥胖抵抗(dietary induced obesity resistant,DIO-R)大鼠10只 ,余30只处死。动物处死前禁食12 h,用10%水合氯醛(0.3 ml/100g bw)麻醉后固定。每只大鼠腹主动脉采血,分离血清和血浆,-20℃保存待测。于肝中叶剪下一小块肝组织,置10%福尔马林溶液中固定,用于形态学检测。同时留取睾周白色脂肪与后肢骨骼肌,迅速置液氮冻存,然后转入-80℃超低温冰箱保存,以备RNA抽提和免疫印迹。
1.3 血液指标检测
日立7600型全自动生化分析仪检测血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)的含量。采用比色法测定血清葡萄糖和游离脂肪酸。放免法检测血浆胰岛素的含量。所有操作均严格按照试剂盒说明书进行。
1.4 肝组织形态学检测
肝组织常规石蜡包埋切片,HE染色,光镜下观察肝脏形态的改变。
1.5 RT-PCR检测UCP2、UCP3 mRNA表达
采用Trizol法提取脂肪和肌肉组织总RNA,测定RNA浓度与纯度后逆转录成cDNA,-20℃保存备用。以适量反转录所得的cDNA为模板,在Taq DNA聚合酶催化下进行PCR扩增反应。UCP2引物序列:上游 5'-GAGAGTCAAGGGCTAGCGC-3',下游 5'-GCTTCGACAGTGCTCTGGTA-3',扩增片段 350 bp;UCP3引物序列:上游 5'-GTTGGACTTCAGCCATCAGAA-3',下游 5'-GTGGGTTGAGCACAGGTC-3',扩增片段418 bp;GAPDH引物序列:上游5'-AACTCCCTCAAGATTGTCAGCAA-3',下游 5'-ATGTCAGATCCACAACGGATACA-3',扩增片段316 bp。反应条件:95℃预变性5 min,95℃变性 30 s,56℃退火30 s,72℃延伸1 min,循环 35次,最后72℃延伸 10 min。PCR产物经1.5%琼脂糖凝胶电泳,凝胶成像及定量扫描,用Gel-Pro Analyzer分析软件进行图像分析,目的基因mRNA的相对含量以目的片段与相应GAPDH mRNA积分吸光度的比值表示。
1.6 Western blot检测 UCP2、UCP3蛋白表达
分别制备10%脂肪组织和肌肉组织匀浆,离心提取蛋白上清液。BCA法蛋白定量后将蛋白水平调成一致,加上样缓冲液100℃变性5 min,于10%聚丙烯酰胺凝胶上电泳分离蛋白后转至硝酸纤维膜上。用5%脱脂奶粉室温封闭2 h,一抗4℃孵育过夜,二抗室温孵育1 h后显影成像分析。目的蛋白的相对含量以目的蛋白条带与相应GAPDH条带积分吸光度的比值表示。
1.7 统计学处理
2 结果
2.1 体重变化比较
实验开始时,两组间体重无明显差别,随着喂养时间的推移,大鼠的体重差异逐渐增大。第6周末,RFR组体重显著低于对照组(P<0.01,表1)。实验期间,RFR-CF/HF组体重明显增加,并逐渐接近CF组。第12周末,RFR-CF/HF组体重仍显著低于HF组(P<0.01),而略高于CF组(P>0.05,表2)。
2.2 血液指标比较
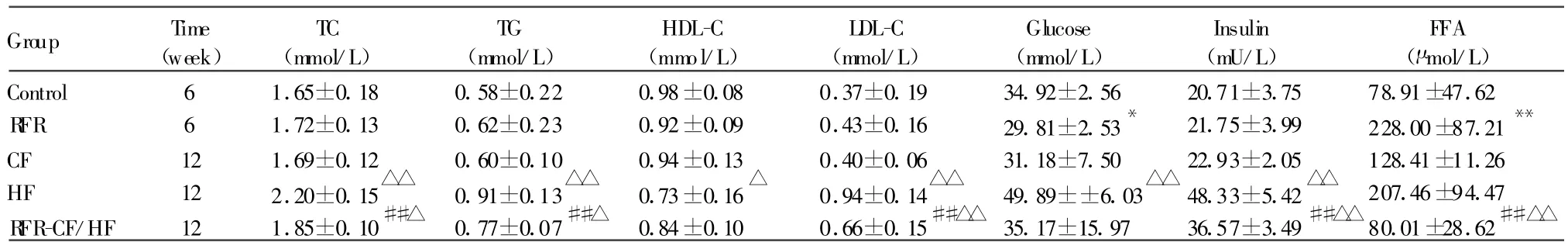
第6周末,RFR组血清葡萄糖含量显著低于对照组(P<0.05),FFA含量则显著高于对照组(P<0.01),但血脂、胰岛素水平与对照组相比无统计学差异(P>0.05)。第12周末,RFR-CF/HF组的血清TC、TG、LDL-C和血浆胰岛素含量均显著低于HF组(P<0.01),而显著高于 CF组(P<0.05),其中LDL-C含量差异更显著(P<0.01),FFA含量则显著低于HF和CF组(P<0.01),但HDL-C、葡萄糖含量与其他两组相比差异无统计学意义(P>0.05,表3)。
2.3 肝组织形态学改变
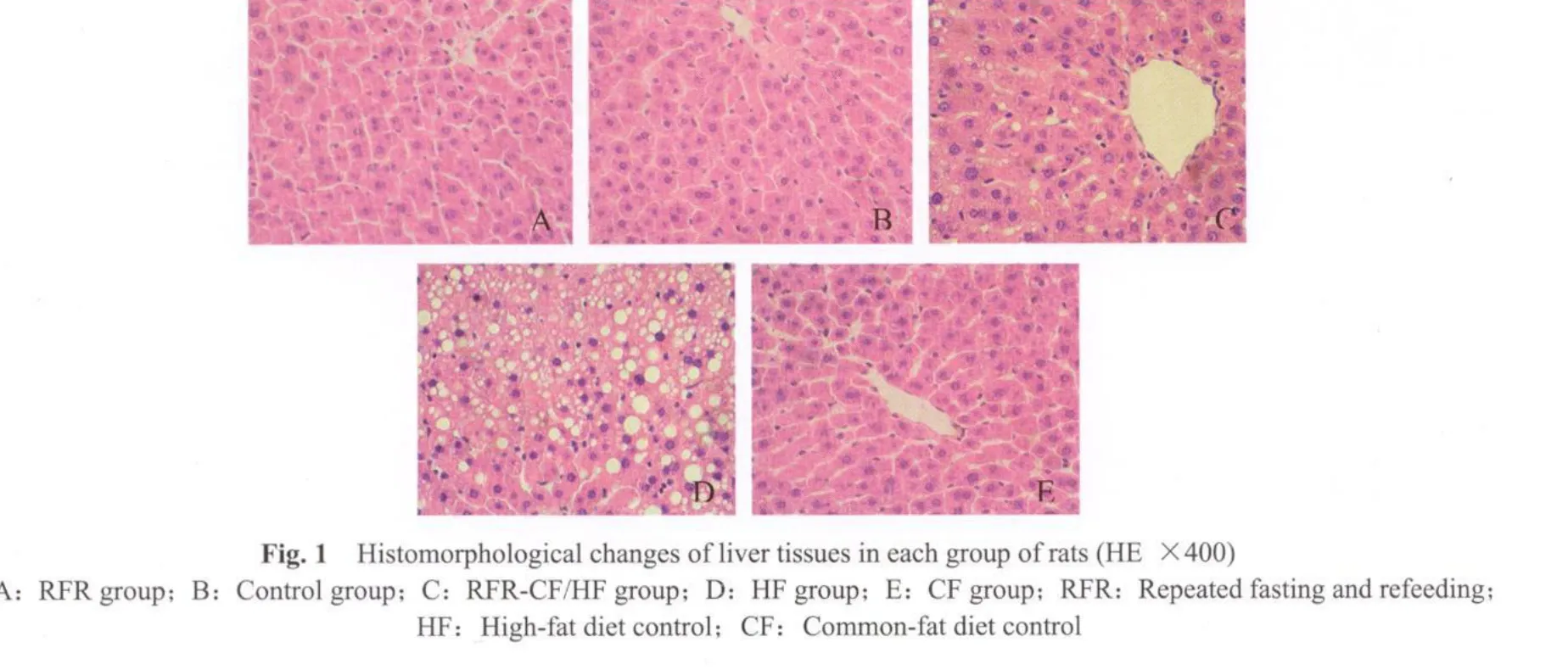
光镜下可见,RFR组、对照组和CF组肝脏组织结构完整,肝小叶清晰,肝细胞索排列整齐,细胞分界清,核圆而清晰,胞质丰富,无变性坏死、炎细胞浸润及纤维组织增生。HF组肝小叶结构破坏,肝索排列紊乱,肝细胞肿胀明显,并伴有水肿变性及空泡状变性,胞质内充满大量脂肪空泡,界限不清,其内细胞核固缩,颜色加深,小叶内和汇管区可见炎细胞浸润并伴有肝细胞坏死。RFR-CF/HF组肝细胞肿胀明显减轻,可见散在炎细胞浸润,肝细胞内偶有小脂滴,脂肪变性程度较HF组明显减轻(图1见彩图页Ⅲ)。
2.4 UCP2、UCP3 mRNA表达水平比较
第6周末,RFR组脂肪组织UCP2 mRNA表达水平显著高于对照组(P<0.05),肌肉组织UCP3 mRNA表达水平略高于对照组,但无统计学差异(P>0.05)。高脂干预6周后,RFR-CF/HF组UCP2、UCP3 mRNA表达水平均显著高于HF组(P<0.01),但显著低于CF组(P<0.01,图2)。
Tab.1 Comparison of body weight from the 1stweek to the 6thweek in each group of rats(g,±s,n=10)

Tab.1 Comparison of body weight from the 1stweek to the 6thweek in each group of rats(g,±s,n=10)
RFR:Repeated fasting and refeeding**P<0.01 vs control group
Group 1stday 7thday 13thday 19thday 25thday 31stday 37thday 43rdday Control 192.25±9.27 271.33±10.59 308.25±15.00 338.00±16.72 366.00±16.87 382.92±19.26 396.50±25.28 412.25±24.42 R FR 193.83±10.63 198.58±6.63** 214.62±10.22**227.25±12.64**232.83±14.27**238.75±15.52**247.00±14.80**251.17±15.54**
Tab.2 Comparison of body weight from the 7thweek to the 12thweek in each group of rats(g, ±s,n=10)

Tab.2 Comparison of body weight from the 7thweek to the 12thweek in each group of rats(g, ±s,n=10)
HF:High-fat diet control;CF:Common-fat diet control;RFR-CF/HF:Common-fat diet repeated fasting and refeeding+high-fat diet treatment**P<0.01 vs HF group;#P<0.05,##P<0.01 vs CF group
Group 6thweek 7thweek 8thweek 9thweek 10thweek 11thweek 12thweek CF 420.17±21.79 437.17±23.17 453.92±22.82 469.08±23.70 480.25±22.92 490.17±22.62 501.83±22.73 HF 422.67±22.15 452.58±24.16 482.67±30.42## 515.50±31.78## 545.42±32.66## 578.92±32.47## 594.17±33.10##R FR-CF/HF 255.58±11.07**##337.67±13.69**##391.17±16.34**##423.75±16.51**##452.50±21.94**#485.00±24.78** 503.50±25.78**
Tab.3 Comparison of serum lipids,glucose,FFA,and plasma insulin in each group of rats(±s,n=10)
Tab.3 Comparison of serum lipids,glucose,FFA,and plasma insulin in each group of rats(±s,n=10)
TC:Total cholesterol;TG:Triglyceride;HDL-C:High-density lipoprotein cholesterol;LDL-C:Low-density lipoprotein cholesterol;FFA:Free fatty acid;RFR:Repeated fasting and refeeding;RFR-CF/HF:Common-fat diet repeated fasting and refeeding+high-fat diet treatment;HF:High-fat diet control;CF:Common-fat diet control*P<0.05,**P<0.01 vs control group;##P<0.01 vs HF group;△P<0.05,△△P<0.01 vs CF group
Group Time(week)TC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)Glucose(mmol/L)Insulin(mU/L)FFA(μ mol/L)Control 6 1.65±0.18 0.58±0.22 0.98±0.08 0.37±0.19 34.92±2.56 20.71±3.75 78.91±47.62 R FR 6 1.72±0.13 0.62±0.23 0.92±0.09 0.43±0.16 29.81±2.53* 21.75±3.99 228.00±87.21**CF 12 1.69±0.12 0.60±0.10 0.94±0.13 0.40±0.06 31.18±7.50 22.93±2.05 128.41±11.26 HF 12 2.20±0.15△△ 0.91±0.13△△ 0.73±0.16△ 0.94±0.14△△ 49.89±±6.03△△ 48.33±5.42△△ 207.46±94.47 R FR-CF/HF 12 1.85±0.10##△ 0.77±0.07##△ 0.84±0.10 0.66±0.15##△△ 35.17±15.97 36.57±3.49##△△80.01±28.62##△△
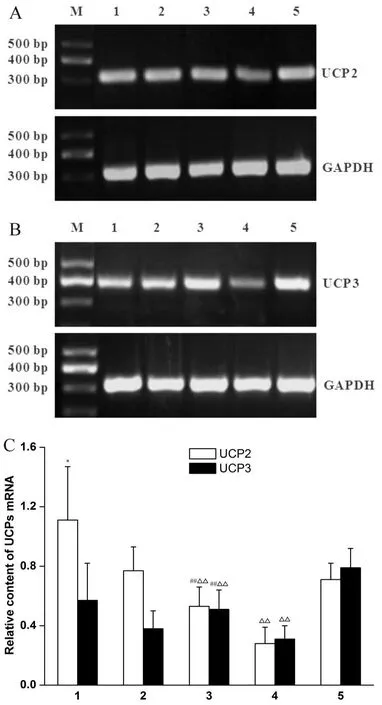
Fig.2 Analysis of content of uncoupling protein 2(UCP2)and uncoupling protein 3(UCP3)mRNA in each group of rats
2.5 UCP2、UCP3蛋白表达水平比较
第6周末,RFR组脂肪组织UCP2和肌肉组织UCP3的蛋白表达水平均显著高于对照组(P<0.05)。高脂干预 6周后,RFR-CF/HF组UCP2、UCP3蛋白表达水平均显著高于HF组(P<0.05),但显著低于CF组(P<0.05,图3)。
3 讨论
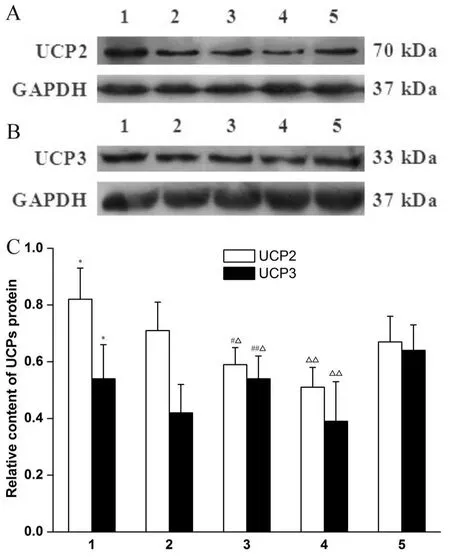
Fig.3 Analysis of content of uncoupling protein 2(UCP2)and uncoupling protein 3(UCP3)protein in each group of rats
机体能量摄入与消耗的精细平衡是维持正常体重的关键,而UCP作为一种线粒体转运蛋白,其作用是将H+从线粒体内膜渗漏到线粒体基质中,减少ATP的合成并产生热量[4],从而在调节产热和能量代谢方面发挥重要作用。根据基因序列的同源性已发现五种解偶联蛋白,分别为UCP1、UCP2、UCP3、UCP4和UCP5,其中UCP2、UCP3已被证实在体内主要发挥产热作用。动物实验研究发现,老龄大鼠UCP2表达减少,产热减少[5]。在UCP3基因敲除的小鼠,肌肉组织产生的质子漏降低,产生的热量减少[6]。UCP2和UCP3其他的作用包括:控制ROS的产生、调节脂肪组织的代谢等作用,并且与基础代谢率、肥胖和糖尿病密切相关。游离脂肪酸近年来被认为可能是一种调节脂代谢的信号因子[7],UCP可能具有氧化脂肪酸的功能,也有可能是脂肪酸氧化的载体。因此,我们推测UCP的表达与脂代谢存在一定的关联,其表达上调可介导脂质跨膜转运,降低游离脂肪酸酯化,并减轻蓄积脂质的细胞毒性作用。
重复性“饥饿/再投喂”是一种能使机体对重复的代谢性应激产生适应性反应的独特实验方法。经过这种饲喂方式处理的大鼠,血清游离脂肪酸、脂肪组织UCP2和肌肉组织UCP3基因及蛋白的表达水平均明显升高,这与文献报道一致[8]。我们推断,经过重复性饥饿1 d/再投喂1 d的饲喂处理后,长时间的摄食不足导致体内血糖降低,机体需要的能源物质不足,组织开始以脂肪作为主要的能源物质,脂肪经脂肪酶的水解作用分解出脂肪酸和甘油,血清中游离脂肪酸和酮体的含量升高;同时血糖降低时,胰高血糖素、促肾上腺糖皮质激素和促甲状腺激素分泌增加[9],作用于脂肪细胞膜表面受体,激活腺苷酸环化酶,使细胞内cAMP的含量增加,激活依赖cAMP的蛋白激酶,使激素敏感性脂肪酶活化,增强脂肪动员,从而使血糖维持在正常水平。机体组织再利用脂肪作为能源底物,氧化分解产生大量的H+,刺激UCP2表达升高,质子泄漏增加,ADP磷酸化合成ATP效率下降,氧化与磷酸化脱偶联而产生热量,ATP生成减少,能量消耗和产热增多。肌肉组织作为大鼠体内耗氧量最高的组织,其能量供应以氧化脂肪酸为主。血清中FFA含量的升高,同时亦可刺激肌肉组织UCP3的表达。
本实验室前期研究发现,高脂饮食干预后,RFR-CF/HF组大鼠在恢复正常给食初段摄食量和体重迅速增加,之后摄食量开始减少,体重趋于稳定,体重增加量明显超过HF组,血清血浆促肾上腺皮质激素和生长激素水平显著升高,表现出旺盛的生长和发育态势[9]。本实验结果显示,RFR-CF/HF组大鼠血糖水平趋于正常,血清TC、TG、LDL-C、FFA含量及肝组织脂肪变性程度等各种指标亦低于后者,表明高脂饮食引起的肥胖程度得到了一定程度的减轻。同时已有动物研究显示继饥饿之后再得到食物,血清游离脂肪酸的含量下降,肌肉组织UCP2和UCP3的表达升高[10],这与本实验结果相符合。此外,高脂饮食导致RFR-CF/HF组大鼠较CF组血清胰岛素分泌增加,脂肪分解作用抑制,脂肪动员、血清游离脂肪酸含量及组织对脂肪酸的利用均减少,大鼠脂肪组织UCP2和肌肉组织UCP3基因及蛋白的表达水平均明显降低,从而使能量消耗和产热减少。
综上所述,重复性“饥饿/再投喂”可减轻高脂饮食诱导的肥胖程度,增加大鼠脂肪组织UCP2和肌肉组织UCP3基因及蛋白的表达,上调由肥胖引起的质子泄漏,提高大鼠的基础能量代谢率。UCP作为能量代谢级联反应的最后分子组成部分,通过与机体能量平衡调节中枢的多种内分泌因子相互作用而共同调节大鼠脂代谢,但其具体的调节机制尚有待进一步探讨。
[1]贺晓丽,张丹参,杜冠华.解偶联蛋白与神经系统疾病的研究进展[J].中国药理学通报,2008,24(3):281-284.
[2]Rankinen T,Zuberi A,Chagnon YC,et al.The human obesity gene map:the 2005 update[J].Obesity(Silver Spring),2006,14(4):529-644.
[3]Kim YW,Scarpace PJ.Repeated fasting/refeeding elevates plasma leptin without increasing fat mass in rats[J].Physiol Behav,2003,78(3):459-464.
[4]吴德红,王凤杰,邓 娟,等.黄芪多糖对实验性2型糖尿病大鼠肝脏组织中解耦联蛋白2表达的影响[J].现代中西医结合杂志,2009,18(29):3552-3554.
[5]Andrews ZB,Liu ZW,Walllingford N,et al.UCP2 mediates ghrelin's action on NPY/AgRP neurons by lowering free radicals[J].Nature,2008,454(7206):846-851.
[6]Collin A,Cassy S,Buyse J,et al.Potential involvement of mammalian and avian uncoupling proteins in the thermogenic effect of thyroid hormones[J].Domest Anim Endocrinol,2005,29(1):78-87.
[7]Schrauwen P,Hesselink M.Uncoupling protein 3 and physical activity:the role of uncoupling protein 3 in energy metabolism revisited[J].Proc Nutr Soc,2003,62(3):635-643.
[8]Samec S,Seydoux J,Russell AP,et al.Skeletal muscle heterogeneity in fasting-induced upregulation of genes encoding UCP2,UCP3,PPARgamma and key enzymes of lipid oxidation[J].Pflugers Arch,2002,445(1):80-86.
[9]吴 博,杜友爱,刘重斌,等.重复性“饥饿/再投喂”对大鼠体重控制与能量平衡调节的影响[J].卫生研究,2010,39(5):601-605.
[10]Van der Lee KA,Willemsen PH,Samec S,et al.Fastinginduced changes in the expression of genes controlling substrate metabolism in the rat heart[J].Lipid Res,2001,42(11):1752-1758.
