番茄红素对帕金森模型小鼠氧化应激损伤及神经行为的影响*
2013-08-30刘重斌潘慧斌丁启峰陆峰彬
刘重斌,王 瑞,潘慧斌,丁启峰,陆峰彬
(1.湖州师范学院医学院生理与药理学教研室,浙江湖州313000,2.温州医学院基础医学院生理教研室,浙江温州 325035)
帕金森病(Parkinson'disease,PD)在病理上表现为黑质致密区多巴胺(dopamine,DA)神经元变性、丢失,胶质增生,胞浆内出现特征性嗜酸性包涵体即路易体(lewy bodies,LBs),而α-突触核蛋白 (α-synuclein,α-SYN)是LBs的主要成分[1-2]。PD 发病与氧化应激、线粒体功能障碍及α-SYN异常有关[3]。因此,减轻氧化应激损伤可作为药物作用靶点之一用于神经保护药物的筛选。一些天然的抗氧化剂如茶多酚(tea polyphenols)、姜黄素(curcumin)和白藜芦醇(resveratrol)的研究表明对 PD具有一定的保护作用[4-5]。番茄红素(lycopene,LP)是类胡萝卜素的一种,有极强的清除自由基能力,能预防和修复动脉粥样硬化、前列腺和胸腺癌等癌症带来的氧化应激损伤[6]。本研究旨在利用鱼藤酮诱导的帕金森病小鼠模型,探讨番茄红素对小鼠黑质致密区和纹状体神经元的保护作用及可能机制,为开发具有抗P D作用的天然药物提供初步实验依据。
1 材料与方法
1.1 试剂与仪器
1.1.1 试剂 鱼藤酮(rotenone)和二甲基亚砜(DMSO)购自Sigma公司,玉米油购自山东鲁花集团有限公司,番茄红素购自ToxSoms公司,鼠α-SYN单克隆抗体、SABC免疫组织化学试剂盒购自武汉博士德公司,鼠酪氨酸羟化酶(tyrosine hydroxylase,TH)单克隆抗体、兔微管相关蛋白轻链3(microtubule-associated protein 3 light chain,LC3-B)多克隆抗体购自碧云天生物技术公司,丙二醛(malondialdehyde,MDA)含量及超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和过氧化氢酶(catalase,CAT)试剂盒购自南京建成生物工程有限公司。其余试剂均为国产市售分析纯。
1.1.2 仪器 SpectraMax M2酶标仪(Molecular Devices公司);WMT-200水迷路视频分析系统(成都泰盟科技有限公司)。Nikon SIM显微镜及NIS-Elements图像分析系统(德国尼康公司)。
1.2 实验动物分组和处理
成年雄性C57BL/6小鼠40只,体重25.4~28.2 g,由中科院上海实验动物中心提供,动物使用许可证号:浙 22-005234。小鼠按体重随机分为空白对照、鱼藤酮、番茄红素、番茄红素+鱼藤酮共4组(n=10)。鱼藤酮先溶于极低体积的DMSO,然后溶于玉米油(配成2 mg/ml油溶液)。鱼藤酮组每日于颈背部皮下注射鱼藤酮油溶液(3 mg/kg小鼠体重)[7-8],空白对照组于颈背部皮下注射等体积的玉米油(含相应体积的DMSO),番茄红素组每日灌胃番茄红素(10 mg/kg小鼠体重,灌胃前先溶于等体积的玉米油),番茄红素+鱼藤酮组每日于颈背部皮下注射鱼藤酮,同时灌胃番茄红素[3]。实验期间所有小鼠自由饮食和饮水,温度22~25℃,相对湿度60%~70%。每日观察动物一般状态表现并记录动物行为变化,持续5周。
1.3 WMT-200水迷路
WMT-200水迷路视频分析系统采用计算机视觉相关算法,实时跟踪动物的行为状态,并分析和记录动物入水后搜索目标所需的时间、采取的策略和游泳的轨迹。实验程序包括:(1)定位航行实验:实验前将小鼠置于站台上适应20 s,随后将小鼠随机从不同象限面壁置入池内,小鼠登上站台5 s后终止记录,最长记录时间为30 s(若30 s内不能上台,引导小鼠登上站台适应10 s,最后将小鼠擦干放人鼠笼)。如此将小鼠置入游泳池,3次为 1组,分别测量四组小鼠平均逃逸时间,以评价其空间学习能力。在实验处理后第2、3、4和5周重复上述步骤。(2)空间探索实验:定位航行1 d后撤除水面下的站台,然后将小鼠随机从不同象限内壁置入池内5次。每次记录小鼠在30 s内的游泳轨迹,并测量小鼠在靶象限的活动时间,以评判小鼠的空间记忆能力。在实验处理后的第2、3、4和5周重复进行空间探索实验。
1.4 氧化应激指标检测
5周行为检测后,采用脱颈法迅速断头取脑,在冰面上迅速分离出中脑黑质和纹状体,玻璃匀浆器制成 10%组织匀浆,-80℃冰箱保存。实验时用Braford法定量蛋白,按照试剂盒说明书,采用化学比色法检测脑组织中SOD、GSH-Px、CAT活性及MDA含量。
1.5 免疫组织化学染色
分别切取中脑黑质和纹状体组织,投入4℃4%多聚甲醛中固定24 h,石蜡包埋,连续做冠状切片(厚5 μ m)。切片经消除内源过氧化物酶活性、抗原修复、PBS冲洗后,分别加入鼠TH单克隆抗体(1∶200)、鼠α-SYN 单克隆抗体(1∶100)、兔 LC3-B多克隆抗体(1∶300)4℃孵育过夜。PBS冲洗后,采用SABC免疫组织化学试剂盒室温孵育30 min。切片经PBS冲洗、DAB显色、脱水、透明、封固后于显微镜下观察并摄影。每只小鼠随机选取5张切片,每张切片随机选取4个视野,在同一视场面积,同一放大倍数,同一背景光强度下采集图像。采用NIS-Elements图像分析系统软件统计TH、α-SYN、LC3-B免疫阳性神经元数量。
1.6 统计方法
2 结果
2.1 一般状态表现和体重变化
鱼藤酮组小鼠从实验开始第10天出现精神萎靡,活动缓慢,毛发松散而无光泽,食欲明显减退,第16天开始相继出现身体屈曲,运动减少,时而伴有强直、震颤表现,显示帕金森的典型行为特征,表明帕金森病小鼠造模成功[3]。其余3组小鼠未出现身体屈曲,运动减少,强直、震颤表现。对各组小鼠每日体重测量发现,鱼藤酮组小鼠体重增长较其它各组缓慢,但组间比较均无显著性差异(P>0.05,图1)。
2.2 氧化应激指标
2.2.1 小鼠中脑黑质氧化应激指标 鱼藤酮组小鼠MDA含量显著高于空白对照和番茄红素组(P<0.05,表1),而鱼藤酮+番茄红素组小鼠MDA含量显著低于鱼藤酮组 (P<0.05)。鱼藤酮组小鼠GSH-Px、SOD、CAT酶活力显著低于空白对照和番茄红素组(P<0.05),而鱼藤酮+番茄红素组小鼠GSH-Px、SOD、CAT酶活力显著高于鱼藤酮组(P<0.05)。其他组间比较没有显著性差异(P>0.05)。
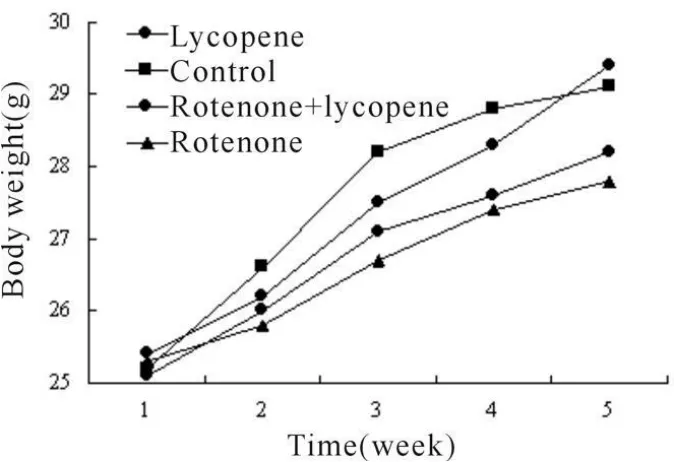
Fig.1 Curve graphfor body weight changes in each group ofmice(±s,n=10)
Tab.1 Effect of lycopene on lipid peroxidation and antioxidant defense in the substantia nigra of rotenone treated mice(±s,n=10)
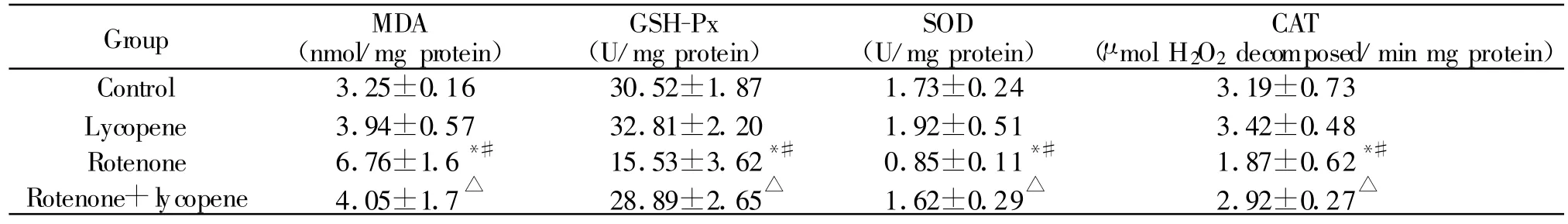
Tab.1 Effect of lycopene on lipid peroxidation and antioxidant defense in the substantia nigra of rotenone treated mice(±s,n=10)
MDA:Malondialdehyde;SOD:Superoxide dismutase;GSH-Px:Glutathione peroxidase;CAT:Catalase*P<0.05 vs control group;#P<0.05 vs lycopene group;△P<0.05 vs rotenone group
Group MDA(nmol/mg protein)GSH-Px(U/mg protein)SOD(U/mg protein)CAT(μ mol H2O2decomposed/min mg protein)Control 3.25±0.16 30.52±1.87 1.73±0.24 3.19±0.73 Lycopene 3.94±0.57 32.81±2.20 1.92±0.51 3.42±0.48 Rotenone 6.76±1.6*# 15.53±3.62*# 0.85±0.11*# 1.87±0.62*#Rotenone+lycopene 4.05±1.7△ 28.89±2.65△ 1.62±0.29△ 2.92±0.27△
2.2.2 小鼠右侧纹状体氧化应激指标 鱼藤酮组小鼠MDA含量显著高于空白对照和番茄红素组(P<0.05,表2),而鱼藤酮+番茄红素组小鼠MDA含量显著低于鱼藤酮组(P<0.05)。鱼藤酮组小鼠GSH-Px和SOD酶活力显著低于空白对照和番茄红素组(P<0.05),而鱼藤酮+番茄红素组小鼠GSHPx和SOD酶活力显著高于鱼藤酮组(P<0.05)。CAT酶活力在各组间比较没有显著性差异(P>0.05)。
Tab.2 Effect of lycopene on lipid peroxidation and antioxidant defense in the right striatum of rotenone treated mice(±s,n=10)
MDA:Malondialdehyde;SOD:Superoxide dismutase;GSH-Px:Glutathione peroxidase;CAT:Catalase*P<0.05 vs control group;#P<0.05 vs lycopene group;△P<0.05 vs rotenone group
Group MDA(nmol/mg protein)GSH-Px(U/mg protein)SOD(U/mg protein)CAT(μ mol H2O2decomposed/min/mg protein)Control 19.76±1.52 735.22±41.55 41.58±7.29 4.24±1.49 Lycopene 20.71±0.97 706.77±32.89 43.76±8.49 4.61±1.51 Rotenone 29.39±4.25*# 605.09±53.11*# 28.87±12.37*# 3.28±0.65 Rotenone+lycopene 21.05±1.84△ 728.56±44.57△ 37.98±10.35△ 3.02±0.82
2.3 水迷路神经行为分析
实验处理后第2、3、4和5周末,分别测量小鼠平均逃逸时间显示(图2),鱼藤酮组小鼠在第3周末平均逃逸时间显著高于空白对照和番茄红素组(P<0.05),第4和5周末差异极显著(P<0.01)。而鱼藤酮+番茄红素组小鼠在第4和5周末平均逃逸时间显著低于鱼藤酮组(P<0.05)。测量各组小鼠在靶象限活动时间显示(图3),鱼藤酮组小鼠在第3周末靶象限活动时间显著高于空白对照和番茄红素组(P<0.05),第4和5周末差异极显著(P<0.01)。而鱼藤酮+番茄红素组小鼠在第4和5周末的靶象限活动时间显著低于鱼藤酮组(P<0.05)。其他组间比较没有显著性差异(P>0.05)。
2.4 TH、α-SYN和 LC3-B免疫阳性反应比较
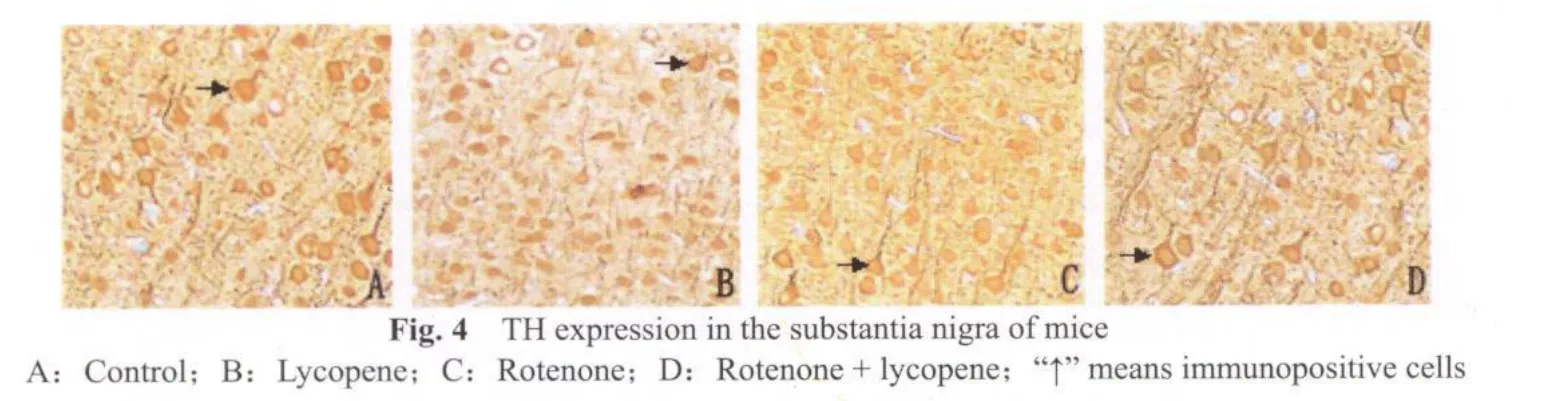
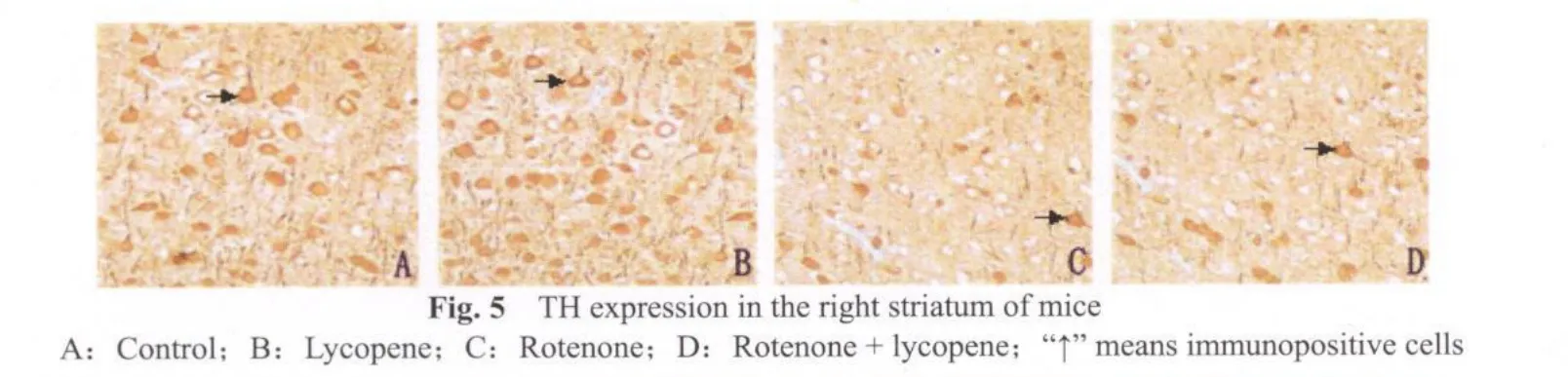
TH免疫组化染色显示,空白对照组(图4A,5A)和番茄红素组(图4B,5B)小鼠中脑黑质致密区及纹状体可见许多TH阳性神经元,细胞多为锥形或三角形,胞浆内棕色颗粒浓,轴突分散在神经纤维之间;鱼藤酮组小鼠(图4C,5C)中脑黑质TH阳性多巴胺能神经元胞体缩小,纹状体TH阳性细胞轮廓不清,阳性神经纤维脱失,轴突消失。鱼藤酮+番茄红素组小鼠(图4D,5D,图4,5见彩图页Ⅵ)免疫染色可见中脑黑质部位TH阳性神经元密集,呈带状分布,胞体大,突起明显。纹状体TH阳性细胞胞浆内染色较为浅淡。
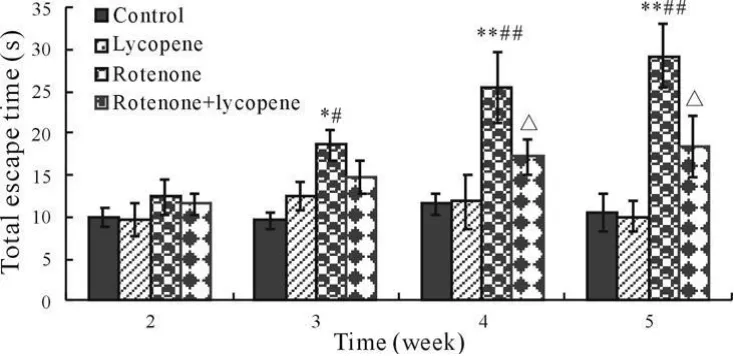
Fig.2 The total escape time of different treated groups(±s,n=10)
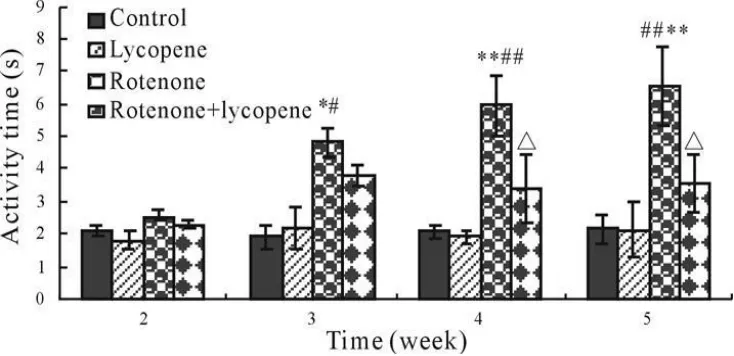
Fig.3 The activity time of different treated groups(±s,n=10)
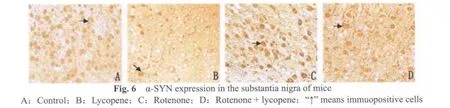
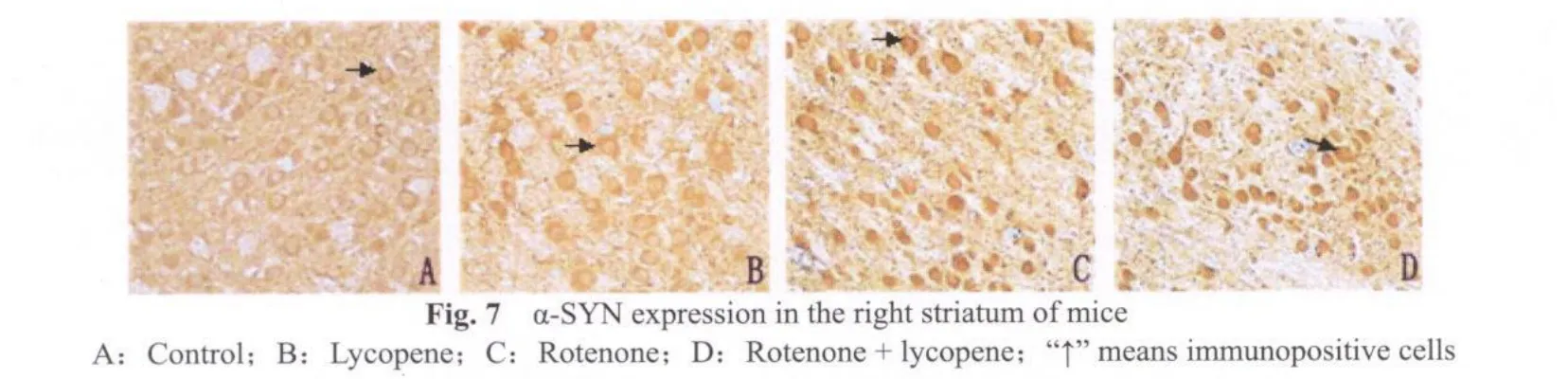
α-SYN免疫组化染色显示,空白对照组(图6A,7A)和番茄红素组(图6B,7B)小鼠中脑黑质致密区及纹状体仅有较弱的免疫阳性反应。而在鱼藤酮组(图6C,7C)小鼠黑质及纹状体α-SYN过度聚集明显,但没有观察到包涵体样结构。鱼藤酮+番茄红素组小鼠(图 6D,7D,图 6,7见彩图页Ⅵ)α-SYN免疫染色可见黑质部位阳性表达显著下降,纹状体阳性表达变化不大。
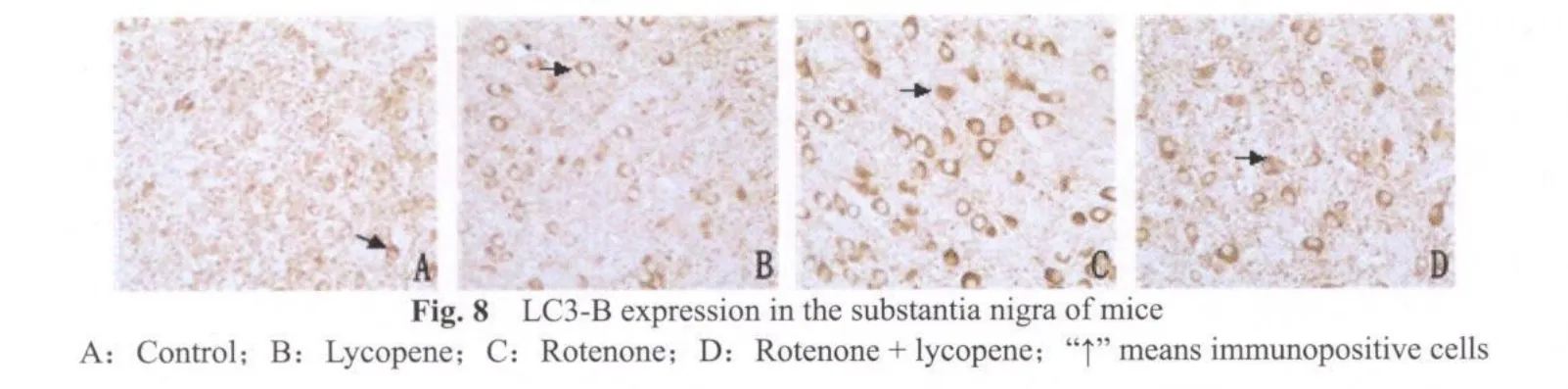
LC3-B免疫组化染色显示,鱼藤酮组小鼠(图8C,9C)中脑黑质致密区及纹状体有较强的阳性反应;而鱼藤酮+番茄红素组小鼠(图8D,9D)LC3-B免疫染色明显减弱;空白对照组(图8A,9A)和番茄红素组小鼠(图8B,9B,图8,9见彩图页Ⅵ)中,LC3-B免疫阳性染色几乎没有出现。
采集图像统计分析发现,鱼藤酮组小鼠黑质TH阳性细胞数显著低于空白对照和番茄红素组(P<0.01,表3),α-SYN,LC3-B阳性细胞数显著高于空白对照和番茄红素组(P<0.01,表3)。鱼藤酮+番茄红素与鱼藤酮组比较,TH阳性神经元数显著增加,α-SYN,LC3-B阳性神经元数显著下降(P<0.05,表3)。其他组间比较没有显著性差异(P>0.05)。
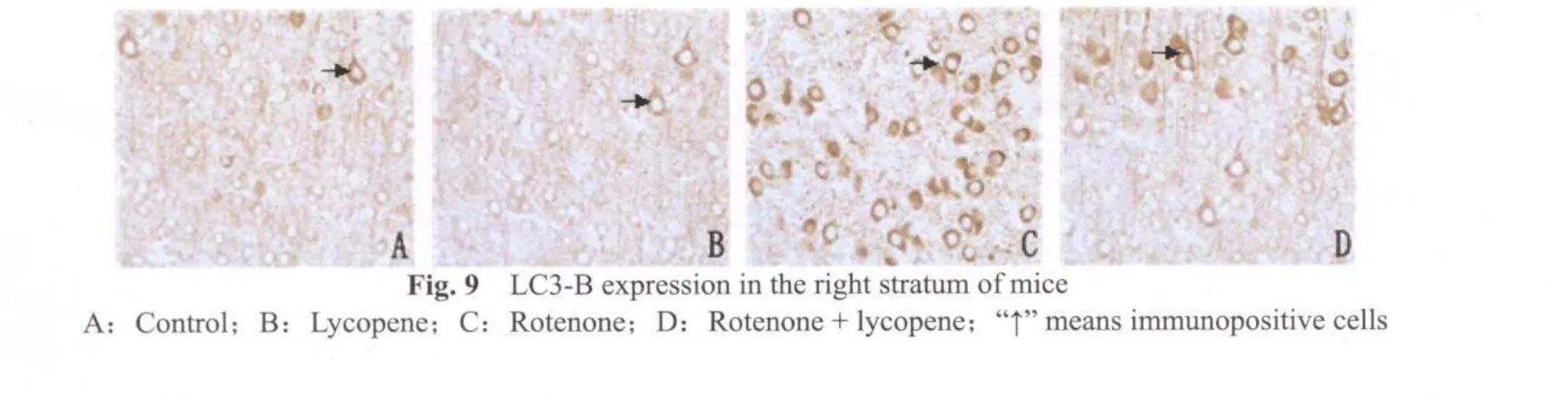
采集图像统计分析发现,鱼藤酮组小鼠纹状体TH免疫阳性细胞数显著低于空白对照和番茄红素组(P<0.01,表 4),α-SYN,LC3-B阳性细胞数显著高于空白对照和番茄红素组(P<0.01,表4)。鱼藤酮+番茄红素与鱼藤酮组比较,TH阳性神经元数有所增加,α-SYN阳性神经元数有所减少,但无显著性差异(P>0.05,表4),LC3-B阳性神经元数显著下降(P<0.05,表4)。其他组间比较没有显著性差异(P>0.05)。
Tab.3 Number of TH,α-SYN and LC3-B immuopositive cells in the substantia nigra of mice(±s,n=10)
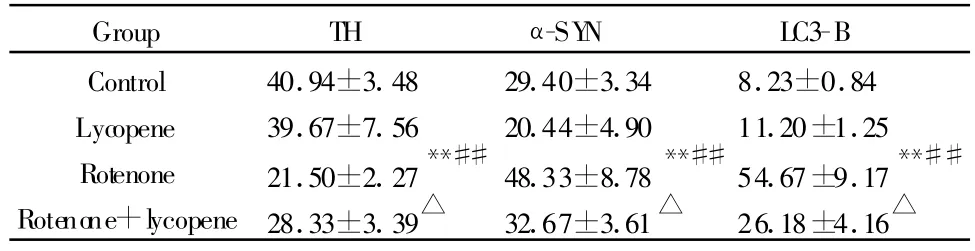
Tab.3 Number of TH,α-SYN and LC3-B immuopositive cells in the substantia nigra of mice(±s,n=10)
TH:Tyrosine hydroxylase;α-SYN:α-synuclein;LC3-B:Microtubule-associated protein 3 light chain**P<0.01 vs control group;##P<0.01 vs lycopene group;△P<0.05 vs rotenone group
Group TH α-SY N LC3-B Control 40.94±3.48 29.40±3.34 8.23±0.84 Lycopene 39.67±7.56 20.44±4.90 11.20±1.25 Rotenone 21.50±2.27**##48.33±8.78**##54.67±9.17**##Rotenone+lycopene28.33±3.39△ 32.67±3.61△ 26.18±4.16△
Tab.4 Number of TH,α-SYN and LC3-B immuopositive cells inthe right striatum of mice(±s,n=10)
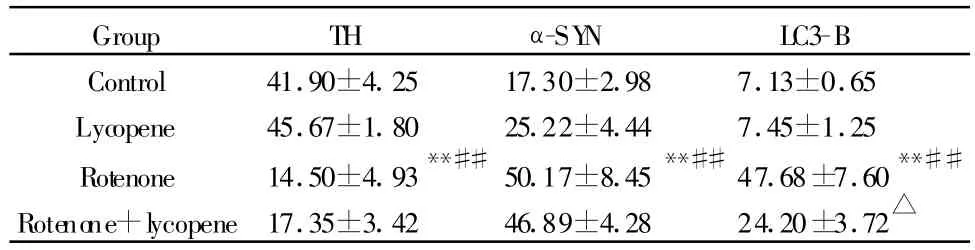
Tab.4 Number of TH,α-SYN and LC3-B immuopositive cells inthe right striatum of mice(±s,n=10)
TH:Tyrosine hydroxylase;α-SYN:α-synuclein;LC3-B:Microtubule-associated protein 3 light chain**P<0.01 vs control and lycopene group;##P<0.01 vs lycopene group;△P<0.05 vs rotenone group
Group TH α-SY N LC3-B Control 41.90±4.25 17.30±2.98 7.13±0.65 Lycopene 45.67±1.80 25.22±4.44 7.45±1.25 Rotenone 14.50±4.93**##50.17±8.45**##47.68±7.60**##Rotenone+lycopene17.35±3.42 46.89±4.28 24.20±3.72△
3 讨论
鱼藤酮具有极强的亲脂性,可自由通过血脑屏障和细胞膜并聚集在细胞器,选择性抑制线粒体复合物I的活性,从而损伤多巴胺神经系统[3]。本实验结果显示,帕金森小鼠中脑黑质和纹状体组织SOD、GSH-Px和CAT活性相对空白对照组显著降低,MDA含量显著升高。该结果反映帕金森小鼠黑质和纹状体内抗氧化应激系统功能减弱,氧自由基含量增多及细胞正处于脂质过氧化阶段,与先前的同类研究类似[9-10]。用番茄红素干预后组织中SOD、GSH-Px和CAT活性较帕金森小鼠显著升高,MDA含量显著降低,提示番茄红素可能通过提高细胞内GSH含量,发挥其较强的抗氧化作用[6]。水迷路行为结果显示,帕金森小鼠平均逃逸时间和靶象限活动时间显著增加,而给予番茄红素组干预后,平均逃逸时间和靶象限活动时间显著降低。结果提示,番茄红素对黑质DA能神经元氧化应激损伤有一定的保护作用。DA是人脑中重要的神经递质,主要存在于黑质和纹状体,影响神经的传导功能,在学习记忆中起着重要作用。正常情况下,DA在自氧化或经单胺氧化酶催化氧化脱胺代谢过程中产生氧自由基、过氧化氢等细胞毒性物质,并能被体内的抗氧化系统清除掉。而在氧化应激时,由于线粒体受损产生的大量自由基能加速引发DA自氧化,从而产生大量的过氧化氢和超氧阴离子,另一方面,使黑质线粒体呼吸链复合物活性下降,线粒体功能损伤,抗氧化系统中酶活性降低,无法清除自由基,使DA神经元膜蛋白脂质过氧化,最终导致动物行为表现异常。本实验结果显示,鱼藤酮小鼠黑质及纹状体TH免疫阳性细胞数显著减少,这可能与实验中α-SYN蛋白水平增加有关。过表达的α-SYN通过细胞内ROS产生氧化应激损伤DA能神经元,ROS也能对α-SYN蛋白进行硝化修饰,而亚硝酸化的α-SYN不仅可以促进寡聚体的形成,而且对形成的多聚体有稳定作用[5]。番茄红素干预组小鼠黑质及纹状体TH免疫阳性细胞数显著增加,而α-SYN蛋白表达显著减少,提示番茄红素能有效增强细胞的抗氧化能力,从而降低鱼藤酮对黑质及纹状体DA能神经元的毒性。α-SYN蛋白和氧化应激之间存在密切关系,它们相互作用、相互影响,共同促进PD的病理进程。自噬是体内降解/再循环系统,也是外源性损伤(如神经毒素所致的氧化应激状态)细胞的一个修复机制。本实验结果显示,帕金森小鼠黑质及纹状体LC3-B表达显著增强,而番茄红素组干预后LC3-B阳性神经元数显著下降。结果表明,鱼藤酮能激活中脑黑质及纹状体DA能神经元的自噬活性,以清除持续升高的氧化应激所产生的大量氧自由基以及受损的线粒体。Weinreb研究认为,细胞内α-SYN蛋白可诱导自噬性细胞的死亡和轴突营养不良[4]。在人类路易体痴呆和转基因小鼠突变型α-SYN过表达的脑组织中LC3-B显著增加,提示自噬被诱导清除α-SYN寡聚体或突变型α-SYN。进一步围绕氧化应激与自噬的激活机制,对揭示PD等神经变性疾病的病因、发病机制具有深远意义。
[1]Jankovic J.Parkinson's disease:clinical features and diagnosis[J].J Neurol Neurosurg Psychiatry,2008,79(4):368-376.
[2]徐 红,董方圆,殷盛明,等.早期帕金森病大鼠胶质细胞免疫反应活性的改变及其意义[J].中国应用生理学杂志,2012,28(1):71-73.
[3]Kaur H,Chauhan S,Sandhir R.Protective effect of lycopene on oxidative stress and cognitive decline in rotenone induced model of Parkinson's disease[J].Neurochem Res,2011,36(8):1435-1443.
[4]Weinreb O,Amit T,Mandel S,et al.Neuroprotective molecular mechanisms of(-)-epigallocatechin-3-gallate:a reflective outcome of itsantioxidant,iron chelating and neuritogenic properties[J].Genes Nutr,2009,4(4):283-296.
[5]Wang M S,Boddapati S,Emadi S,et al.Curcumin reduces alpha-synuclein induced cytotoxicity in Parkinson's disease cell model[J].BMC Neurosci,2010,11:57.
[6]Sharma N,Goswami UC.Functioning of lycopene in mammalian system:a review[J].Proc ZoolSoc Lond,2011,64(1):1-7.
[7]李亚南,葛晓群.鱼藤酮毒性及含量测定方法研究进展[J].国际药学研究杂志,2009,36(5):366-369.
[8]Sandhir R,Mehrotra A,Kamboj SS.Lycopene prevents 3-nitropropionic acid-induced mitochondrial oxidative stress and dysfunctions in nervous system[J].Neurochem Int,2010,57(5):579-587.
[9]彭 岩,殷盛明,于德钦,等.早期帕金森病大鼠血清抗氧化能力降低[J].中国应用生理学杂志,2011,27(2):218-220.
[10]Navarro A,Boveris A.Brain mitochondrial dysfunction and oxidative damage in Parkinson's disease[J].J Bioenerg Biomembr,2009,41(6):517-521.
