阿托伐他汀对氯化锂诱导人脐静脉内皮细胞Wnt信号通路相关因子表达的影响
2013-08-27申玉超于晓玲张秀梅
申玉超,于晓玲,张秀梅
辽宁医学院附属第一医院,辽宁锦州 121001
动脉粥样硬化(atherosclerosis,AS)是众多心脑血管疾病共同的病理基础,严重危害人类健康。近年来内皮损伤学说得到了多数学者支持,内皮功能不全被认为是AS发生机制中的始动环节,因而对内皮细胞损伤进行药物干预治疗,也成为心血管疾病领域研究的一个新的趋势[1]。Lee等[2]激活内皮细胞的Wnt/β-连环蛋白(Wnt/β-catenin)信号通路,发现内皮细胞功能紊乱,单核细胞对血管内皮的黏附性增强,但内皮细胞黏附分子表达并未增加,因此推断Wnt/β-catenin信号通路可能与AS的发生机制有关[3-4]。本文通过研究阿托伐他汀对氯化锂诱导人脐静脉内皮细胞Wnt信号通路相关因子Wnt1、β-catenin、dvl-1蛋白表达的影响,探讨AS与Wnt/β-catenin信号通路的关系及阿托伐他汀抗AS的可能机制。
材料和方法
1 材料和试剂 人脐静脉内皮细胞株(human umbilical vein endothelial cells,HUVECs)购 自 ATCC公司;胎牛血清、1640培养基、胰蛋白酶购自海克隆生物有限公司(北京);Licl购自北京协生生物科技有限公司;阿托伐他汀原粉购自辉瑞公司;兔抗人Wnt1抗体购自巴傲得生物科技有限公司;鼠抗人β-catenin抗体购自北京中杉金桥生物技术有限公司;兔抗人dvl1抗体购自北京博奥森生物技术有限公司;NO试剂盒购自南京建成生物工程研究所。
2 实验细胞与分组 HUVECs的培养 用含体积分数10%胎牛血清的1640细胞培养液培养,体积分数5% CO2的细胞培养箱中,1~2 d换液1次。以0.25%胰蛋白酶消化及传代,并在倒置显微镜下观察细胞形态、选择生长良好的4~6代的细胞用于实验。细胞分为3组:1)空白对照组:细胞不加任何干预;2)Licl组:加入终浓度为20 mmol/L的Licl;3)阿托伐他汀组:加入终浓度为20 mmol/L的Licl+10 μmol/L的阿托伐他汀共同处理。各组经卵育24 h后,收集细胞及培养的上清液,观察不同组Wnt1、β-catenin、dvl-1蛋白的表达及培养液中NO含量的变化。
3 HUVECs形态学观察 倒置显微镜观察各组处理24h后HUVECs的形态学变化。
4 HUVECs的NO含量 用硝酸还原酶特异性将NO3-还原NO2-,通过显色深浅测定其浓度高低。吸取各组中的细胞培养液,按南京建成生物工程研究所的试剂盒说明书进行检测。
5 免疫组织化学法检测蛋白的表达 将第4代细胞接种在有盖玻片(多聚赖氨酸处理好)的6孔板中进行细胞爬片。4 ℃10%甲醛固定30 min,30%H2O21份+纯甲醇9份室温浸泡15 min,封闭液37 ℃孵育30 min,加兔抗人Wnt1、鼠抗人β-catenin、兔抗人dvl-1抗体(1∶600)于4 ℃过夜;加二抗A液37 ℃卵育30 min,加二抗B液37 ℃孵育30 min,显色、复染。以上每步之间用PBS冲洗3次,每次4 min;显色、复染,脱水、封片。镜下观察蛋白表达。
6 Western blot法检测蛋白表达 收集各组细胞,超声裂解细胞,4 ℃ 1 000 g离心2 min,取上清液,用考马斯亮蓝法蛋白定量。取20 μl蛋白质样品行聚丙烯酰胺凝胶电泳,转膜,5%脱脂奶粉封闭2 h,分别滴加兔抗人Wnt1、鼠抗人β-catenin、兔抗人dvl-1(1∶400)抗体,4 ℃孵育过夜,相应碱性磷酸酶标记的二抗室温孵育2 h,碱性磷酸酶法显色。于扫描仪上成像,并用GENE GENIUS软件对条带进行灰度值半定量进行分析。以肌动蛋白(β-actin,分子量为43 kU)为内参照,Wnt1(分子量为40 kU)、β-catenin(分子量为92 kU)及dvl-1(分子量为76 kU)与β-actin条带灰度值的比值代表各蛋白表达的相对量。
7 统计学方法 采用SPSS13.0统计软件,计量资料用-x±s表示,组间差异采用单因素方差分析,组间两两差异采用SNK检验。P<0.01为差异有统计学意义。
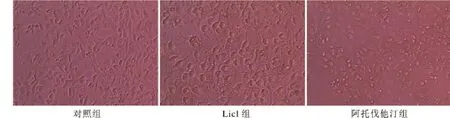
图1 倒置显微镜观察各组的形态学变化

图2 免疫组化法检测各组Wnt1、β-catenin、dvl-1蛋白表达 A:Wnt1抗体; B:β-catenin抗体; C:dvl-1抗体
结 果
1 HUVECs形态学观察 对照组细胞倒置显微镜下呈单层铺路石状镶嵌排列,互不重叠,细胞边界清晰,呈多角形;Licl组细胞收缩变圆,细胞间隙增宽,边界不清,部分细胞脱落;阿托伐他汀组细胞间隙较Licl组窄,细胞形态趋于对照组。见图1。
2 各组HUVECs的NO含量比较 与对照组比较,Licl组及阿托伐他汀组细胞培养的上清液中一氧化氮含量显著减少(P<0.01);与Licl组比较,阿托伐他汀组细胞培养的上清液中一氧化氮含量显著减少(P<0.01)。见表1。
3 各组Wnt1、β-catenin、dvl-1蛋白表达 利用免疫组化法检测,对照组Wnt1、β-catenin、dvl-1蛋白在细胞质内出现棕黄色淡染颗粒;与对照组比较,Licl组细胞质内出现大量棕色颗粒聚集、浓染;阿托伐他汀组较对照组细胞质内出现较多棕黄色颗粒,但较Licl组棕黄色颗粒明显少。见图2。利用Western blot法检测,与对照组相比,Licl组和阿托伐他汀组Wnt1、β-catenin、dvl-1蛋白定量明显上升(P<0.01);与Licl组相比,阿托伐他汀组Wnt1、β-catenin、dvl-1蛋白定量明显降低(P<0.01)。见表1、图3。
表1 各组HUVECs的NO含量及Wnt1,β-catenin,dvl-1表达的比较, n=6)
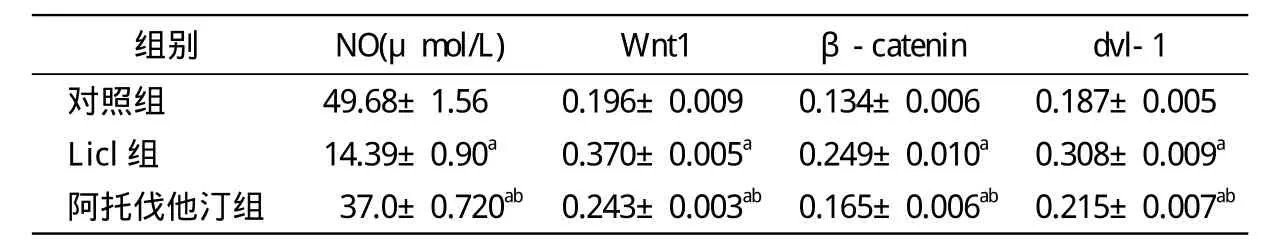
表1 各组HUVECs的NO含量及Wnt1,β-catenin,dvl-1表达的比较, n=6)
aP<0.01,与对照组相比较;bP<0.01,与Licl组相比较
?

图3 Western blot法检测各组HUVECs的Wnt1,β-catenin, dvl-1蛋白表达电泳图
讨 论
Wnt信号通路至少分为3个分支[5]:经典Wnt信号 通路(Wnt/β-catenin信号通路),Wnt/JNK信号通路,Wnt/Ca2+信号通路。通过上述途径影响细胞的增殖,分化及凋亡。本研究主要探讨Wnt/β-catenin信号通路,正常情况下此通路处于关闭状态,当被激活时Wnt蛋白表达增多,与其受体卷曲蛋白(frizzled)结合,激活dvl-1,使糖原合成酶激酶-3β(GSK-3β)活性受抑制,胞内β-catenin水平升高,入细胞核识别淋巴样增强因子/白细胞增强因子(Tcf/Lef)[6-7]。β-catenin入细胞核形成Tcf-β-catenin复合物,它可与钙黏蛋白启动子区结合,从而下调钙黏蛋白的表达[8]。钙黏蛋白表达减少,使内皮细胞间黏附功能下降,细胞间缝隙形成、通透性增加,从而导致炎症细胞侵入血管内皮下致AS形成。有报道证实了Wnt/β-catenin信号通路在内皮细胞黏附连接重建中居于重要地位[9-10]。Lee等[2]激活内皮细胞的Wnt/β-catenin信号通路,发现内皮细胞功能紊乱,单核细胞对血管内皮的黏附性增强,但内皮细胞黏附分子表达并未增加。综上推断Wnt/β-catenin信号通路激活与AS的形成有关。
阿托伐他汀是3-羟基-3-甲基戊二酰辅酶A(HUG-CoA)还原酶选择性抑制剂,是广为应用的他汀类药物,其除有降脂作用外,还具有独特的心血管疾病防治作用。Haidari等[11]发现阿托伐他汀通过抑制血管内皮细胞钙黏蛋白酪氨酸磷酸化保护内皮细胞间的黏附功能。
本研究通过Wnt信号通路激活剂Licl诱导HUVECs,发现内皮细胞分泌的NO明显减少,同时Wnt1、β-catenin、dvl-1蛋白表达明显升高,证明在这一过程Wnt/β-catenin信号通路激活。在Licl诱导HUVECs的同时加入阿托伐他汀,发现内皮细胞分泌的NO明显增加,同时Wnt1、β-catenin、dvl-1蛋白表达明显降低,证明在这一过程Wnt/β-catenin信号通路被抑制。本研究证实了Wnt/β-catenin信号通路激活可能与AS的形成有关,而阿托伐他汀抗AS可能与其抑制Wnt/β-catenin信号通路有关。
1 Schwartz BG, Economides C, Mayeda GS, et al. The endothelial cell in health and disease : its function, dysfunction, measurement and therapy[J]. Int J Impot Res, 2010, 22(2): 77-90.
2 Lee DK, Nathan Grantham R, Trachte AL, et al. Activation of the canonical Wnt/beta-catenin pathway enhances monocyte adhesion to endothelial cells[J]. Biochem Biophys Res Commun, 2006, 347(1): 109-116.
3 Marinou K, Christodoulides C, Antoniades C, et al. Wnt signaling in cardiovascular physiology. Trends Endocrinol Metab. 2012. [Epub ahead of print] .
4 Mill C, George SJ. Wnt signalling in smooth muscle cells and its role in cardiovascular disorders[J]. Cardiovasc Res, 2012, 95(2):233-240.
5 Rao TP, Kühl M. An updated overview on Wnt signaling pathways:a prelude for more[J]. Circ Res, 2010, 106(12): 1798-1806.
6 Miller JR. Wnt signal transduction[M]. London:Nature publishing Group,2002:195-208.
7 Miller JR, Hocking AM, Brown JD, et al. Mechanism and function of signal transduction by the Wnt/beta-catenin and Wnt/Ca2+ pathways[J]. Oncogene, 1999, 18(55): 7860-7872.
8 Birchmeier W. Cell adhesion and signal transduction in cancer.Conference on cadherins, catenins and cancer[J]. EMBO Rep,2005, 6(5):413-417.
9 Van Gijn ME, Daemen MJ, Smits JF, et al. The wnt-frizzled cascade in cardiovascular disease[J]. Cardiovasc Res, 2002, 55(1):16-24.
10 Kuroda J, Nakamura M, Yoshida M, et al. Canonical Wnt signaling in the visceral muscle is required for left-right asymmetric development of the Drosophila midgut[J]. Mech Dev, 128(11-12): 625-639.
11 Haidari M, Zhang W, Chen Z, et al. Atorvastatin preserves the integrity of endothelial adherens junctions by inhibiting vascular endothelial cadherin tyrosine phosphorylation[J]. Cell Res, 2012,318(14): 1673-1684.
