含磺基苯甲酸及联吡啶钌配合物的合成、结构和催化苯甲硫醚氧化研究
2013-08-20胡文婷朱龙观
胡文婷 朱龙观
(浙江大学化学系,杭州 310027)
苯甲硫醚氧化反应已得到广泛重视[1],利用配合物作为催化剂已有许多研究,例如Schiff 碱类型、杂多酸型、离子液体修饰型、分子筛包覆型、环糊精包结物、聚合物负载型、MOF 型等[2-17]。我们曾利用3-磺基苯甲酸镍配合物进行过苯甲硫醚氧化催化研究,表明有较良好的催化活性[18],但是在较高温度下反应的。磺基苯甲酸配体有二个功能基,能构筑新型结构并具有功能特性的配合物,国内外学者有一定报道[19-21];我们实验室近几年有较广泛研究[22-24]。但目前国内外迄今未见贵金属Ru,Rh,Pd,Pt 等与磺基苯甲酸配合物的报道;而且在苯甲硫醚氧化催化反应中,贵金属配合物只有一例研究,获得的结果是没有任何活性[25]。基于此,我们报道磺基苯甲酸钌配合物并研究催化苯甲硫醚氧化的活性。
1 实验部分
1.1 仪器和试剂
实验中所用试剂均为分析纯。C,H,N 元素分析采用Perkin-Elmer 1110 型元素分析仪。红外光谱测试使用Nicolet Nexus 470 红外光谱仪,KBr 压片,扫瞄范围4 000~500 cm-1。差热-热重测试采用Delta TA-SDT Q600 热分析仪,氮气气氛,升温速率10 ℃·min-1,测试范围室温到800 ℃,Al2O3坩埚。紫外-可见测试使用SPECORD 2000 光谱仪,甲醇溶液,室温测试。固体荧光光谱测试使用岛津F-2500 FL光谱仪,室温测试。电化学测试使用上海辰华仪器公司的CHI660C 电化学工作站,采用三电极体系:以KCl 饱和的Ag/AgCl 电极为参比电极(用二茂铁进行校正,E1/2=0.54 V),对电极为铂片电极(1.8 cm×2.2 cm),工作电极为玻碳电极;玻碳电极使用前用Al2O3粉末抛光至镜面,并将打磨好的电极用超纯水超声清洗10 min;支持电解质为高氯酸四丁基铵(TBAP),浓度为0.1 mol·L-1;乙腈中测试。气相色谱检测使用浙江福立分析仪器有限公司的GC97790J气相色谱仪,使用DB-5 毛细管柱,校正使用的苯甲硫醚、 苯甲亚砜和苯甲砜标准物质购自美国Alfa Aesar 公司。
1.2 配合物[Ru(2,2′-bipy)3](3-sb)(3-Hsb)·5H2O(1)合成
将0.064 g (0.25 mmol) RuCl3·3H2O,0.112 g(0.5 mmol) 3-磺 基 苯 甲 酸 钠 (3-NaHsb),0.078 g(0.50 mmol) 2,2′-联吡啶(2,2′-bipy)以及20 mL 水加入到30 mL 特氟隆管,封在不锈钢反应釜中,在烘箱中423 K 下反应1 d 后,冷却到室温,获得深红色溶液,过滤;滤液在室温下缓慢挥发,约3 个月获得深红色块状晶体,产率54%(147 mg 配合物)。元素分析 (基于化学式C44H43N6O15RuS2),实验值 (%):C 50.16,H 4.00,N 7.89; 理论计算值(%):C 49.81,H 4.08,N 7.92%; 差热-热重分析表明在120 ℃之前,失重9.21%, 与理论计算失去5 个水基本符合(8.48%)。红外光谱峰(KBr,cm-1):3 436(s),3 078(w),2 618(w),1 701(m),1 464(m),1 445(m),1 426(m),1 227(s),1 191(s),1 160(w),1 141(w),1 094(m),1 034(s),997(w),774 (s),731(w),690(w),654(w),616(s),580(w);1 701 cm-1处的峰表明有未脱去质子的羧基存在。
1.3 晶体结构测定

表1 配合物1 的晶体学数据Table 1 Crystallographic data and refinement parameters for complex 1
晶体结构测定使用Bruker-Smart Apex CCD X射线单晶衍射仪,在293 K 测定。挑选合适尺寸的单晶收集衍射数据,Mo Kα 射线(λ=0.071 073 nm),ω 扫描方式,数据还原采用SAINT 程序[26],进行经验吸收校正,结构解析采用SHELXTL-97[27]。用重原子法确定Ru,通过差值Fourier 方法确定其它非氢原子,芳环以及一个3-磺基苯甲酸羧基上的氢采用理论加氢。分子中晶格水有3 个是无序的,O3WA…O3WB,O4WA…O4WB,O5WA…O5WB 的距离分别只有0.216 7 nm,0.237 4 nm 和0.204 7 nm,占有率精修结果:O3WA 和O3WB 分别为0.463(9)和0.575(8),O4WA 和O4WB 分别为0.506 (8) 和0.615(10),O5WA 和O5WB 分别为0.447(7)和0.567(8)。元素分析与差热分析都表明有5 个水分子,因此在最后的精修中将这些无序水分子的占有率都固定为0.5,这些无序水分子的氢不加。另2 个水分子上的氢从差值Fourier 图上找出,并固定O-H 键长0.085(1)nm,Uiso(H)=0.000 8 nm2。非氢原子坐标和各向异性温度因子采用全矩阵最小二乘法修正。数据处理与画图采用WinGX 和Ortep 程序包[28]。配合物1 的晶体学参数见表1。
CCDC:910779。
1.4 催化实验
催化实验恒温控制进行(23±2) ℃,20 mL 的圆底烧瓶中加入6 mL 乙醇,加入0.02 mmol 的催化剂,磁力搅拌,加入2 mmol 底物苯甲硫醚,继续搅拌10 min,并在搅拌下加入6 mmol 的H2O2(30%),反应记时开始,第一个取样检测点是10 min 后,用色谱检测产物;以后每隔30 min,取样1 次,总反应310 min。结果表明,催化剂是均相催化剂。
2 结果与讨论
配合物1 是一个阳离子-阴离子复合型化合物,由阳离子[Ru(2,2′-bipy)3]3+,阴离子3-sb2-、3-Hsb-以及晶格水组成(见图1)。阳离子中中心金属离子Ru3+为6 配位,具有八面体结构,平均Ru-N 键长为:0.214 9(18) nm。阴离子3-sb2-羧基中的C-O 键长分别为0.126 7(3)和0.126 3(4) nm,是处于离域状态;阴离子3-Hsb-羧基中的C-O 键长分别为0.120 8(3)和0.132 3(3) nm,很明显羧基上的氢未脱掉。
3-Hsb-和3-sb2-通过水分子形成三维氢键阴离子网络(图2),具有孔洞,阳离子[Ru(2,2′-bipy)3]3+占据这些阴离子孔洞,形成较为稳定的阴离子-阳离子配合物。配合物中的部分氢键参数见表2 (由于O3W,O4W 和O5W 无序未加氢,因此只列出与O1W 和O2W 有关的氢键参数,但从Mercury 软件显示O3W 与O4W、O5W 和O7,O4W 与O5W,O5W与O6 或O7 均可能有氢键存在)。配合物中无π-π堆积作用,但依据Platon 软件的分析发现[29]:配位的联吡啶间以及联吡啶与磺基苯甲酸间存在较为丰富的C-H…π 作用(表3,Cg 定义为:1 为含N1、N2的联吡啶,2 为含N3、N4 的联吡啶,3 为含N5、N6的联吡啶,4 为含C9-C14 的磺基苯甲酸),进一步增强了配合物的稳定性。
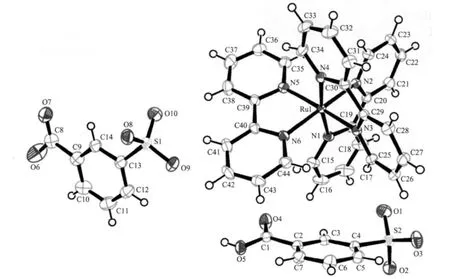
图1 配合物1 的分子结构Fig.1 Molecular structure of complex 1
配合物的UV-Vis 光谱在甲醇溶液室温下测定,浓度1.25×10-5mol·L-1,结果见图3。有3 个吸收峰:216 nm(ε=98 372 dm3·mol-1·cm-1),299 nm (ε=98 464 dm3·mol-1·cm-1) 和463 nm (ε=13 915 dm3·mol-1·cm-1),其中216 nm 处的吸收峰最强。与配体2,2′-bipy(236 nm 和281 nm)和3-NaHsb(228 nm)在甲醇溶液中的谱图比较,发现配合物216 nm 的吸收峰来自于配体2,2′-bipy 和3-NaHsb,299 nm 的吸收峰来自于配体2,2′-bipy,这2 个吸收峰均发生了位移。这些吸收峰归因于配体中的π-π* 跃迁。463 nm 的吸收峰则由金属与配体的电荷转移引起,归因于金属d 轨道到配体π*轨道的跃迁。
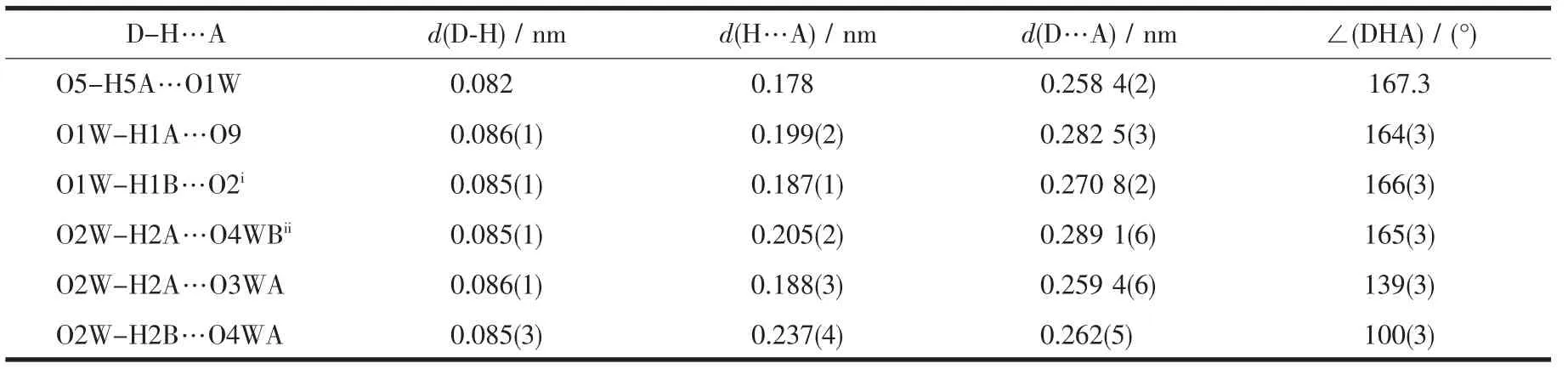
表2 配合物1 中的氢键键长及键角Table 2 Hydrogen bonds distances and angles for complex 1

表3 配合物1 中C-H…π 作用Table 3 C-H…π interactions in complex 1

图2 阴离子3-Hsb-、3-sb2-和水分子形成的具有孔洞的三维氢键网络Fig.2 Three-dimensional hydrogen-bonding network with cavities constructed by 3-Hsb-, 3-sb2-and water molecules
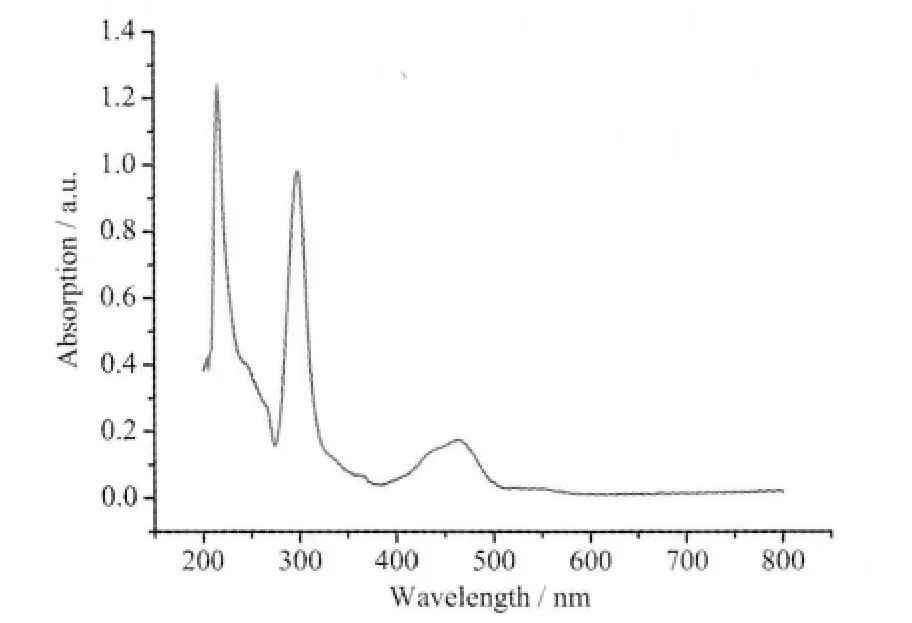
图3 配合物1 在甲醇中紫外-可见光谱图Fig.3 UV-Vis spectrum of complex 1 in methanol
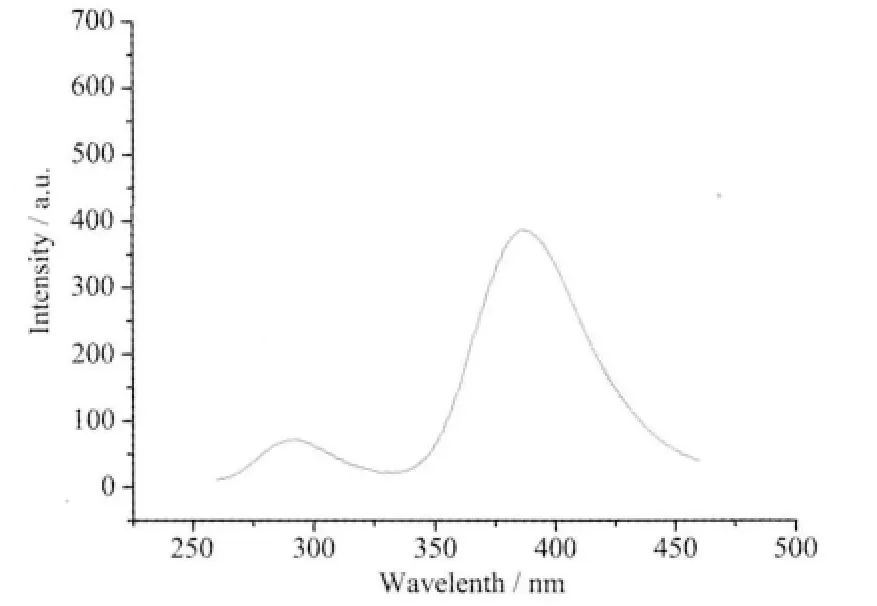
图4 配合物1 室温固体荧光光谱图Fig.4 Fluorescent spectrum of complex 1 in solid sate at room temperature
配合物固体粉末的荧光光谱见图4 (λex=240 nm),在292 和388 nm 有2 个发射峰,与配体2,2′-bipy(290、387 nm)和3-NaHsb(318、384 nm)相比配合物显示了配体的特征,发射峰位置有一定的位移,但形成配合物后其荧光强度低于配体。

图5 配合物1 在乙腈中的电化学循环伏安图Fig.5 Cyclic voltammogram of complex 1 in CH3CN
配合物1 在乙腈中的循环伏安见图5,支持电解质高氯酸四丁基铵,扫描速率50 mV·s-1。阴极峰值电位Epc=1.315 V,阳极峰值电位Epa=1.385 V,ΔEp=Epa-Epc=1.385-1.315=0.070 V,结果表明是一个单电子过程(理论计算值为0.059 V,是很好的吻合);阴极峰值电流ipc=1.684×10-5A,阳极峰值电流ipa=22.48 μA,ipa/ipc=1.33,表明这是一个可逆氧化还原过程,对应的可逆对为Ruビ/Ru(Ⅲ),E1/2=1.350 V。较高的E1/2值表明配合物具有较好的电化学稳定性。
苯甲硫醚氧化反应见图6。室温下配合物1 作为苯甲硫醚氧化催化剂实验表明: 催化活性较低,但比空白高(图7),这与Acquaye 等[25]报道的Ru 配合物的催化活性类似,不过Acquaye 认为检测到的产物量很少,可能是产物与Ru 形成了配合物,但目前为止还没有其它报道能证实这种说法。我们的配合物类型与Acquaye 的不同,因此可以认为单独的Ru 配合物在硫醚氧化反应中作催化剂时活性不强。Lippold 曾在研究配合物-环糊精包结物时也发现[12]:配合物-环糊精包结物催化活性很低,但若加入与硫醚量1∶1 物质的量比的高氯酸转化率显著增加。借鉴Lippold 的研究,我们在反应体系中加入与配合物配体相似的酸,即2-磺基苯甲酸(2-H2sb)0.05 mmol,结果表明转化率提高显著(图7),反应310 min,转化率为90.5%,亚砜选择性为96.7%。由此获得新的认识:钌配合物作为硫醚氧化催化剂应与酸结合使用,可以发挥显著催化作用。
图6 苯甲硫醚氧化反应Fig.6 Scheme of the oxidation of methyl phenyl sulfide
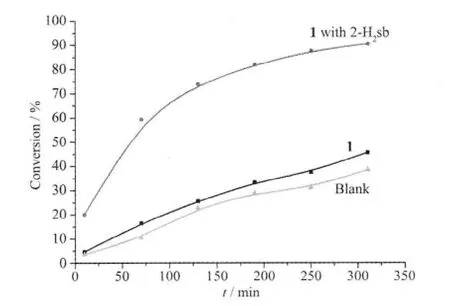
图7 配合物1 催化苯甲硫醚氧化反应转化率Fig.7 Conversion vs time of the oxidation of thioanisol
3 结 论
本文合成了一个钌磺基苯甲酸配合物,其结构是由阴离子与水分子形成具孔洞的三维氢键主体结构,阳离子占据这些孔洞,构筑成稳定的主体-客体结构。紫外-可见测定表明,配合物主要显示2,2′-bipy 和3-sb2-的吸收峰,但发生了位移,新出现了463 nm 的金属-配体电荷转移引起的吸收峰。配合物固体荧光显示配体2,2′-bipy 和3-sb2-的特征发射峰,但有一定位移、强度低于配体。电化学性质测试表明:氧化还原是一个单电子可逆过程。室温催化活性测试表明: 钌配合物作为苯甲硫醚氧化反应催化剂应与酸结合应用,有较高的转化率和亚砜选择性。
[1] Carreno M C. Chem. Rev., 1995,95:1717-1760
[2] GAO Ai-Ping(高爱平), WANG Mei(王梅), WANG Dong-Ping(王 东 平), et al. Chin. J. Catal.(Cuihua Xuebao), 2006,27:743-748
[3] Romanelli G P, Villabrille P I, Caceres C V, et al. Catal.Commun., 2011,12:726-730
[4] Shi X Y, Wei J F. J. Mol. Catal. A: Chem., 2008,280:142-147
[5] Shi X Y, Han X Y, Ma W J, et al. J. Mol. Catal. A: Chem.,2011,341:57-62
[6] Maurya M R, Bisht M, Avecilla F. J. Mol. Catal. A: Chem.,2011,344:18-27
[7] Maurya M R, Saini P, Haldar C, et al. Polyhedron, 2012,31:710-720
[8] Maurya M R, Chandrakar A K, Chand S. J. Mol. Catal. A:Chem., 2007,274:192-201
[9] Maurya M R, Chandrakar A K, Chand S. J. Mol. Catal. A:Chem., 2007,278:12-21
[10]Maurya M R, Saini P, Kumar A, et al. Eur. J. Inorg. Chem.,2011:4846-4861
[11]Maurya M R, Singh B, Adao P, et al. Eur. J. Inorg. Chem.,2007:5720-5734
[12]Lippold I, Vlay K, Gorls H, et al. J. Inorg. Biochem., 2009,103:480-486
[13]Maurya M R, Kumar M, Arya A. Cat. Commun., 2008,10:187-191
[14]Prasanth K L, Maheswaran H. J. Mol. Catal. A: Chem.,2007,268:45-49
[15]Maurya M R, Arya A, Kumar A, et al. Dalton Trans., 2009:2185-2195
[16]Maurya M R, Kumar M, Kumar U. J. Mol. Catal. A: Chem.,2007,273:133-143
[17]Dybtsev D N, Nuzhdin A L, Chun H, et al. Angew. Chem.Int. Ed., 2006,45:916-920
[18]Miao X H, Zhu L G. CrystEngComm, 2009,11:2500-2509
[19]Yuan R X,Xiong R G,Xie Y L,et al.Inorg.Chem.Commun.,2001,4:384-387
[20]Thuery P. Cryst. Growth Des., 2012,12:1632-1640
[21]Li X F, Huang Y B, Cao R. Dalton Trans., 2012,41:6195-6205
[22]Zheng X F, Zhu L G. Cryst. Growth Des., 2009,9:4407-4414
[23]Zheng X F, Zhu L G. CrystEngComm, 2010,12:2878-2884
[24]Zheng X F, Zhu L G. Polyhedron, 2011,30:666-675
[25]Claustro I, Abate G, Sanchez E, et al. Inorg. Chim. Acta,2003,342:28-36
[26]SAINT,Version 6.02a,Bruker AXS Inc.,Madison,WI,2002.
[27]Sheldrick G M. SHELXL-97, Program for Crystal Structure Refinement, University of Göttingen, Göttingen, Germany,1997.
[28]Farrugia L. J. Appl. Crystallogr., 1999,32:837
[29]Spek A L. Acta Crystallogr., 2009,D65:148-155
