苍白芽孢杆菌D-阿拉伯糖异构酶克隆表达及D-塔格糖制备
2013-08-07石贵阳
张 娥,张 梁,石贵阳*
(江南大学生物工程学院,工业生物技术教育部重点实验室,粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
D-阿拉伯糖异构酶(D-AI,EC5.3.1.3),系统名称为D-阿拉伯糖醛-酮糖异构酶,催化D-阿拉伯糖(醛糖)异构为D-核酮糖(酮糖)[1]。苍白芽孢杆菌中的D-阿拉伯糖异构酶,不仅可以催化D-阿拉伯糖转化生成D-核酮糖,同时还可以催化D-半乳糖转化生成D-塔格糖(tagatose)[2]。
D-塔格糖是一种在自然界中存在但较为稀有的天然六碳酮糖,是果糖的一种差向异构体[3],相对分子质量180.16,甜度为蔗糖的92%,甜味特性与蔗糖相似,而产生的热量只为蔗糖的1/3,所以被称之为低热量甜味剂[4]。此外,塔格糖对强力甜味剂还有很好的协同增效作用,包括甜蜜素、糖精、阿斯巴甜、安赛蜜、甜菊糖、纽甜和三氯蔗糖等[5]。2001年,美国食品药品管理局(FDA)批准其为普遍公认安全食品(GRAS)[3]。许多食品(如灭菌牛乳、超高温灭菌乳、乳粉、热可可、各种干酪、某些品种的酸乳、婴儿配方食品)以及某些植物、药物中都存在有一定量的塔格糖[3]。D-塔格糖具有抑制高血糖、改善肠道菌群、抗龋齿等功能,以甜味剂、赋形剂、保湿剂和稳定剂等形式作为各种添加剂,被广泛应用于食品、饮料、医药和化妆品等领域[6-7]。
目前塔格糖的生产方法主要有两大类:化学催化法和生物转化法[8]。化学催化合成是利用各种化学催化剂将D-半乳糖催化为D-塔格糖。在这个过程中容易产生很多副产物,而且这些杂质与D-塔格糖混在一起很难分离,因此D-塔格糖的产率不高。
生物转化法中有一种是以半乳糖醇为原料,利用各种微生物的半乳糖醇脱氢酶将其氧化为D-塔格糖,如Mycobacterium smegmatis[9],但考虑到半乳糖醇是一种比较贵的试剂(500~800$/kg)[10],所以这种方法的价值不大;另一种是通过L-阿拉伯糖异构酶转化半乳糖生成塔格糖。1993年,Cheetham等[11]首次报道了利用微生物的L-阿拉伯糖异构酶(L-AI)活性发酵D-半乳糖生产D-塔格糖的研究。目前研究较多的生物转化生产塔格糖的方法是利用L-阿拉伯糖异构酶催化D-半乳糖转化为D-塔格糖,但对利用D-阿拉伯糖异构酶来催化D-半乳糖转化为D-塔格糖还未见报道。
本实验采用一种新型耐热型D-阿拉伯糖异构酶来高效生产D-塔格糖,利用实验室保藏的菌种经过基因工程的方法构建成含有D-阿拉伯糖异构酶基因的工程菌,并用该工程菌所表达的D-阿拉伯糖异构酶合成D-塔格糖。同时研究pH值、温度、金属离子及底物浓度等因素对酶合成D-塔格糖的影响。
1 材料与方法
1.1 材料与试剂
苍白芽孢杆菌(Geobacillus pallidus)是由江南大学工业微生物保藏中心所得,编号CICIM B3101;宿主菌E.coli JM109、BL21(DE3)、pET-28a载体等均来自本实验室保藏;PCR引物由生工生物工程(上海)有限公司合成。
DNA polymerase、pMD-18T载体、胶回收试剂盒、质粒提取试剂盒 生工生物工程(上海)有限公司;T4 DNA连接酶、限制性内切酶SacⅠ、Xho Ⅰ及PCR产物纯化试剂盒 宝生物工程(大连)有限公司;蛋白电泳标样 中国科学院上海生化研究所;D-塔格糖标准品 美国Sigma公司。
1.2 仪器与设备
恒温金属浴锅 杭州博日科技有限公司;Sonics 750超声波细胞破碎仪 美国Sonic & Materials有限公司;PCR仪 东胜龙创新生物科技有限公司;UV-2100分光光度计 尤尼科上海仪器有限公司;垂直板状电泳系统 美国Bio-Rad公司;Alpha Innotech凝胶成像系统 美国Alpha Innotech公司;4K15型台式高速冷冻离心机 美国Sigma公司;全自动制冰机 英国Grant公司;DW3型冷冻干燥机 丹麦Het公司;AKTA Purifi er蛋白分离纯化仪 美国通用电气公司。
1.3 方法
1.3.1 产D-阿拉伯糖异构酶菌株的筛选
LB(种子)培养基(g/L):酵母提取物5、蛋白胨10、氯化钠10,pH 7.0~7.2,0.1MPa灭菌20min。固体培养基添加2%的琼脂粉。
发酵培养基(g/L):D-阿拉伯糖1.5、酵母膏10、蛋白胨10、无水乙酸钠10、K3PO40.2、MgSO4·7H2O 0.2、FeSO4·7H2O 0.2、NaCl 0.01,pH7.0,0.1MPa灭菌20min。
将菌种通过种子培养基活化后转接到发酵培养基中,37℃培养12h。将发酵液6000r/min离心10min,收集菌体,用PBS缓冲液(pH7.0,0.2mol/L)洗涤两次,再将收集的菌体于冰浴中超声波破碎至澄清,离心收集上清得细胞破碎液。取细胞破碎液进行酶反应,酶反应条件:0.5mL酶液+1mL 0.83mol/L的D-半乳糖(pH7.0,内含5mmol/L MnCl2)60℃,反应1h,取0.1mL反应液加入0.9mL 0.1mol/L盐酸终止反应。取反应液适当稀释后,利用半胱氨酸-咔唑法[12]测定酶活。取25mL具塞试管7个,分别加100μg/mL的D-塔格糖标准溶液0、50、100、200、300、400、500μL,再用蒸馏水分别补充至1mL,然后每管中加入0.2mL 1.5%的半胱氨酸盐酸溶液,6mL 70%的浓硫酸溶液,摇匀后,立即加入0.2mL 0.12%的咔唑酒精溶液,摇匀于60℃保温10min,取出冰浴中冷却10min,在波长560nm处比色,以D-塔格糖的质量浓度为横坐标,吸光度为纵坐标,绘制标准线性曲线y=0.02479x+0.0081(R2=0.99646)。
酶活力单位定义:以D-半乳糖为底物,每毫升发酵液每分钟转化生成1μg D-塔格糖所需的酶量,作为一个酶活力单位,以U表示。
1.3.2 D-阿拉伯糖异构酶基因的PCR扩增
苍白芽孢杆菌基因组DNA的提取方法参照细菌基因组DNA的制备[13]。
根据NCBI中报道的G.pallidus D-阿拉伯糖异构酶(D-AI)基因序列(数据库登记号为GenBank:AB429010.1,GI:226069485)为模板,设计PCR引物P1/P2:P1:5’- GCCGAG CTCATGGCAAAAGATCCACGATATG-3’,P2:5’- CCCC TCGAGTTATTTATAGATCGGCCCAAAGT-3’,其中P1包含Sac Ⅰ限制性酶切位点,P2包含XhoⅠ限制性酶切位点。
以苍白芽孢杆菌基因组DNA为模板,以P1/P2为引物进行PCR扩增。PCR扩增体系为:dNTPs、10×Buffer各2.5μL,上下游引物各0.5μL,模板1μL,灭菌的双蒸水18μL,Taq酶0.3μL。其扩增条件为:95℃预热5min,94℃变性30s,54℃退火45s,72℃延伸2min,循环30次,最后72℃延伸10min。PCR产物经琼脂糖凝胶电泳进行结果分析后,纯化回收。
1.3.3 苍白芽孢杆菌D-AI基因重组菌的构建
将纯化PCR产物连接到pMD-18T载体,连接产物转化到E.coli JM109中,筛选氨苄抗性阳性克隆。挑取阳性克隆接种至氨苄抗性LB培养基,提质粒用XhoⅠ和SacⅠ酶切验证并测序鉴定,将测序正确的重组质粒pET-28a-DAI和表达载体pET-28a分别用XhoⅠ和SacⅠ双酶切后,用T4 DNA连接酶连接,转化到E.coli BL21(DE3)中,筛选卡那抗性阳性克隆。
1.3.4 对重组菌株的诱导表达及SDS-PAGE凝胶电泳检测
挑取含重组质粒pET-28a-DAI的阳性克隆菌株和空载对照pET28a/DE3于50μg/mL的卡那霉素的LB培养基中,37℃培养至OD600nm达到0.6~0.8时,加入诱导剂IPTG至终浓度为1.0mmol/L,30℃条件下再诱导培养6h,离心收集菌体,用PBS缓冲液(pH7.0,0.2mol/L)洗涤后,于冰浴中超声波破碎至澄清,离心收集上清得重组菌悬液,然后利用半胱氨酸-咔唑法[12]测定其酶活力。
取20μL样品加入5μL的Loading Buffer,煮沸10min,12000r/min离心10min,上样量15μL,采用10%分离胶、5%浓缩胶进行SDS-PAGE鉴定蛋白表达与否。
1.3.5 酶的分离纯化及其酶学性质研究
将50mL重组菌培养液于6000r/min离心10min,收集细胞,用10mL 0.2mol/L pH 7.4磷酸缓冲液重悬进行超声破碎。破碎液经8000r/min离心20min,收集上清,0.22μm滤膜过滤后使用美国GE公司的镍柱His-Trap HP进行纯化,再用SDS-PAGE进行检测。
1.3.5.1 最适pH值以及pH值稳定性的测定
分别用0.2mol/L柠檬酸-柠檬酸钠缓冲液(pH4.0~6.0)、0.2mol/L磷酸二氢钠-磷酸氢二钠缓冲液(pH6.0~8.0)、0.2mol/L甘氨酸-氢氧化钠缓冲液(pH8.0~10.0)配制酶液,加入到0.8mol/L的底物溶液中,酶-底物反应体系在60℃反应1h,测定各pH值条件下对应的相对酶活力,并以最高酶活力为100%。
再将酶液置于0.2mol/L柠檬酸-柠檬酸钠缓冲液(pH4.0~6.0)、0.2mol/L磷酸二氢钠-磷酸氢二钠缓冲液(pH6.0~8.0)、0.2mol/L甘氨酸-氢氧化钠缓冲液(pH8.0~10.0)中,于60℃保温1h,然后在60℃与底物反应1h,测定各pH值条件下对应的相对酶活力,并以最高酶活力为100%。
1.3.5.2 最适温度以及温度稳定性的测定
将酶-底物反应体系分别置于30、40、50、60、70、80、90℃条件下反应1h,测定各温度对应的相对酶活力,并以最高酶活力为100%。
再将酶液在30、40、50、60、70、80、90℃条件下保温1h,再与底物在60℃反应1h,测定各温度下对应的相对酶活力,并以最高酶活力为100%。
1.3.5.3 金属离子对酶活力的影响
在酶-底物反应体系中,加入离子浓度终浓度为5mmol/L的各种金属离子,60℃反应1h,测定在不同金属离子下对应的相对酶活力,并以未加离子的酶活力为相对酶活力100%。反应条件:用纯化后的酶液,半乳糖浓度为0.83mol/L,反应pH值为7.0,在60℃条件下反应12h,不同的是每个体系所加的金属离子不同。
1.3.6 最佳酶转化反应条件的选择
1.3.6.1 pH值对酶转化的影响
选取pH6.0、7.0、8.0的反应体系进行粗酶液的转化反应,其他条件不变。反应条件:采用D-阿拉伯糖异构酶粗酶液,半乳糖浓度0.83mol/L,在60℃反应,测定不同pH值条件下,转化率随时间的变化曲线。
1.3.6.2 温度对酶转化的影响
选取温度为50、60、65℃的反应体系进行粗酶液的转化反应,其他条件不变。反应条件:用D-阿拉伯糖异构酶粗酶液,半乳糖浓度0.83mol/L,反应pH7.0,测定不同温度下,转化率随时间的变化曲线。
1.3.6.3 底物质量浓度对酶转化的影响
分别在D-半乳糖质量浓度为5、10、18、25、50g/L条件下测定转化反应,其余条件不变。反应条件为:将D-阿拉伯糖异构酶粗酶液加入到不同质量浓度底物中,反应pH 7.0,在60℃条件下进行反应,测定转化率随时间的变化曲线。
1.4 D-半乳糖转化率的计算
采用半胱氨酸-咔唑法[12],计算反应一段时间后总反应体系中生成D-塔格糖的量,与反应体系中加入D-半乳糖的量的比值,即为D-半乳糖的转化率。
2 结果与分析
2.1 产D-阿拉伯糖异构酶菌株的筛选结果
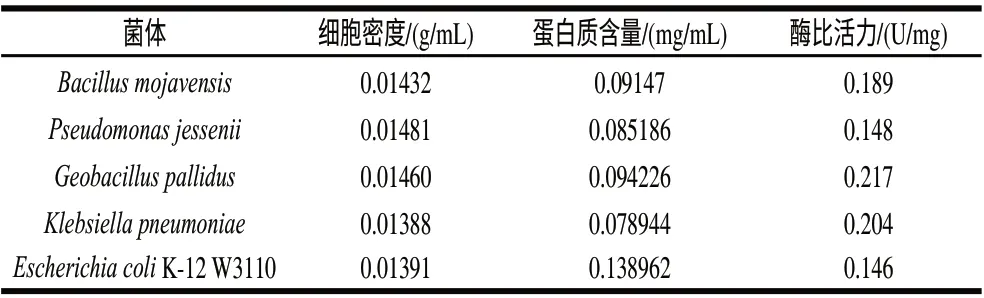
表 1 5株菌酶比活力对比(n=3)Table 1 Specifi cactivity of five strains (n=3)
从实验室保藏的1000株菌种中筛选出90株能产该酶的菌株,经过复筛后选出5株酶活较高的菌株,如表1所示,分别是Geobacillus pallidus、Klebsiella pneumoniae、Escherichia coli K-12 W3110,Bacillus mojavensis、Pseudofirmus jessenii。其中有较高酶比活力的是Geobacillus pallidus。
2.2 含D-阿拉伯糖异构酶基因的重组菌的构建
以G.pallidus基因组DNA为模板进行PCR扩增,得到一条1800bp的特异性条带,其大小与理论值一致(图1)。

图 1 目的基因PCR扩增D-AIFig.1 PCR result of target gene from D-AI
重组质粒pET-28a-DAI经XhoⅠ和SacⅠ双酶切后,得到5400bp和1800bp的两条带(图2)。

图 2 重组质粒pET-28a-DAI酶切验证Fig.2 Restriction enzyme digestion analysis of pET-28a-DAI
对比测序结果和GenBank中报道的G.pallidus D-阿拉伯糖异构酶(D-AI)基因的序列100%重合。
2.3 对D-阿拉伯糖异构酶的诱导表达以及酶的分离纯化
通过SDS-PAGE,发现在该诱导菌株中产D-AI的蛋白质分子质量靠近70kD,跟报道的分子质量67kD[1]很相近。根据软件计算,该诱导菌株D-AI理论分子质量应为66.237kD(图3a)。通过镍柱His-Trap HP,用浓度为300mmol/L的咪唑将目的蛋白洗脱下来(图3b)。
诱导表达的最佳条件是细胞在37℃条件下培养4h后,添加至终浓度为1.0mmol/L的IPTG,然后在30℃条件下诱导培养6h,酶活达到最高,为4.998U/mL。

图 3 D-AI的诱导表达(a)及SDS-PAGE电泳(b)纯化Fig.3 SDS-PAGE electrophoresis of inducible expression SDS-PAGE electrophoresis of purifi ed enzymes
2.4 D-阿拉伯糖异构酶的酶学性质
2.4.1 酶反应最适pH值以及pH值稳定性
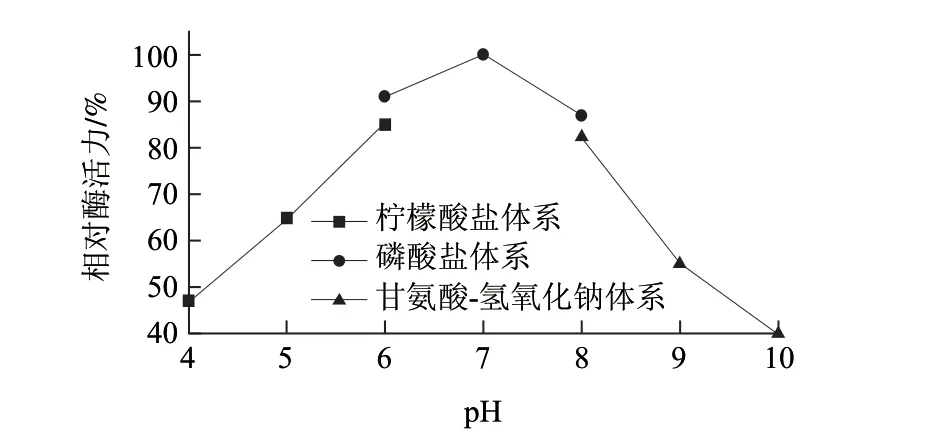
图 4 酶反应最适pH值曲线Fig.4 Enzyme reaction optimum pH curve

图 5 酶的pH值稳定性曲线Fig.5 pH stability curves
由图4可知,随着体系从酸性向中性过渡,相对酶活逐渐升高,而当体系逐渐偏碱性后,相对酶活力迅速下降,所以纯化酶液的最适反应pH值为7.0。由图5可知,纯化酶液的pH值稳定范围较宽,在pH6.0~8.0范围内放置lh后,酶活均能保持90%以上。且在相同pH值为6.0的体系下,磷酸盐体系明显比柠檬酸盐体系能更好的作用于该酶,可能原因是柠檬酸盐对该酶有一定的抑制作用;同样,在相同pH值为8.0的体系下,磷酸盐体系明显比甘氨酸-氢氧化钠体系能更好的作用于该酶,可能原因是甘氨酸对该酶有一定的抑制作用,因此选择pH 7.0的磷酸二氢钠-磷酸氢二钠缓冲液是最合适的。
2.4.2 最适温度以及温度稳定性
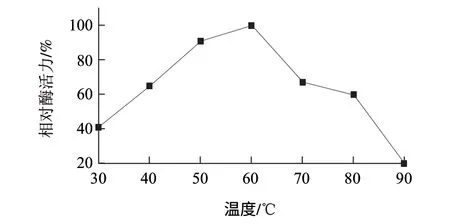
图 6 酶反应最适温度曲线Fig.6 Optimal enzyme reaction enzyme reaction

图 7 酶的热稳定性曲线Fig.7 Thermal stability curve
由图6、7可知,纯化酶液最适温度为60℃。在30~60℃条件下温度稳定性良好,基本变化不大,但是在70℃时相对酶活力降低为60%,随着温度继续升高,酶的热稳定性和酶活力显著降低,在90℃时相对酶活力降低到只有15%,基本快完全失活了。
结果表明,实验所得的D-阿拉伯糖异构酶是一种耐热性能较好的酶,它可以在较高温度下进行催化反应。高的反应温度可以增加糖的溶解性,减少微生物生长,消除在反应过程中因温度变化所需的能耗[14],这对酶的催化反应是十分有利的。在用半乳糖生产塔格糖的工业化应用中,D-阿拉伯糖异构酶可以满足高温(>50℃)生成的要求。
2.4.3 金属离子对酶活性的影响

表 2 金属离子对酶活性的影响(n=3)Table 2 Effect of metal ion on enzyme activity (n=3)
添加某些金属离子可以起到利于酶发挥活性与维持热稳定性的作用,所以本实验考察了加入不同离子(浓度均为5mmol/L)对D-阿拉伯糖异构酶酶活性的影响,由表2可知,Mn2+、Zn2+、Ca2+、Fe2+、Ba2+分别增强酶活力92%、30%、21%、55%、8%,而Mg2+和Cu2+则分别对酶活力产生了不同程度的抑制。
Mn2+是大多数目前发现的D-AI反应需要的金属离子,不同浓度的Mn2+对酶活性影响很大,因此分析了不同浓度的Mn2+对酶活性的影响。

图 8 不同浓度的Mn2+对酶活性的影响Fig.8 Effect of different concentration of Mn2+ on enzymatic activity
由图8可知,随着Mn2+浓度的增加,相对酶活力逐渐增加,当反应液中Mn2+浓度达到5mmol/L时,相对酶活力达到最高。因此在做酶的转化实验时可以加入终浓度为5mmol/L的Mn2+来进行反应。
2.5 最佳酶转化反应条件的选择
2.5.1 pH值对D-阿拉伯糖异构酶转化的影响

图 9 pH值对酶转化反应的影响Fig.9 Effect of pH on enzymatic conversion reaction
由图9可知,pH6.0和pH7.0时不同反应时间对酶转化率的影响不大。pH值为8.0的时候转化率偏低一点,原因是在偏酸性条件下产物D-塔格糖比较稳定,而在偏碱性环境下D-塔格糖不稳定,容易转化形成其他物质,造成其含量偏低。
2.5.2 温度对D-阿拉伯糖异构酶转化的影响
由图10可知,温度对酶转化率的影响比较明显,60℃时转化率最高。50℃的转化率低于60℃的转化率,原因是反应温度未达到酶的最适反应温度,因此酶与底物没有更好的结合在一起,导致产物含量偏低。而65℃的转化率最低,是因为温度过高,使部分酶失活,导致酶活性位点与底物不能更多的结合,对酶的转化产生了较大影响,从而使转化率降低。

图 10 温度对酶转化反应的影响Fig.10 Effect of temperature on enzymatic conversion reaction
2.5.3 不同质量浓度的底物对D-阿拉伯糖异构酶转化的影响
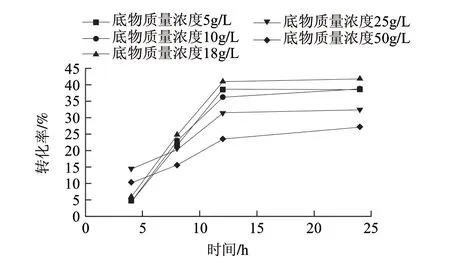
图 11 底物质量浓度对酶转化反应的影响Fig.11 Effect of substrate concentration on enzymatic conversion reaction
由图11可知,在12h之内,随着底物质量浓度的逐渐增加,D-塔格糖的生成量是逐渐增加的。在反应过程中,酶的质量浓度为定值,底物的起始质量浓度较低时,酶促反应速率与底物质量浓度成正比,即随底物质量浓度的增加而增加。当所有的酶与底物结合生成产物后,即使再增加底物质量浓度,产物质量浓度也不会增加,酶促反应速率也不增加。在18g/L底物质量浓度时参与酶反应后转化率更高一些,因此确定半乳糖质量浓度为18g/L最为合适。在12h之内,随着转化时间的逐渐增加,D-塔格糖的生成量是逐渐增加的,在转化12h后基本达到动态平衡,在18g/L底物质量浓度时其最高转化率可达41.6%。
3 结 论
由于野生菌株培养不易以及酶制备较困难(产酶水平低),因此,通过基因工程技术对其进行高效制备是实现其工业应用的关键步骤之一。同时,阿拉伯糖异构酶催化半乳糖异构化为塔格糖的反应为一可逆过程,在高温条件下,此反应平衡偏向于塔格糖。因此,高温阿拉伯糖异构酶的获得在塔格糖工业生产和高效制备中具有十分重要的意义。
本研究选择耐高温型菌株Geobacillus pallidus基因组DNA作为模板,用PCR方法克隆得到D-阿拉伯糖异构酶基因D-AI,并将其转入表达载体pET-28a中表达。经SDSPAGE分析,30℃条件下诱导培养6h,酶活力达到最高,且目的蛋白主要以可溶性蛋白形式存在于菌体中。
D-阿拉伯糖异构酶的最适反应温度和pH值分别为60℃和7.0,而报道的大部分异构酶的最适温度都小于60℃,且最适pH值均在偏碱性条件,但塔格糖的稳定pH值范围是在2.0~7.0,所以该酶比报道的酶更适合生产塔格糖。Mn2+对D-阿拉伯糖异构酶有明显的激活作用,而Cu2+则对D-阿拉伯糖异构酶有显著的抑制作用,可使酶几乎完全失活。
将底物质量浓度为18g/L的D-半乳糖(含5mmol/L的Mn2+),加入pH值为7.0的重组细胞粗酶液中,在60℃条件下反应12h,可达到最高转化率为41.6%,有报道显示,来源于耐高温菌Bacillus stearothermophilis IAM 1100l基因的重组阿拉伯糖异构酶菌株,全细胞反应24h后D-塔格糖的转化率才达到39.8%[15]。这表明具有生物活性的重组D-AI在大肠杆菌E.coli(BL21)中成功表达了,且该D-AI具备工业化生产D-塔格糖的潜能,但D/L-AI催化D-半乳糖转化为D-塔格糖的过程仍然需要更进一步的比较研究。
[1] TAKEDA K, YOSHIDA H, TAKADA G, et al. Overexpression, purifi cation, crystallization and preliminary X-ray crystal analysis of Bacillus pallidus D-arabinose isomerase[J]. Acta Cryst, 2008, F64 (Pt 10): 945-948.
[2] MENAVUVU B T, POONPERM W, TAKEDA K, et al. Novel substrate specificity of D-arabinose isomerase from Klebsiella pneumoniae and its application to production of D-altrose from D-psicose[J]. Biosci Bioeng , 2006, 102: 436-441.
[3] LEVIN G V. Tagatose, the new GBAS sweetener and health product[J]. J Medicinal Food, 2002, 5: 23-36.
[4] LIVESEY G, BROWN J C. Whole-body metabolism is not restrict to D-sugars as energy metabolism of L-sugars fi ts computational model in rats[J]. Nutr, 1995, 125: 3020-3029.
[5] ANDERSEN H, VIGH M L. Synergistic combination of sweeteners including D-tagatose: US, 6432464B 1[P]. 2002-08-13.
[6] DONNER T W, WILBER J F, OSTROWSKI D. D-Tagatose, a novel hexose:acute effects on carbohydrate tolerance in subjects with and without type 2 diabetes[J]. Diabetes Obesity and Metabolism, 1999, l: 285-291.
[7] NORMEN L, LAERKE H N, JENSEN B, et a1. Small-bowel absorption of D-tagatose and related effects on carbohydrate digestibility: an ileostomy study[J]. American J Clinical Nutrition, 2001, 73: 105-110.
[8] 寇秀颖, 黄东东, 王三永. 塔格糖制备方法研究进展[J]. 食品工程, 2007(3): 14-16.
[9] IZUMORI K, TOUZAKI K. Production of D-tagatose from D-galactitol by Mycobacterium smegmatis[J]. J Fermentation Technology, 1988, 66: 225-227.
[10] MANZONI M, ROLLINI M, BERGOMI S. Biotransformation of D-Galactitol to tagatose by acetic acid bacteria[J]. Process Bio Chemistry, 2001, 36: 971-977.
[11] CHEETHAM P S J, WOOTTON A N. Bioconversion of D-galactose into D-tagatose[J]. Enzyme and Microbial Technology, 1993, 15: 105-108.
[12] DISCHE Z, BORENFREUND E. A new spectrophotometric method for the detection and determination of keto sugar and trioses[J]. J Biological Chemistry, 1951, 192: 583-587.
[13] 刘箭. 分子生物学及基因工程实验教程[M]. 北京: 科学出版社, 2008.
[14] IBRAHIM OSAMA O, SPRADLIN JOSEPH E. Process for manufacturing D-tagatose: US, 6057135[P]. 2000-05-02.
[15] 程丽芳, 沐万孟, 张涛, 等. Bacillus stearothermophilus IAM 11001 L-阿拉伯糖异构酶在大肠杆菌中的表达、纯化及活性研究[J]. 中国生物工程杂志, 2008, 28(9): 52-55.
