酿酒酵母L-阿拉伯糖转化乙醇代谢工程的研究进展
2014-05-04汪城墙张艳艳鲍晓明
汪城墙,沈 煜,张艳艳,索 凡,侯 进,鲍晓明
(山东大学 微生物技术国家重点实验室,济南 250100)
燃料乙醇是公认的最有发展前景的新型生物能源[1]。第一代燃料乙醇的生产主要是以粮食为原料。2011年,全世界的生物乙醇产量为1.06亿L,2012年产量可以达到1.13亿L[2]。由于第一代燃料乙醇的生产存在与人争粮的问题,因而提出以木质纤维素材料为原料的第二代燃料乙醇生产策略,以推进燃料乙醇的规模化应用。木质纤维素材料是地球上最丰富的可再生资源之一,是燃料乙醇生产的廉价原料[3-5]。我国是农业大国,有十分丰富的农作物秸秆、林木枝条为主的富含大量木质纤维素成分的农林业废弃物资源。自20世纪70年代以来,有关生物质的全糖利用问题已成为木质纤维素原料再生性能源开发的重要课题。开发生产工艺将木质纤维素原料充分转化成单糖组分,并将得到的所有单糖组分转化成乙醇,是木质纤维素发酵生产乙醇的必要条件,这一观点已达成普遍共识[6-7]。构建可以发酵全糖组分的微生物工程菌株是纤维素乙醇规模化生产与应用的前提条件之一[8]。
木质纤维素包含纤维素、半纤维素和木质素三部分,其中纤维素、半纤维素包含多种己糖及戊糖组分,表1中列出了常见的几种木质纤维素原料中的主要单糖含量。从表1可以看出,虽然不同种类木质纤维素原料中L-阿拉伯糖的含量差别较大[9],但其含量在木质纤维素糖组分中位于第三位[10]。同时它和木糖一样,是比较容易通过预处理过程从木质纤维素原料中释放出来的糖分,是木质纤维素全糖乙醇发酵的重要底物成分[11]。木质纤维素原料中的大部分单糖都是D型,但L-阿拉伯糖却主要以L型呋喃糖的形式存在[10]。
酿酒酵母(Saccharomyces cerevisiae)是广泛应用于食品及化工工业生产的微生物,人们对酿酒酵母的利用已有上千年的历史。作为传统的乙醇发酵菌株,其具有乙醇产量高、厌氧生长,抗逆性强等诸多优良生产性状,因而成为第二代燃料乙醇产业化进程中备受关注的重要微生物[2]。虽然野生型的酿酒酵母可以通过非特异性的醛糖还原酶转化L-阿拉伯糖生成阿拉伯糖醇,但很难完成后续代谢步骤[12]。通过表达缺乏的L-阿拉伯糖代谢最初几步所需的酶基因,可以赋予其代谢L-阿拉伯糖的能力。酿酒酵母L-阿拉伯糖代谢工程的研究,起步远晚于木糖代谢工程的研究,近几年来取得了阶段性进展,有效地拓展了酿酒酵母的底物利用范围[11,13],提高了木质纤维素原料的利用效率,推进了第二代燃料乙醇生产过程的成本节约和经济可行的进程。
本文中笔者综述近年来有关遗传改造的酿酒酵母在代谢L-阿拉伯糖方面的研究,分析其研究进展,为其在工业领域的应用提供参考。
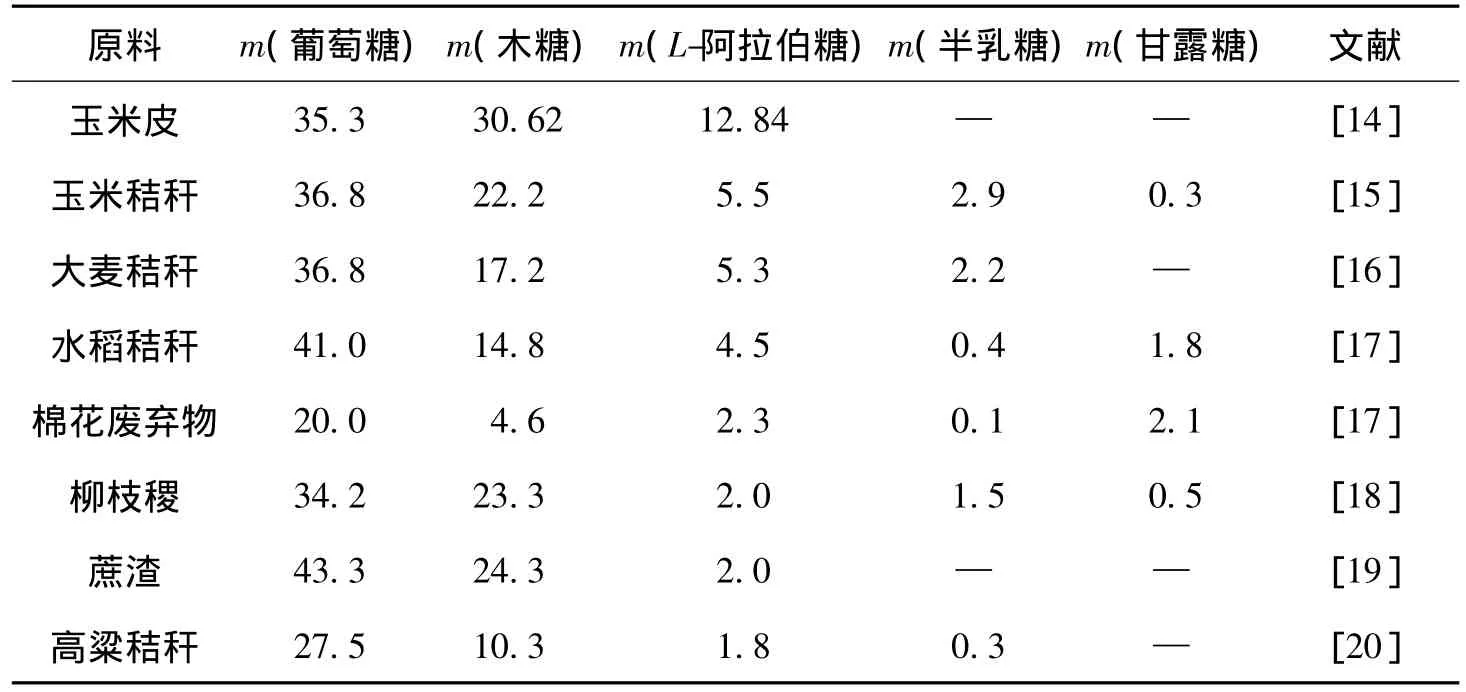
表1 不同木质纤维素原料中部分单糖的含量Table 1 Sugar composition of various lignocellulosic raw materials g
1 L-阿拉伯糖代谢途径
自然界中,主要有2条L-阿拉伯糖的初始代谢途径(图1)[11],分别存在于细菌和真菌中。其中,细菌L-阿拉伯糖代谢途径(图1,①)较为简单[21]:L-阿拉伯糖经转运蛋白进入细胞后,在L-阿拉伯糖异构酶(L-arabinose isomerase,AI)作用下转化为其异构体 L-核酮糖,L-核酮糖由 L-核酮糖激酶(L-ribulokinase,RK)磷酸化后生成 L-核酮糖-5-磷酸,进一步经 L-核酮糖-5-磷酸-4-差向异构酶(L-ribulose-5-P-4-epimerase,RPE)作用产生细胞可代谢的5-磷酸木酮糖;真菌L-阿拉伯糖代谢途径(图1,②)相对复杂[22],涉及5个酶,由4个交替的氧化还原反应组成。在这条代谢途径中,L-阿拉伯糖首先被L-阿拉伯糖还原酶(arabinose reductase,AR)还原成L-阿拉伯糖醇,再被L-阿拉伯糖醇-4-脱氢酶(L-arabinitol 4-dehydrogenase,LAD)转化成 L-木酮糖,L-木酮糖经 L-木酮糖还原酶(L-xylulose reductase,LXR)还原成木糖醇,木糖醇在木糖醇脱氢酶(D-xylitoldehydrogenase,XDH)和木酮糖激酶(xylulokinase,XK)作用下生成5-磷酸木酮糖。以上两条初始代谢途径中,L-阿拉伯糖均被转化生成5-磷酸木酮糖,进入细胞内的磷酸戊糖途径(pentose phosphate pathway,PPP)进一步被代谢,由中间产物6-磷酸果糖和3-磷酸甘油醛的形式进入糖酵解途径(EMP)或Entner-Doudoroff途径(ED),在限氧或厌氧条件下生成乙醇,完成整个发酵过程[12]。比较这2种途径,真菌途径涉及基因较多,代谢过程中的氧化还原反应存在辅酶不平衡问题,较为复杂;而细菌途径只涉及3个酶,是酿酒酵母L-阿拉伯糖代谢工程改造的便利途径。
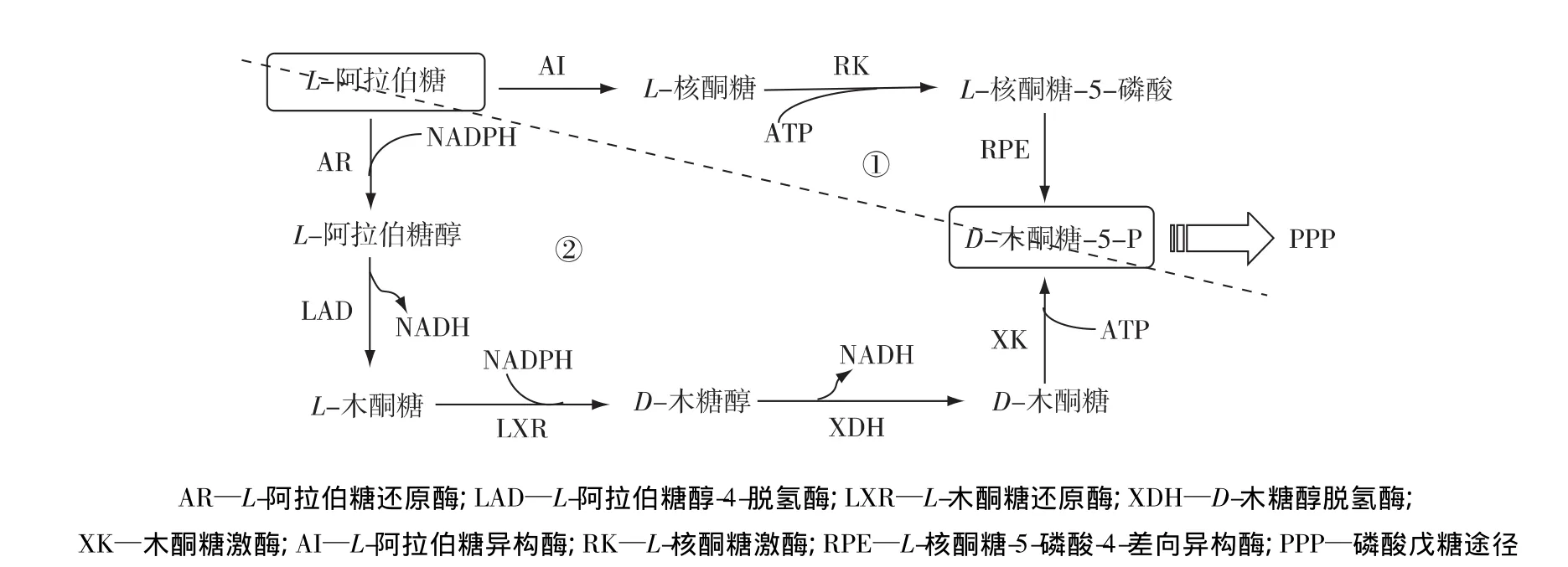
图1 微生物细胞的L-阿拉伯糖初始代谢途径Fig.1 Initial metabolic pathway of L-arabinose in micro-organisms
2 酿酒酵母的L-阿拉伯糖代谢工程研究
根据代谢工程理念,用基因工程手段,将L-阿拉伯糖初始代谢途径引入酿酒酵母中,可以构建能代谢L-阿拉伯糖产生乙醇的工程菌株[23]。细菌和真菌L-阿拉伯糖代谢途径均有研究者尝试在酿酒酵母中建立。
2.1 酿酒酵母中细菌L-阿拉伯糖代谢途径的构建
细菌L-阿拉伯糖初始代谢途径,通过分别由araA、araB和araD编码的3种酶:L-阿拉伯糖异构酶、L-核酮糖激酶和RPE,可将L-阿拉伯糖转化为D-木酮糖-5-P(图1,①),此过程不涉及辅酶参与的氧化还原反应。通过对细菌L-阿拉伯糖代谢途径中不同来源基因的分析与优化,并结合进化工程选育和转运系统强化,可以提高重组酿酒酵母L-阿拉伯糖的代谢能力。
2.1.1 L-阿拉伯糖异构酶的表达活性是主要限速步骤
目前为止,来源于大肠杆菌(Escherichia coli)[24-25]、植物乳杆菌(Lactobacillus plantarum)[11]、枯草芽胞杆菌(Bacillus subtilis)[25]、地衣芽胞杆菌(Bacillus licheniformis)[26]、戊糖片球菌(Pediococcus pentosaceus)[26]、肠 系 膜 明 串 珠 菌 (Leuconostoc mesenteroides)[26]和 丙 酮 丁 醇 梭 菌 (Clostridium acetobutylicum)[26]等细菌的 L-阿拉伯糖初始代谢途径相关基因已在酿酒酵母中成功表达。Sedlak等[24]于2001年首次报道在酿酒酵母中异源表达了大肠杆菌(E.coli)的L-阿拉伯糖初始代谢途径,但重组菌株不能利用L-阿拉伯糖生长,也没有检测到乙醇的生成,而重组菌株在非特异性醛糖还原酶作用下产生并积累了大量的副产物阿拉伯糖醇。这表明,大肠杆菌L-阿拉伯糖异构酶在酿酒酵母细胞内没有功能性表达。Becker等[25]用枯草芽胞杆菌(B.subtilis)来源的araA基因代替大肠杆菌的araA基因,研究发现重组酿酒酵母的L-阿拉伯糖异构酶的活性较高,且能够利用L-阿拉伯糖生长,在限氧条件下,菌株代谢L-阿拉伯糖生成乙醇的速率为0.06 ~0.08 g/(h·g)(以细胞干质量计)。在此基础上,Wiedemann等[26]通过密码子优化策略提高了araA(B.subtilis)、araB和 araD 3个基因的表达水平,使L-阿拉伯糖的利用速率从0.08 g/(h·g)提高到0.11 g/(h·g),乙醇得率从0.24 g/g 提高到0.39 g/g(以1 g L-阿拉伯糖计)。笔者所在课题组的Wang等[27]将经过密码子优化的植物乳杆菌(L.plantarum)L-阿拉伯糖初始代谢途径的3个基因整合表达在酿酒酵母染色体中,但重组菌株在L-阿拉伯糖培养基上依然不能生长;进一步通过强启动子TEF1以附加体2μ质粒形式提高L-阿拉伯糖异构酶的表达量后,经过150 h的孵育之后,获得了在L-阿拉伯糖培养基上能生长的重组菌株。以上实验结果表明,细菌L-阿拉伯糖代谢途径的3个酶基因中,第一个酶基因araA在酿酒酵母中的高表达活性是使途径得以畅通的重要前提。
2.1.2 PPP途径强化提高L-阿拉伯糖的代谢能力
L-阿拉伯糖转化生成的5-磷酸木酮糖,需通过PPP途径进一步被代谢(图 1)。Wisselink等[11]将PPP途径非氧化阶段的4个重要基因转醛醇酶基因(TAL1)、转酮醇酶基因 (TKL1)、RPE基因 (RPE1)和5-磷酸核糖酮醇异构酶基因 (RKI1),过表达在带有植物乳杆菌L-阿拉伯糖代谢途径的酿酒酵母中,并结合进化工程手段育种后得到了目前最佳的L-阿拉伯糖单糖代谢重组菌株。其L-阿拉伯糖的单糖利用速率提高到0.7 g/(h·g),乙醇生成速率增加到0.29 g/(h·g),乙醇产率达到 0.43 g/g(以 1 g L-阿拉伯糖计)。Wisselink等[28]对乙醇产量提高的进化后菌株的转录组结果分析表明,基因TKL2和YGR043c(分别为PPP途径中的转酮醇酶和转醛醇酶的同功酶)的表达水平分别提高了2.9倍和6.1倍,敲除2个基因则导致L-阿拉伯糖的比消耗速率降低了21%。对L-阿拉伯糖厌氧发酵条件下的代谢流量分析发现,其通过胞内PPP途径的代谢流量是葡萄糖发酵条件下的30倍以上。这证明PPP途径相关下游途径基因的高水平表达是强化L-阿拉伯糖发酵能力的重要原因。Wang等[27]将PPP途径相关基因超表达在了含有密码子优化后的植物乳杆菌源的araA、araB和araD 3个基因的重组菌株中,也增强了菌株代谢L-阿拉伯糖的能力,再进一步结合适应性进化策略育种之后,得到了1株在厌氧条件下L-阿拉伯糖比利用速率超过0.49 g/(h·g)的菌株,乙醇产率可达到0.42 g/g(以1 g L-阿拉伯糖计)。分析主要原因是由于下游途径基因的高水平表达促使了L-阿拉伯糖代谢流量向生成乙醇的方向集中,最终增加了乙醇产量。下游途径的强化是进一步提高L-阿拉伯糖的代谢速率和乙醇生成速率的有效措施。
2.1.3 适应性进化显著提高重组菌株代谢L-阿拉伯糖的能力
在酿酒酵母中表达细菌初始L-阿拉伯糖代谢途径后,所得重组菌株不能立即获得在L-阿拉伯糖上的生长能力,但菌株进一步用适应性进化手段在以L-阿拉伯糖为唯一C源的培养基上驯化之后,很多菌株获得了L-阿拉伯糖的显著代谢能力。Becker等[25]将枯草芽胞杆菌(B.subtilis)来源的araA基因和大肠杆菌的araB和araD基因异源表达在酿酒酵母中,Wisselink等[11]将植物乳杆菌来源的L-阿拉伯糖代谢途径异源表达在酿酒酵母中,但所得到的2种重组菌株并不能在L-阿拉伯糖培养基上生长,经过进一步在L-阿拉伯糖培养基上的一系列转接之后,重组菌株获得了在L-阿拉伯糖培养基上的快速生长能力。Wang等[27]得到的第1株在L-阿拉伯糖上生长的菌株,也是在L-阿拉伯糖培养基上经过150 h的孵育之后才出现了明显生长。
2.2 酿酒酵母中真菌L-阿拉伯糖代谢途径的构建
真菌L-阿拉伯糖初始代谢途径通过5种酶:L-阿拉伯糖还原酶、L-阿拉伯糖醇-4-脱氢酶、L-木酮糖还原酶、木糖醇脱氢酶和木酮糖激酶作用生成D-木酮糖-5-P(图1,②),此过程由4个交替的氧化还原反应组成。陆续克隆得到上述5种酶之后,重组酿酒酵母获得了L-阿拉伯糖的代谢能力。通过改变4个氧化还原酶的辅酶偏好性,可以提高重组酿酒酵母L-阿拉伯糖的代谢能力。
2.2.1 完整真菌L-阿拉伯糖代谢途径在酿酒酵母中的建立
在细菌L-阿拉伯糖代谢途径研究的同时,真菌中涉及此途径的5个酶基因陆续被发现,并在酿酒酵母中功能表达:酿酒酵母和毕赤酵母中存在L-阿拉伯糖还原酶和木酮糖激酶,多种真菌中含有木糖醇脱氢酶[29];直到瑞氏木霉中的L-阿拉伯糖醇脱氢酶和L-木酮糖还原酶被发现并在酿酒酵母中表达,完整的真菌L-阿拉伯糖代谢途径从而得以在酿酒酵母中构建[29-31]。Richard 等[29-31]报道,在酿酒酵母中构建上述真菌L-阿拉伯糖代谢途径,得到的重组菌株可在L-阿拉伯糖上生长,并在厌氧条件下生成乙醇。
2.2.2 辅酶不平衡是限制此途径代谢能力的重要因素
真菌L-阿拉伯糖代谢途径的4步交替的氧化还原反应中,2个还原酶对辅酶NADPH的亲和性高于对辅酶 NADH的亲和性,而2个脱氢酶严格以NAD+为辅酶,从而造成NADH的积累,造成胞内辅酶的不平衡,限制 L-阿拉伯糖的代谢能力[31]。Richard等[29]构建的含有真菌L-阿拉伯糖代谢途径的菌株的L-阿拉伯糖利用速率明显低于细菌途径,其主要原因是代谢过程中辅酶不平衡造成的。Bengtsson等[32]将1个对NADH亲和力提高的阿拉伯糖还原酶(AR)(K270R)和1个NADH依赖的L-木酮糖还原酶(ALK)[33]代替 Richard 等[29]研究中相应的酶组分,在酿酒酵母中构建了辅酶偏好性优化后的L-阿拉伯糖真菌代谢途径,辅酶不平衡问题得到一定程度的缓解,得到的菌株在L-阿拉伯糖和葡萄糖混合发酵下,副产物阿拉伯糖醇转化率明显下降,乙醇产率达到 0.42 g/g(以 1 g总糖计)[34]。Ghosh 等[35]对 L-阿拉伯糖真菌代谢途径和木糖的XR-XDH途径辅酶不平衡问题进行研究后发现,酿酒酵母中辅酶平衡的代谢途径比不平衡途径可以提高24.7%的乙醇产量。可见,辅酶不平衡问题是制约真菌途径代谢能力提高的重要限制因素,此途径的后续研究重点应集中在进一步优化辅酶偏好性以提高酶分子功能等方面。
3 葡萄糖、木糖和L-阿拉伯糖共糖代谢微生物工程菌株的构建
充分利用木质纤维素原料,需要在酿酒酵母中整合葡萄糖、木糖和L-阿拉伯糖的代谢。L-阿拉伯糖代谢研究中,一项重要的工作是在酿酒酵母中同时整合木糖发酵途径,以构建葡萄糖、木糖和L-阿拉伯糖的共糖发酵菌株,以期得到发酵全糖组分的微生物工程菌株。目前已经有一些工作报道了共糖发酵工程菌株的研究。
3.1 L-阿拉伯糖的细菌代谢途径和木糖XR-XDH途径的共表达
Karhumaa等[36]将细菌L-阿拉伯糖代谢途径引入酿酒酵母实验室菌株和工业菌株中,同时共表达木糖的XR-XDH代谢途径,构建了共代谢L-阿拉伯糖和木糖的酿酒酵母实验室菌株和工业菌株,在过表达了枯草芽胞杆菌来源的阿拉伯糖异构酶后,明显提高了菌株的L-阿拉伯糖利用能力。这证明了2条戊糖代谢途径共表达的可操作性,不过此共表达策略会增加副产物L-阿拉伯糖醇的产生。Sanchez等[37]将细菌L-阿拉伯糖途径和XR-XDH途径整合表达在工业酿酒酵母后,采用进化策略改造菌株,在好氧或厌氧条件下,L-阿拉伯糖和木糖的利用率都得到加强,但L-阿拉伯糖基本全部转化为副产物阿拉伯糖醇。这说明XR-XDH途径中的XR减少了L-阿拉伯糖细菌途径向乙醇代谢的流向,增加了向副产物L-阿拉伯糖醇的代谢流向。
3.2 L-阿拉伯糖的细菌代谢途径和木糖异构酶(XI)途径的共表达
为了缓解细菌L-阿拉伯糖代谢途径受XR-XDH途径的影响,与不含醛糖还原酶的XI途径的共表达是较佳选择。Wisselink等[13]将细菌L-阿拉伯糖代谢途径和XI代谢途径共表达,得到了共利用葡萄糖、木糖和 L-阿拉伯糖的重组菌株[11,13]。共糖发酵结果显示,乙醇产率达到0.43 g/g(以1 g总糖计),并且没有副产物木糖醇和阿拉伯糖醇的积累。此共表达策略构建的重组菌株的进化潜力较大,在进一步用三糖培养基(葡萄糖、木糖和L-阿拉伯糖)、双糖培养基(木糖和L-阿拉伯糖)和L-阿拉伯糖单糖培养基依次重复选育之后,重组菌株的三糖(30 g/L葡萄糖、15 g/L木糖和15 g/L L-阿拉伯糖)发酵的总时间从60 h降为35 h,这是目前实验室菌株在三糖共发酵情况下的最佳结果。以上结果说明,L-阿拉伯糖的细菌代谢途径和木糖的XI途径的共表达是理想策略。
3.3 L-阿拉伯糖的真菌代谢途径可同时代谢木糖
XR-XDH代谢途径中的醛糖还原酶、木糖醇脱氢酶和木酮糖激酶亦是阿拉伯糖真菌途径中的3个酶,表达有L-阿拉伯糖的真菌代谢途径的菌株亦具有代谢木糖的能力。Bettiga等[34]构建的含有L-阿拉伯糖真菌代谢途径的菌株实现了葡萄糖、木糖和L-阿拉伯糖的混糖发酵。在葡萄糖消耗后,菌株木糖和 L-阿拉伯糖的消耗速率分别达到 0.08 g/(h·g)和 0.02 g/(h·g),乙醇得率达到 0.35 g/g(以1 g戊糖计)。Bera等[38]在含有XR-XDH代谢途径的菌株中额外表达了阿拉伯糖醇脱氢酶(LAD)和L-木酮糖还原酶(ALK),也得到了同时代谢L-阿拉伯糖的菌株,乙醇得率超过40%。
4 酿酒酵母的L-阿拉伯糖转运蛋白研究
L-阿拉伯糖需通过转运蛋白的协助才可以进入酿酒酵母细胞,并且这一转运过程受到葡萄糖的强烈抑制。Subtil等[39]证明了葡萄糖对L-阿拉伯糖的抑制效应主要发生在转运环节,L-阿拉伯糖转运速率是L-阿拉伯糖利用的限速步骤之一。Richard等[29]对L-阿拉伯糖代谢菌株的分子机制分析发现,L-阿拉伯糖转运能力的提高是菌株对L-阿拉伯糖利用能力增强的原因。在酿酒酵母菌株中表达可缓解葡萄糖抑制的L-阿拉伯糖高效转运蛋白能提高菌株的L-阿拉伯糖代谢能力。
4.1 酿酒酵母内源L-阿拉伯糖转运蛋白的功能研究
野生型酿酒酵母不能发酵L-阿拉伯糖,但是可以通过对L-阿拉伯糖亲和性较低的內源己糖运输蛋白 Gal2p[40]、Hxt9p 和 Hxt10p 来摄取 L-阿拉伯糖[41],其中,Gal2p的 L-阿拉伯糖转运能力最强。Becker等[25]通过超表达 GAL2基因,促进了酿酒酵母对 L-阿拉伯糖的吸收。Richard等[30]在菌株IMS0002中,通过敲除GAL2基因,证明了Gal2p是酿酒酵母利用L-阿拉伯糖为唯一C源生长的必要前提。Wang等[27]在驯化后的L-阿拉伯糖代谢菌株中进一步超表达GAL2基因后,菌株的L-阿拉伯糖代谢能力进一步提高,其中,L-阿拉伯糖比利用速率提高了24%,达到0.61 g/(h·g),乙醇产率提高到0.43 g/g(以1 g总糖计)。
4.2 异源L-阿拉伯糖转运蛋白促进L-阿拉伯糖的利用
异源表达不受葡萄糖抑制的或葡萄糖抑制程度较低的L-阿拉伯糖转运蛋白可以进一步提高酿酒酵母的 L-阿拉伯糖利用能力。Verho等[42]从酵母Ambrosiozyma monospora中扩增得到了2个L-阿拉伯糖特异性转运蛋白,2个蛋白的表达提高了酿酒酵母转运L-阿拉伯糖的能力。Subtil等[41]利用内源18个己糖转运蛋白全部缺失的酿酒酵母突变株研究不同来源的转运蛋白,发现毕赤酵母(Scheffersomycesstipitis)的 AraTp和拟南芥(Arabidopsis thaliana)中的Stp2p转运蛋白在酿酒酵母中得到了功能性表达并且具有L-阿拉伯糖转运功能,尤其在低浓度L-阿拉伯糖条件下具有很强的L-阿拉伯糖转运能力,并且几乎不转运葡萄糖。此研究对L-阿拉伯糖转运蛋白的研究起了巨大的推进作用。笔者所在课题组近期从皮状丝孢酵母(Trichosporon cutaneum)中扩增得到了2条在酿酒酵母中具有L-阿拉伯糖转运功能的转运蛋白,其中1条为L-阿拉伯糖专一性转运蛋白,转运速率为Gal2p的22%(数据尚未发表)。目前为止,人们已在可以代谢L-阿拉伯糖的真菌和细菌中发现了多种L-阿拉伯糖转运蛋白,但在酿酒酵母中高效表达L-阿拉伯糖专一性转运蛋白,提高菌株代谢L-阿拉伯糖能力的研究尚不足[43],这也将是L-阿拉伯糖工程菌研究的重要课题之一。
5 结论与展望
通过基因工程策略,结合适应性进化和育种等手段,细菌和真菌的L-阿拉伯糖代谢途径均在酿酒酵母菌株中成功建立和表达,并能在厌氧或限氧条件下生成乙醇,有效扩展了酿酒酵母的底物利用范围。高效的全糖发酵菌株的获得是燃料乙醇生产可行的关键。经济可行的利用木质纤维素原料生产燃料乙醇,需要充分利用木质纤维素水解液中的葡萄糖、木糖和L-阿拉伯糖。酿酒酵母的木糖转化乙醇代谢工程菌株的研究已经取得了较大进展,纯糖的乙醇转化率已接近理论值的90%,但纤维素原料水解混合糖液的木糖发酵效果逊色于纯糖发酵。酿酒酵母的L-阿拉伯糖乙醇转化工程菌株的研究相对滞后,纤维素原料水解混合糖液的L-阿拉伯糖发酵测试结果尚无相关文献报道。目前,所研究的全糖发酵工艺大多处于实验室研究阶段,还没有得到稳定的、经济上可行的、能进入产业化阶段的优良重组菌株,尚需进一步将研究成果从实验室研究有效转接到工业应用中来。未来的L-阿拉伯糖代谢研究将集中在己糖和戊糖全糖高效共利用角度,尤其是对存在抑制物的原料水解液糖组分的共利用,以缩短发酵时间,提高乙醇生成速率和产量。寻找可以在酿酒酵母中高效表达并且不影响菌株生长能力的异源L-阿拉伯糖专一性转运蛋白,缓解葡萄糖抑制效应,也是提高L-阿拉伯糖以及全糖共利用效率的重要策略之一。
[1] Hahn-Hägerdal B,Galbe M,Gorwa-Grauslund M F,et al.Bioethanol:the fuel of tomorrow from the residues of today[J].Trends Biotechnol,2006,24(12):549-556.
[2] denHaan R,Kroukamp H,MertM,etal.Engineering Saccharomyces cerevisiae for next generation ethanol production[J].J Chem Technol Biotechnol,2013,88(6):983-991.
[3] Farrell A E,Plevin R J,Turner B T,et al.Ethanol can contribute to energy and environmental goals[J].Science,2006,311:506-508.
[4] Ragauskas A J,Williams C K,Davison B H,et al.The path forward for biofuels and biomaterials[J].Science,2006,311:484-489.
[5] Mabee W E.Policy options to support biofuel production[J].Adv Biochem Eng Biotechnol,2007,108:329-357.
[6] Galbe M,Zacchi G.A review of the production of ethanol from softwood[J].Appl Microbiold Biotechnol,2002,59(6):618-628.
[7] Suriyachai N,Weerasaia K,Laosiripojana N,et al.Optimized simultaneous saccharification and co-fermentation of rice straw for ethanol production by Saccharomyces cerevisiae and Scheffersomyces stipitis co-culture using design of experiments[J].Bioresour Technol,2013,142:171-178.
[8] Kim S R,Ha S J,Wei N,et al.Simultaneous co-fermentation of mixed sugars:a promising strategy for producing cellulosic ethanol[J].Trends Biotechnol,2012,30(5):274-282.
[9] Almeida J R M,Runquist D,Sànchez Nogué V,et al.Stressrelated challenges in pentose fermentation to ethanol by the yeast Saccharomyces cerevisiae[J].Biotechnol J,2011,6(3):286-299.
[10] Seiboth B,Metz B.Fungal arabinan and L-arabinose metabolism[J].Appl Microbiol Biotechnol,2011,89(6):1665-1673.
[11] Wisselink H W,Toirkens M J,Berriel M R F,et al.Engineering of Saccharomyces cerevisiae for efficient anaerobic alcoholic fermentation of L-arabinose[J].Appl Eenviron Microbiol,2007,73(15):4881-4891.
[12] Fonseca C,Romão R,Rodrigues de Sousa H,et al.L-arabinose transport and catabolism in yeast[J].FEBS J,2007,274(14):3589-3600.
[13] Wisselink H W,Toirkens M J,Wu Q,et al.Novel evolutionary engineering approach for accelerated utilization of glucose,xylose,and arabinose mixtures by engineered Saccharomyces cerevisiae strains[J].Appl Environ Microbiol,2009,75(4):907-914.
[14] Buhner J,Agblevor F.Effect of detoxification of dilute-acid corn fiber hydrolysate on xylitol production[J].Appl Biochem Biotechnol,2004,119(1):13-30.
[15] Öhgren K,Bura R,Saddler J,et al.Effect of hemicellulose and lignin removal on enzymatic hydrolysis of steam pretreated corn stover[J].Bioresour Technol,2007,98(13):2503-2510.
[16] Linde M,Galbe M,Zacchi G.Simultaneous saccharification and fermentation of steam-pretreated barley straw at low enzyme loadings and low yeast concentration[J].Enzyme Microbial Technol,2007,40(5):1100-1107.
[17] Lee J.Biological conversion of lignocellulosic biomass to ethanol[J].J Biotechnol,1997,56(1):1-24.
[18] Faga B A,Wilkins M R,Banat I M.Ethanol production through simultaneous saccharification and fermentation of switchgrass using Saccharomyces cerevisiae D5A and thermotolerant Kluyveromyces marxianus IMB strains[J].Bioresour Technol,2010,101(7):2273-2279.
[19] Carrasco C,Baudel H M,Sendelius J,et al.SO2-catalyzed steam pretreatmentand fermentation of enzymatically hydrolyzed sugarcane bagasse[J].Enzyme Microbial Technol,2010,46(2):64-73.
[20] Sathesh-Prabu C,Murugesan A G.Potential utilization of sorghum field waste for fuel ethanol production employing Pachysolen tannophilus and Saccharomyces cerevisiae[J].Bioresour Technol,2011,102(3):2788-2792.
[21] Schleif R.Regulation of the L-arabinose operon of Escherichia coli[J].Trends Genetics,2000,16(12):559-565.
[22] Hahn-Hägerdal B,Karhumaa K,Jeppsson M,et al.Metabolic engineering for pentose utilization in Saccharomyces cerevisiae[J].Adv Biochem Eng Biotechnol,2007,108:147-177.
[23] van Maris A J A,Abbott D A,Bellissimi E,et al.Alcoholic fermentation ofcarbon sources in biomasshydrolysatesby Saccharomyces cerevisiae:currentstatus[J].Antonie Van Leeuwenhoek,2006,90(4):391-418.
[24] Sedlak M,Ho N W Y.Expression of E.coli araBAD operon encoding enzymes for metabolizing L-arabinose in Saccharomyces cerevisiae[J].Enzyme Microbial Technol,2001,28(1):16-24.
[25] Becker J,Boles E.A Modified Saccharomyces cerevisiae Strain that consumes L-arabinose and produces ethanol[J].Appl Environ Microbiol,2003,69(7):4144-4150.
[26] Wiedemann B,Boles E.Codon-optimized bacterial genes improve L-arabinose fermentation in recombinant Saccharomyces cerevisiae[J].Appl Environ Microbiol,2008,74(7):2043-2050.
[27] Wang C,Shen Y,Zhang Y,et al.Improvement of L-arabinose fermentation by modifying the metabolic pathway and transport in Saccharomyces cerevisiae[J].BioMedRes Int,2013,doi:10.1155/2013/461204.
[28] Wisselink H W,CipollinaC,OudB,etal.Metabolome,transcriptome and metabolic flux analysis of arabinose fermentation by engineered Saccharomyces cerevisiae[J].Metab Eng,2010,12(6):537-551.
[29] Richard P,Verho R,Putkonen M,et al.Production of ethanol from L-arabinose by Saccharomyces cerevisiae containing a fungal L-arabinose pathway[J].FEMS Yeast Res,2003,3(2):185-189.
[30] Richard P,Londesborough J,Putkonen M,et al.Cloning and expression of a fungal L-arabinitol 4-dehydrogenase gene[J].J Biol Chem,2001,276(44):40631-40637.
[31] Richard P,Putkonen M,Vaananen R,et al.The missing link in the fungal L-arabinose catabolic pathway,identification of the L-xylulose reductase gene[J].Biochem,2002,41(20):6432-6437.
[32] Bengtsson O,Hahn-Hägerdal B,Gorwa-Grauslund M F.Xylose reductase from Pichia stipitis with altered coenzyme preference improves ethanolic xylose fermentation by recombinant Saccharomyces cerevisiae[J].Biotechnol Biofuels,2009,2:9.doi:10.1186/1754-6834-2-9.
[33] Verho R,Putkonen M,Londesborough J,et al.A novel NADH-linked L-xylulose reductase in the L-arabinose catabolic pathway of yeast[J].J Biol Chem,2004,279(15):14746-14751.
[34] Bettiga M,Bengtsson O,Hahn-Hagerdal B,et al.Arabinose and xylose fermentation by recombinantSaccharomycescerevisiae expressing a fungal pentose utilization pathway[J].Microb Cell Fact,2009,8:40.doi:10.1186/1475-2859-8-40.
[35] Ghosh A,Zhao H,Price N D.Genome-scale consequences of cofactor balancing in engineered pentose utilization pathways in Saccharomyces cerevisiae[J].PLoS One,2011,6(11):e27316.
[36] Karhumaa K,WiedemannB,Hahn-HägerdalB,etal.Coutilization ofL-arabinose and D-xylose by laboratory and industrial Saccharomyces cerevisiae strains[J].Microb Cell Fact,2006,5(1):18.doi:10.1186/1475-2859-5-18.
[37] Sanchez R G,Karhumaa K,Fonseca C,et al.Improved xylose and arabinose utilization by an industrial recombinant Saccharomyces cerevisiaestrain using evolutionary engineering[J].Biotechnol Biofuels,2010,3:13.doi:10.1186/1754-6834-3-13.
[38] Bera A K,Sedlak M,Khan A,et al.Establishment of L-arabinose fermentation in glucose/xylose co-fermenting recombinant Saccharomyces cerevisiae 424A(LNH-ST)by genetic engineering[J].Appl Microbiol Biotechnol,2010,87(5):1803-1811.
[39] Subtil T,Boles E.Competition between pentoses and glucose during uptake and catabolism in recombinant Saccharomyces cerevisiae[J].Biotechnol Biofuels,2012,5:14.doi:10.1186/1754-6834-5-14.
[40] Kou S C,Christensen M S,Cirillo V P.Galactose transport in Saccharomyces cerevisiae:II.characteristics of galactose uptake and exchange in galactokinaseless cells[J].J Bacteriol,1970,103(3):671-678.
[41] Subtil T,Boles E.Improving L-arabinose utilization of pentose fermenting Saccharomyces cerevisiae cells by heterologous expression of L-arabinose transporting sugar transporters[J].Biotechnol Biofuels,2011,4:38.doi:10.1186/1754-6834-4-38.
[42] Verho R,Penttila M,Richard P.Cloning of two genes(LAT1,2)encoding specific L-arabinose transporters of the L-arabinose fermenting yeast Ambrosiozyma monospora[J].Appl Biochem Biotechnol,2011,164(5):604-611.
[43] Leandro M J,Fonseca C,Goncalves P.Hexose and pentose transport in ascomycetous yeasts:an overview[J].FEMS Yeast Res,2009,9(4):511-525.
