转谷氨酰胺酶对鳙鱼糜热诱导胶凝特性的影响
2013-08-07刘明菲黎玉彬熊善柏
贾 丹,刘 茹,刘明菲,黎玉彬,熊善柏,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.国家大宗淡水鱼加工技术研发分中心(武汉),湖北 武汉 430070)
我国是淡水鱼渔业大国,2010年全国淡水鱼总产量2225.6万t,其中鳙鱼产量达225.08万t,居淡水鱼产量的第3位[1]。我国南方地区居民素有用鳙鱼头煲汤的习惯,造成鳙鱼头价格较高,而去除鱼头后鱼身的价格较低,将鳙鱼肉加工成鱼糜制品则可提高其经济价值[2],但鳙鱼糜较难形成凝胶且极易凝胶劣化[3],如何改善鱼糜制品的凝胶强度是鳙鱼糜加工所面临的主要问题。转谷氨酰胺酶(transglutaminase,TGase)作为一种常见的凝胶增强剂,能催化肌球蛋白重链(myosin heavy chains,MHC)上赖氨酸的ε-氨基与谷氨酸的γ-羟酰胺基形成共价键而促进蛋白质分子间或分子内的共价交联,从而提高鱼糜制品的弹性和紧实度[4],改善食品蛋白质的流变学和黏合特性[5]。Téllez-Luis等[6]得出TGase可以提高低盐重组鲢鱼制品的质构特性和功能特性。陈海华等[7]证实TGase可以提高竹荚鱼糜的凝胶强度、持水性及白度等特性,严菁[8]研究了TGase对鳙鱼糜凝胶特性的影响并优化其作用条件。周爱梅等[9]研究了TGase对鳙鱼糜凝胶的凝胶强度、持水性和微观结构的影响,但关于TGase对鳙鱼糜热诱导凝胶形成过程中的蛋白质的交联、胶凝温度(gelation temperature,Tgel)以及胶凝活化能(activation energy,Ea)的影响还未见报道。本实验以鳙鱼糜为对象,采用动态流变仪、物性分析仪、SDS-PAGE以及蛋白质溶解性分析等方法,研究TGase热诱导鳙鱼糜凝胶形成过程中蛋白质的交联程度、胶凝温度和胶凝活化能,揭示TGase对鳙鱼糜热诱导胶凝特性的影响,为开发高品质鱼糜制品提供一定的参考。
1 材料与方法
1.1 材料与试剂
鲜活鳙鱼(Aristichthys nobilis)购于华中农业大学菜市场,每尾体质量为1500g左右。
转谷氨酰胺酶(酶活力100U/g) 江苏泰兴一鸣精细化工有限公司;PVDC塑料肠衣 武汉飘飘食品集团有限公司;Fermentas蛋白标样 武汉谷歌生物科技有限公司;样品缓冲液 武汉谷歌生物科技有限公司。
1.2 仪器与设备
TA-XTPlus物性分析仪 英国Stable Micro System公司;AR-2000ex动态流变仪 英国TA公司;电泳仪 北京市六一仪器厂;Gel doc XR+Universal hood Ⅱ凝胶成像仪 美国Bio-Rad公司。
1.3 方法
1.3.1 鱼糜凝胶的制备
新鲜鳙鱼去头、骨、内脏后采肉,用5倍质量的自来水漂洗2次,再用5倍0.5% NaCl溶液漂洗1次(室温为25℃左右,漂洗过程中是用一部分冰代替同等质量的水),每次漂洗10min,称取6份质量为100g的漂洗鱼糜(鱼糜水分含量(83±0.5)%),加入10g冰水斩拌2min,加2.5g NaCl和TGase(添加量分别为0、9.36、18.72、28.08、37.44、46.80U/100g鱼糜)斩拌2min(保证漂洗和斩拌过程温度在0~10℃之间),灌入直径为20mm的肠衣,两段式加热冷却后于4℃放置过夜。
1.3.2 鱼糜动态流变学的测定
取一定量的鱼糜置于载物台与圆形平板(直径为4cm)之间,去除过量的样品,用液体石蜡封住样品以免水分蒸发,载物台与平板间距为1000μm。采用0.1Hz的振动频率,剪切力为10Pa,从20℃加热到90℃,升温速率为1℃/min[10],鱼糜水分含量为(83±0.5)%,加酶量为0、9.36、18.72、28.08、37.44、46.80U/100g鱼糜。
根据高分子物理学的观点,Tgel可定义为聚合物在温度扫描过程中储能模量G′发生显著变化时所对应的温度[11]。在40~70℃的范围内,G′和温度之间可以用式(1)进行表述。对式(1)进行一阶求导,可以得到G′最小值时对应的温度,即当dG′/dT=0时对应的温度为Tgel[11]。

鱼糜凝胶形成过程中的能垒可以用胶凝活化能Ea来表示,参考Yoon等[11]的方法,按照式(2)计算。
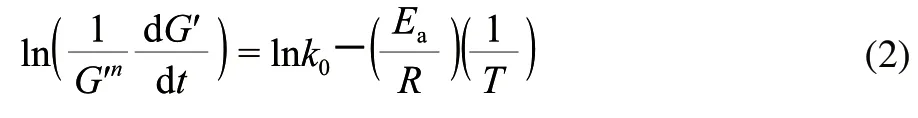
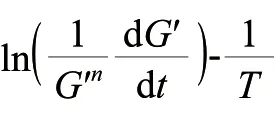
1.3.3 鱼糜凝胶强度的测定
在室温条件下将样品切成20mm的小段,用TA-XTPlus物性分析仪进行凝胶强度的测试。采用P/0.25S球型探头穿刺样品,参数设置为:一次压缩模式、压缩距离15mm、测前速率1mm/s、测中速率1mm/s、测后速率10mm/s。每个样品做6个平行,取平均值。穿刺曲线上的第1个峰即为破断强度。凝胶强度为破断强度与凹陷深度的乘积[8]。日本陆上冷冻鱼糜质量标准中AA级的凝胶强度为4400g·mm,A级的凝胶强度为3500g·mm[8]。
1.3.4 鱼糜凝胶持水性能的测定
将样品切成厚3mm的圆片(Φ=20mm)并称质量m1,用滤纸包裹,然后用硬度计加压3kg并保持1min,去掉滤纸,再将样品称质量m2[12],按照式(3)计算失水率。
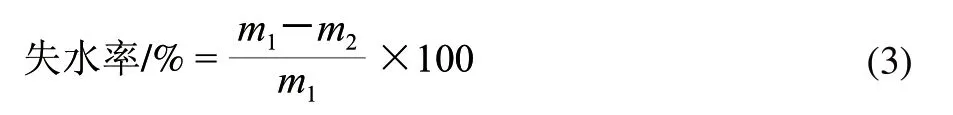
1.3.5 鱼糜凝胶溶解度的测定
称取1g鱼糜样品溶解于20mL 20mmol/L Tris-HCl(含1g/100mL SDS、8mmol/L尿素和体积分数2% β-巯基乙醇,pH8.0)缓冲液,均质,混合液于100℃加热2min后,于室温搅拌4h,10000×g离心30min。取上清液10mL,添加50g/100mL冷的三氯乙酸(TCA)至终含量为10%,混合液于4℃放置18h,10000×g离心3min,沉淀物用10g/100mL TCA冲洗并溶解于0.5mol/L NaOH中。蛋白质含量用Lowry法[13]测定。溶解度表示为样品在溶剂中测得的蛋白质总量占总蛋白(凝胶直接溶解于0.5mol/L NaOH)含量的百分比[14]。
1.3.6 SDS-PAGE电流
肉糜样品的处理参考Benjakul等[15]的方法。取3g肉糜加入5g/100mL SDS后采用高速分散均质机均质,再于85℃的水浴中保温1h溶解样品中的蛋白质,随后在8000r/min离心20min取上清液,并用Lowry法[13]测定上清液中蛋白质的含量,调节其质量浓度为0.5~2mg/mL。取稀释后蛋白样品0.5mL,加入0.1mL的样品缓冲液,沸水煮10min,冷却后取10μL上样于5%的浓缩胶上,在7.5%分离胶上进行电泳分离,以考马斯亮蓝G250染色1h,用醋酸、乙醇体积比1:1进行脱色[16]。用凝胶成像仪照相,采用Image Lab分析MHC条带强度的变化。
1.4 数据处理
采用Excel、SAS8.0分析数据,采用Duncan新复极差多重比较对数据进行显著性分析,显著水平为P<0.05。
2 结果与分析
2.1 TGase对鳙鱼糜热胶凝过程中动态流变性能的影响
2.1.1 TGase对鳙鱼糜热胶凝过程中储能模量的影响
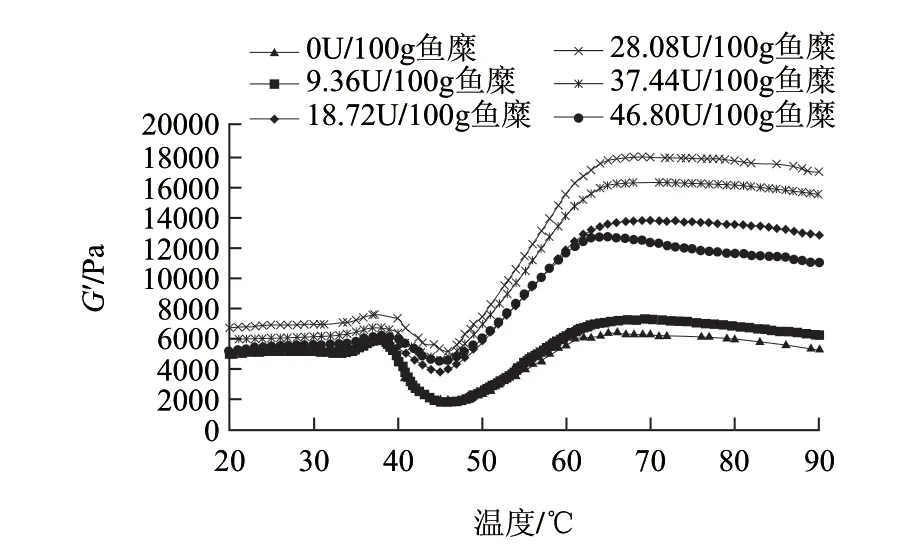
图 1 不同TGase添加量对鳙鱼糜G′的影响Fig.1 Changes in G' of surimi from bighead carp at various TGase concentrations
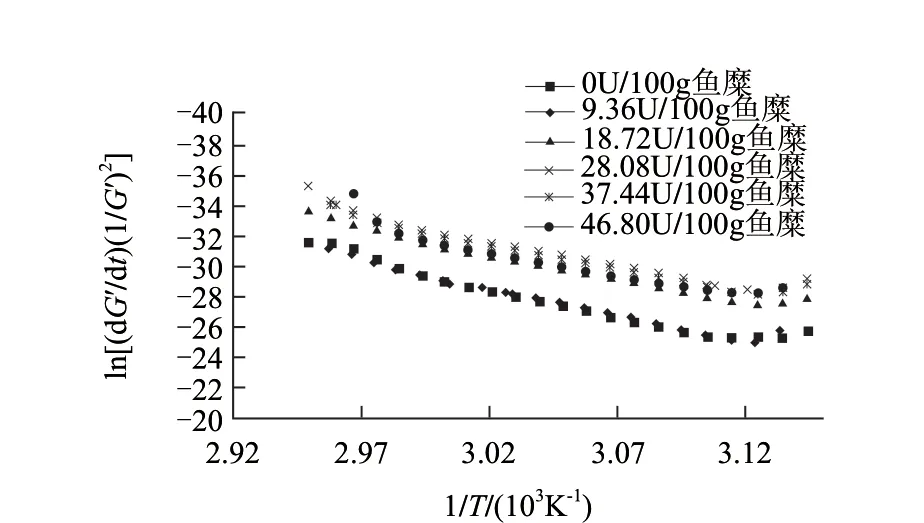
图 2 不同TGase添加量的鳙鱼糜G′随温度变化的阿伦尼乌斯曲线(n=2)Fig.2 Arrhenius plots for the changes in G' of bighead surimi at various TGase concentrations (n=2)
储能模量G′反映黏弹性物质的类固体特性即弹性[17]。由图1、2可知,鳙鱼糜凝胶形成过程大致可分为3个阶段:在20~38℃范围,TGase的添加使G′有小幅度增加,不同TGase添加量的鳙鱼糜在37℃附近均出现1个小峰,G′随着加酶量的增加而增大,但是当TGase添加量超过28.08U/100g鱼糜时,G′下降。在20~38℃范围,肌球蛋白的轻链发生解离,在TGase作用下蛋白质之间发生交联,使体系的G′增加[18]。在39~47℃范围,随着温度的升高鳙鱼糜的G′迅速下降,其原因可能是温度升高破坏了以氢键为主的低温凝胶化网络结构[19],也有可能是鱼糜中内源性蛋白酶水解肌球蛋白,导致凝胶结构的破坏[19]。当酶添加量超过9.36U/100g鱼糜时,其G′的下降程度明显减弱。在48~90℃范围,随着温度升高G′大幅度增加;随着TGase用量增加,鳙鱼糜的G′显著增加,在TGase添加量为28.08U/100g鱼糜时,G′达到最大,继续增加酶量,G′则会明显下降,但都高于未添加TGase的鳙鱼糜组,其原因是鱼糜中蛋白质除了以二硫键和疏水相互作用等形成稳定的网络结构[18]外,TGase催化MHC形成ε-(γ-谷氨酰)赖氨酸键在鱼糜凝胶网络形成过程中起主导作用,从而促使了更加稳定的网络结构的形成,但过量的TGase则不利于谷氨酸与赖氨酸的共价交联。在TGase添加量为28.08U/100g鱼糜时,鳙鱼糜的G′达到最大为17860Pa,较对照组的G′提高了2.5倍。
2.1.2 TGase对鳙鱼糜热胶凝温度的影响
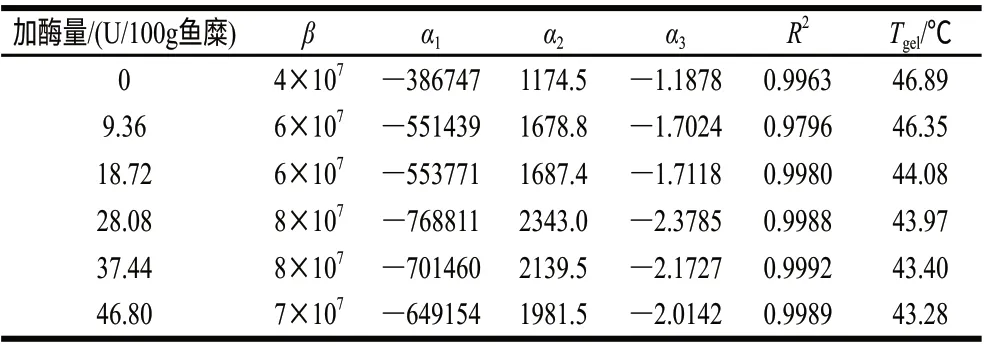
表 1 不同TGase添加量的鳙鱼糜G′随温度变化的拟合曲线方程的系数Table 1 Coefficients of polynominal equation of bighead surimi at various TGase concentrations
在温度扫描过程中,采用式(1)对G′(40~70℃)进行拟合。由表1可知,鳙鱼糜的Tgel为46.89℃,当TGase的添加量为9.36U/100g鱼糜时,Tgel为46.35℃,下降不明显。在添加量为18.72U/100g鱼糜时,鳙鱼糜的Tgel为44.08℃,较未添加TGase的鳙鱼糜降低了2.81℃。当继续增加酶量到46.80U/100g鱼糜时,鳙鱼糜的Tgel继续下降但幅度不明显,Tgel都在43℃以上。总体来说,在鳙鱼糜中添加TGase可以降低鱼糜的Tgel。在蛇鲻鱼糜中,也发现添加TGase可使其胶凝温度降低[20]。
在40~70℃的温度范围内,鱼糜的凝胶过程按二级反应进行拟合,不同酶添加量的胶凝活化能如表2所示,拟合R2都在0.90以上,说明拟合效果较好。TGase的添加使得鱼糜Tgel降低的同时Ea也下降。这可能是由于TGase交联作用使得蛋白质分子间的接触概率增大,更容易产生分子链间的交联,鱼糜蛋白质形成凝胶所需要克服的能垒变小,更容易形成凝胶[21]。
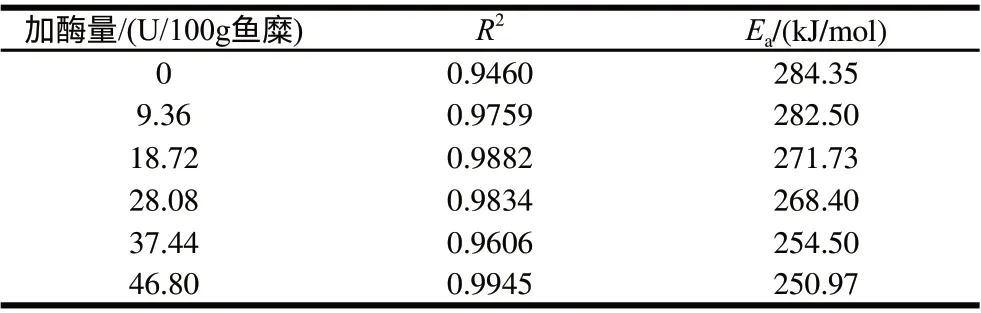
表 2 不同TGase添加量的鳙鱼糜凝胶形成过程中的动力学参数 Table 2 Kinetic gelation parameters of surimi from bighead carp at various TGase concentrations
2.2 TGase添加量对鳙鱼糜凝胶强度的影响
表 3 TGase添加量对鳙鱼糜凝胶强度的影响(±s,n=6)Table 3 Effect of TGase concentration on the gel strength of surimi gels from bighead carp (±s,n=6)
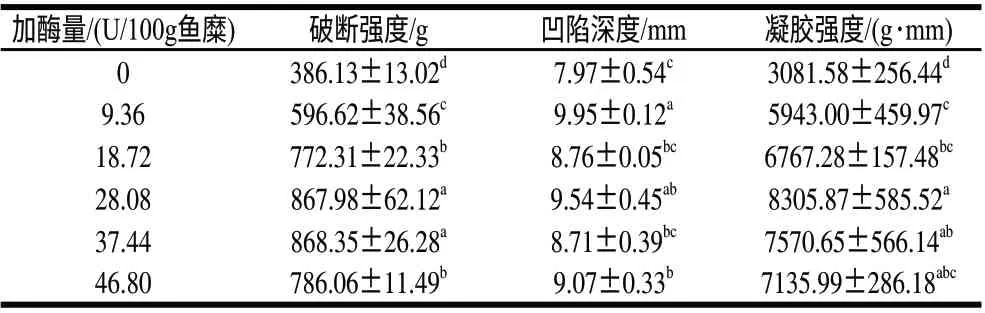
表 3 TGase添加量对鳙鱼糜凝胶强度的影响(±s,n=6)Table 3 Effect of TGase concentration on the gel strength of surimi gels from bighead carp (±s,n=6)
注:不同小写字母表示差异显著(P <0.05)。
加酶量/(U/100g鱼糜)破断强度/g凹陷深度/mm凝胶强度/(g·mm)0 386.13±13.02d7.97±0.54c3081.58±256.44d 9.36596.62±38.56c9.95±0.12a5943.00±459.97c 18.72772.31±22.33b8.76±0.05bc6767.28±157.48bc 28.08867.98±62.12a9.54±0.45ab8305.87±585.52a 37.44868.35±26.28a8.71±0.39bc7570.65±566.14ab 46.80786.06±11.49b9.07±0.33b7135.99±286.18abc
由表3可知,添加TGase可以显著提高鳙鱼糜的破断强度、凹陷深度和凝胶强度(P<0.05)。当TGase的添加量小于28.08U/100g鱼糜时,鳙鱼糜的破断强度和凝胶强度随着TGase添加量的增加而增大。这是因为随着加酶量的增加,鳙鱼糜的Tgel降低、胶凝能垒减小,ε-(γ-谷氨酰)赖氨酸键形成得更多;但当TGase超过28.08U/100g鱼糜时,鳙鱼糜凝胶强度反而会下降,因为过度的交联作用使得鳙鱼糜凝胶弹性降低而变得硬而脆,这和严菁等[22]的研究结果一致。但加酶后的鱼糜凝胶强度整体较未添加TGase的鱼糜的凝胶性能要好。在加酶量为28.08U/100g鱼糜时,鳙鱼糜凝胶强度达到最大,较未加酶的提高了约2.7倍。在红杉鱼糜(golden threadfi n-bream)和鳕鱼糜(pollack surimi)中也发现了这一现象[23]。
2.3 TGase添加量对鳙鱼糜凝胶持水性的影响

图 3 TGase添加量对鳙鱼糜凝胶失水率的影响Fig.3 Effect of TGase concentration on the expressible moisture of surimi gels from bighead carp
持水性用于表征蛋白质结合水的能力,对于鱼糜凝胶制品的加工特性、产量及成本起着重要的作用。凝胶失水率与持水性成负相关,失水率越小,凝胶持水性能越好。同时还与凝胶的结构有关,形成的凝胶越致密、均匀则其失水率越低[24]。由图3可知,TGase的添加使得鱼糜凝胶压出的水分明显减少,这表明TGase的加入提高了鱼糜凝胶的持水性。当TGase添加量为28.08U/100g鱼糜时,持水性达到最大,失水率较未添加TGase减少了46%。这可能是由于随着TGase添加量继续增加,TGase引起蛋白质分子聚集,从而使鱼糜凝胶持水性下降[25]。
2.4 TGase添加量对鳙鱼糜凝胶溶解度及SDS-PAGE图谱的影响
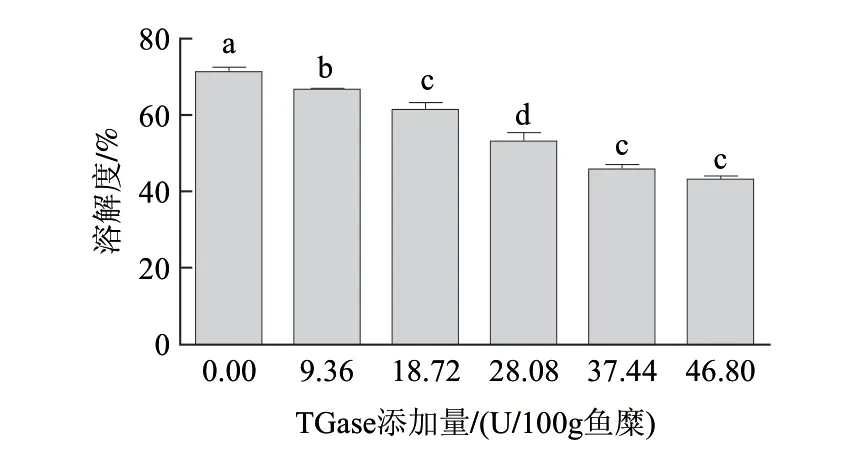
图 4 TGase添加量对鳙鱼糜凝胶溶解度的影响Fig.4 Effect of TGase concentration on the solubility of surimi gels from bighead carp
β-巯基乙醇、尿素及SDS可除去除ε-(γ-谷氨酰)赖氨酸键以外的其他化学键。因此鱼糜凝胶溶解度与鱼糜网络中生成的ε-(γ-谷氨酰)赖氨酸键呈反比。由图4可知,鱼糜凝胶的溶解度随着TGase添加量的增加而下降,这说明TGase催化形成了更多的ε-(γ-谷氨酰)赖氨酸键,这和前面动态流变得出的结论一致。加酶量为46.80U/100g鱼糜时,溶解度下降约25%。但是过多的ε-(γ-谷氨酰)赖氨酸键会导致鱼糜变得硬又脆,从而使鱼糜的凝胶强度反而下降(表3)。加酶量对SDS-PAGE图及肌球蛋白重链的条带百分比的影响分别如图5、6所示。添加TGase较未添加酶的鱼糜凝胶的MHC的条带强度显著降低。由图6可知,MHC条带的百分比随着加酶量的增加而降低,当加酶量为28.08U/100g鱼糜时,MHC条带的百分比为9.3%,继续增加酶量,其MHC条带的百分比略微有些下降而后上升,但与加酶量为28.08U/100g鱼糜时比较,MHC条带百分比几乎趋于不变。MHC条带强度减弱是因为TGase使MHC之间通过ε-(γ-谷氨酰)-赖氨酸键发生共价交联而形成了分子质量更大的肽链,不易被β-巯基乙醇等离解[23]。在整个过程中肌动蛋白的条带没有改变,说明肌动蛋白没有参与TGase催化的交联作用。在TGase诱导牛肉蛋白形成凝胶的过程中,Dondero等[4]也发现了肌动蛋白没有参与TGase催化牛肉蛋白的交联作用这一现象。
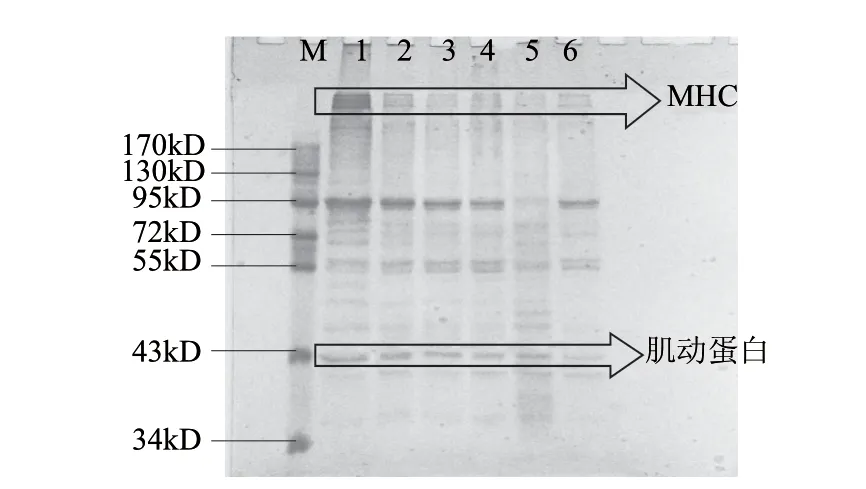
图 5 TGase处理的鳙鱼糜凝胶SDS-PAGE图谱Fig.5 SDS-PAGE pattern of surimi gels from bighead carp subjected to TGase treatment

图 6 TGase处理的鳙鱼糜凝胶的MHC强度变化Fig.6 Changes in MHC intensity of surimi gels from bighead carp subjected to TGase treatment
3 结 论
鳙鱼糜在热诱导凝胶形成过程中,其Tgel和Ea随着TGase添加量的增加而降低,而溶解度和MHC条带百分比随着TGase添加量的增加先降低后趋于稳定。说明添加TGase可降低鱼糜胶凝所需的能垒、使MHC之间更易形成ε-(γ-谷氨酰)赖氨酸共价键。而鳙鱼糜凝胶的破断强度、凝胶强度、持水性G′随着酶量的增加呈现先上升后下降的趋势,当TGase添加量为28.08U/100g鱼糜时,其凝胶强度最高、失水率最小。与对照组相比,添加28.08U/100g鱼糜 TGase的鳙鱼糜凝胶强度提高2.7倍、失水率减少46%、G′提高2.5倍。当TGase添加量超过28.08U/100g鱼糜,鳙鱼糜凝胶的G′、破断强度、凝胶强度和持水性下降。因此适当添加TGase可降低鳙鱼糜胶凝所需的Ea和Tgel,明显提高鳙鱼糜的凝胶强度和持水性。
[1] 戈贤平, 缪凌鸿. 我国大宗淡水鱼产业发展现状与体系研究进展[J]. 中国渔业质量与标准, 2011, 1(3): 22-31.
[2] 周爱梅, 龚杰, 邢彩云, 等. 罗非鱼与鳙鱼鱼糜蛋白在冻藏中的生化及凝胶特性变化[J]. 华南农业大学学报, 2005, 26(3): 103-107.
[3] 吴汉明, 王海洪, 韩素珍, 等. 几种淡水鱼糜特性的研究[J]. 食品科学, 1999, 20(9): 15-19.
[4] DONDERO M, FIGUEROA V, MORALES X, et al. Transglutaminase effects on gelation capacity of thermally induced beef protein gels[J]. Food Chemistry, 2006, 99(3): 546-554.
[5] 林丽军, 孙健, 徐幸莲, 等. 磷酸盐和转谷氨酰胺酶对鸡肉肠出品率和硬度的影响[J]. 食品科学, 2006, 27(5): 49-52.
[6] TÉLLEZ-LUIS S J, URESTI R M, RAMÍREZ J A, et al. Low-salt restructured fi sh products using microbial transglutaminase as binding agent[J]. Journal of the Science of Food and Agriculture, 2002, 82(9): 953-959.
[7] 陈海华, 薛长湖. 谷氨酰胺转氨酶对竹荚鱼鱼糜蛋白凝胶特性的影响[J]. 食品科学, 2010, 31(9): 35-40.
[8] 严菁. 转谷氨酰胺酶对淡水鱼糜凝胶特性的影响[D]. 武汉: 华中农业大学, 2003.
[9] 周爱梅, 黄文华, 刘欣, 等. 转谷氨酰胺酶对鳙鱼鱼糜凝胶特性的影响[J]. 食品发酵与工业, 2003, 29(8): 27-31.
[10] DING Yuqin, LIU Ru, RONG Jianhua, et al. Rheological behavior of heat-induced actomyosin gels from yellowcheek carp and grass carp[J]. European Food Research and Technology, 2012, 235: 245-251.
[11] YOON W B, GUNASEKARAN S, PARK J W. Characterization of thermorheological behaviour of alaska pollock and pacific whiting surimi[J]. Journal of Food Science, 2004, 69(7): E338-E343.
[12] TAMMATINNA A, BENJAKUL S, VISESSANGUAN W, et al. Gelling properties of white shrimp (Penaeus vannamei) meat as influenced by setting condition and microbial transglutaminase[J]. LWT-Food Science and Technology, 2007, 40(9): 1489-1497.
[13] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193: 265-275.
[14] 刘海梅. 大豆分离蛋白对微生物转谷氨胺酶诱导鲢鱼糜凝胶形成的影响[J]. 食品科学, 2009, 30(5): 76-78.
[15] BENJAKUL S, VISESSANGUAN W, PECHARAT S. Suwari gel properties as affected by transglutaminase activor and inhibitors[J]. Food Chemistry, 2004, 85(1): 91-99.
[16] AHHMED A M, KURODA R, KAWAHARA S, et al. Dependence of microbial transglutaminase on meat type in myofi brillar proteins crosslinking[J]. Food Chemistry, 2009, 112(2): 354-361.
[17] 栗瑞娟, 熊善柏, 赵思明, 等. 面团组成对鱼面面团及面片流变学特性的影响[J]. 食品科学, 2008, 29(9): 83-86.
[18] BENJAKUL S, VISESSANGUAN W, ISHIZAKI S, et al. Differences in gelation characteristics of natural actomyosin from two species of bigeye snapper, Priacanthus tayenus and Priacanthus macracanthus[J]. Journal of Food Science, 2001, 66(9): 1311-1318.
[19] LIU R, ZHAO S M, XIONG S B, et al. Studies on fi sh and pork paste gelation by dynamic rheology and circular dichroism[J]. Journal of Food Science, 2007, 72(7): E399- E403.
[20] YONGSAWATDIGUL J, PIYADHAMMAVIBOON P. Effect of microbial transglutaminase on autolysis and gelation of lizardfi sh surimi[J]. Journal of the Science of Food and Agriculture, 2005, 85(9): 1453-1460.
[21] 曹燕, 程裕东. 鲢、狭鳕鱼糜微波加热凝胶形成的动力学分析[J]. 水产学报, 2005, 29(4): 547-551.
[22] 严菁, 熊善柏, 李清亮. 转谷氨酰胺酶对淡水鱼糜制品凝胶强度的影响[J]. 食品科学, 2002, 23(8): 59-62.
[23] JIANG S T, HSIEH J F, HO M L, et al. Microbial transglutaminase affects gel properties of golden threadfi n-bream and pollack surimi[J]. Journal of Food Science, 2000, 65(4): 694-699.
[24] SALVADOR P, TOLDRÀ M, SAGUER E, et al. Microstructurefunction relationships of heat-induced gels of porcine hemoglobin[J]. Food Hydrocolloids, 2009, 23(7): 1654-1659.
[25] BENJAKUL S, PHATCHARAT S, TAMMATINNA A, et al. Improvement of gelling properties of lizardfish mince as influenced by microbial transglutaminase and fi sh freshness[J]. Journal of Food Science, 2008, 73(Suppl 6): 239-246.
