响应面法优化里氏木霉产木聚糖酶发酵培养基
2013-08-07李小娟赵儒铭龚大春
黄 瑞,张 超,李小娟,田 辉,赵儒铭,龚大春
( 三峡大学新能源研究院生物质能研究所,湖北宜昌443002)
现代化工业的快速发展使得能源短缺问题日益严重,寻找新的能源已是当务之急。植物纤维是地球上取之不尽的生物能源,可将其转化为乙醇,作为工业生产直接用能,可产生巨大的经济效益,并可减少环境污染,促进自然界碳素循环。据报道,木聚糖酶在与其他酶的协同作用下可将植物纤维降解为戊糖和己糖,以戊糖和己糖为发酵底物,通过微生物作用可生产乙醇[1]。广义的木聚糖酶是指能够降解半纤维素木聚糖的一组酶的总称,降解时起主要作用的是内切β-1,4-木聚糖酶和β-木糖苷酶[2-3],完全降解还需α-L-呋喃型阿拉伯糖苷酶、乙酰木聚糖酯酶、酚酸酯酶等的参与[4]。木聚糖酶作为酶制剂行业中的一个重要产品,被广泛应用于食品、造纸、饮料、纺织业及废物处理[5]。已发现的木聚糖酶种类繁多而且广泛存在于海洋及陆地,但因为获得难易程度及纯度的原因,当前商用木聚糖酶仍主要依靠微生物发酵获得[6]。因此,开展对木聚糖酶发酵工艺的研究,进行里氏木霉产木聚糖酶的培养基成分及中试放大研究,可以为木聚糖酶的生产研究提供重要的理论依据,为清洁能源的开发提供有力保障。响应面分析法包括了实验设计,建立模型,分析模型合理性和寻求最优解等众多实验和统计技术,采用该法可以建立连续变量曲面模型,以最经济的方式对所选的实验参数进行全面研究,对影响生物过程的因子水平及其交互作用进行优化与评价[7-12]。以往关于里氏木霉产木聚糖酶的研究方法比较单一,主要为单因素法和正交法。如毛连山等[13]用单因素法确定了里氏木霉产木聚糖酶的培养基成分,并确定了最佳碳氮比7.2;魏瑛等[14]利用正交法确定了最佳培养基组成为牛肉膏、蛋白胨、玉米芯、葡萄糖,其比例为1∶0.50∶3∶0.43。而单因素法和正交法均存在局限性,单因素法无法得知因素间的交互影响,正交法只能得到最佳因素水平的组合。因此,本实验运用Design-Expert7.0 软件中的Plackett-Burman 设计法、Behnken-Box 设计法以及最陡爬坡路径法对里氏木霉产木聚糖酶的培养基成分进行优化,并利用minitab16 进行统计学分析,为其中试放大提供理论依据。
1 材料与方法
1.1 材料与仪器
里氏木霉(Trichoderma reesei) 艾伦麦克德尔米德研究所提供;木聚糖 北京拜尔迪生物技术有限公司;其他试剂 国产分析纯。
BPC-250F 型恒温培养箱 上海一恒科技有限公司;UV-1100 型紫外分光光度计 上海美谱达仪器有限公司;XFLS-50MA 型灭菌锅 浙江新丰医疗器械有限公司;SW-CT-1D 型净化工作台 苏州净化设备有限公司;AR2140 型分析天平 梅特勒-托利多仪器(上海)有限公司;ZHWY-1102 型恒温培养震荡器 上海智城分析仪器制造有限公司。
1.2 培养基的配制
1.2.1 斜面培养基PDA 培养基。
1.2.2 种子培养基 木糖20g/L、玉米浆17g/L、(NH4)2SO45g/L、KH2PO42g/L、MgSO4·7H2O 0.6g/L、无水CaCl20.4g/L。
1.2.3 基础发酵培养基 乳糖30g/L、玉米浆17g/L、(NH4)2SO45g/L、KH2PO42g/L、MgSO4·7H2O 0.6g/L、无水CaCl20.4g/L、吐温-80 2mL/L。
1.3 实验方法
1.3.1 种子液制备 取28℃下培养成熟的斜面试管一支,用无菌生理盐水冲洗,适当稀释,配制成108cfu/mL 的孢子悬浮液,以10%的接种量接入装有100mL 种子液的250mL 锥形瓶中,28℃、200r/min 下培养48h。
1.3.2 摇瓶培养条件 基础发酵培养基250mL 摇瓶装液量50mL,以10%的接种量接种,28℃、200r/min下培养72h。
1.3.3 酶活的测定 采用紫外分光光度法:a.实验组,向50℃中预热3min 的底物(质量浓度为10mg/mL的木聚糖溶液2mL)加入2mL 经适当稀释的酶液,50℃保温15min 后加入5mL DNS 溶液,电磁震荡3~5s,以终止反应。沸水浴加热10min,用自来水冷却至室温,用蒸馏水定容至25mL,电磁震荡3~5s,在540nm 处测定吸光度值AE;b.对照组,向保温3min 的底物中加入已灭活的酶液2mL,50℃保温15min 后加入5mL DNS 溶液。沸水浴加热10min,用自来水冷却至室温,用蒸馏水定容至25mL,电磁震荡3~5s,在540nm 处测定吸光度值AB。酶活定义:在50℃,pH5.5 的条件下,每分钟从10mg/mL 的木聚糖溶液中降解释放1μmol 还原糖所需要的酶量为一个酶活力单位U。
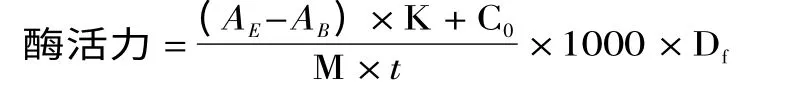
式中:K-标准曲线的斜率;C0-标准曲线的截距;M-木糖的摩尔质量,M(C5H10O5)=150.2g/mol;t-酶解反应时间,min;1000 - 转化因子,1mmol =1000μmol;Df-酶液稀释倍数。
1.4 实验设计
1.4.1 Plackett-Burman 设计法筛选影响酶活的显著性影响因素PB 法是一种近饱和的2 水平实验设计方法。它基于非完全平衡块原理,能用最少实验次数估计出因素的主效应,以从众多的考察因素中快速有效地筛选出最为重要的几个因素供进一步研究[15]。根据单因素实验结果,选用N =7 的Plackett-Burman 设计表对培养基的7 个组分的重要性进行研究,以3 组零点值估计误差。PB 设计表见表1。
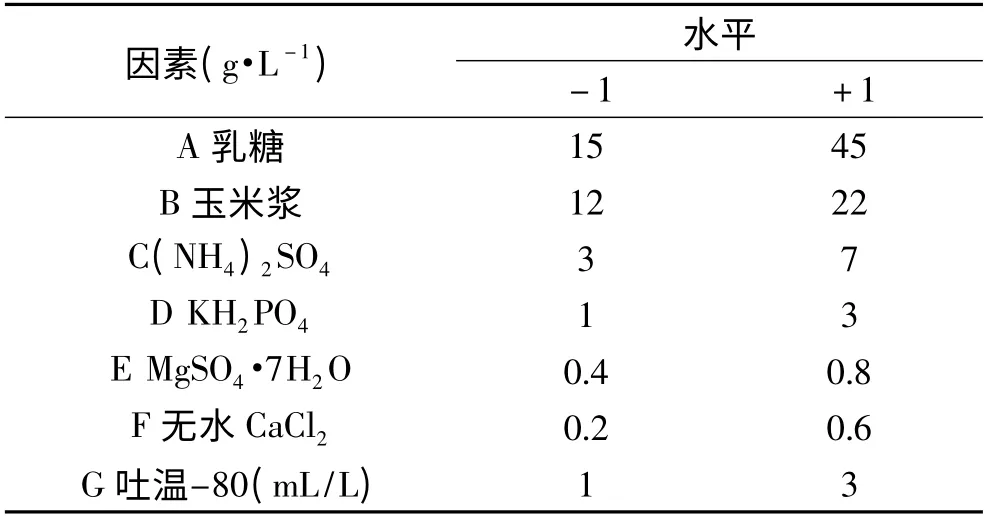
表1 Plackett-Burman 设计各因素与水平Table 1 Factors and levels of Plackett-Burman design
1.4.2 最陡爬坡实验 响应面只有在临近最佳值时才能建立有效的响应面方程。最陡爬坡法以实验值变化的梯度方向为爬坡方向,根据各因素效应值的大小确定变化步长,能快速、经济地逼近最佳值区域[16]。根据实验1.4.1 的结果,做最陡爬坡实验。
1.4.3 Box-Behnken 设计 以爬坡设计得出的实验结果为依据进行Box-Behnken 设计,因素与水平见表2,用软件Design expert 7.0 对实验进行回归分析,利用软件minitab16 进行误差分析并求得最优值,得出响应面分析结果,进而确定最佳培养条件,最后依据回归方程绘制响应面立体分析图。
1.4.4 验证实验 用所得到的最佳培养条件进行5次平行实验,取平均值,以验证模型是否可靠,进而得出最终优化结果。
2 结果与讨论
2.1 Plackett-Burman 实验设计结果分析
Plackett-Burman 实验结果见表3,回归分析结果见表4。
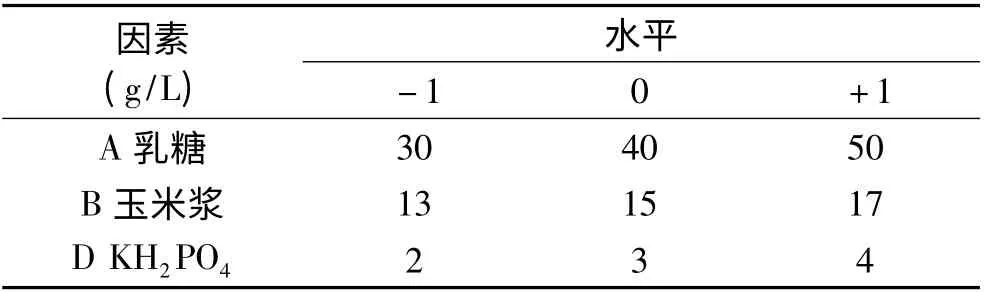
表2 Box-Behnken 设计各因素与水平Table 2 Factors and levels of Box-Behnken design
该模型R2=0.9137,说明91.37%的数据可用此模型解释。模型p 值(prob >F)=0.0079 <0.05,表明此模型显著,可在0.05 水平上拟合数据。失拟项p值(prob >F)=0.1008 >0.1,表明失拟项不显著,模型没有产生失拟现象。由各因素的p 值可看出,对产酶影响最显著的3 个因素依次为:A >B >D,即乳糖>玉米浆>KH2PO4。后续实验将对这3 个因素作进一步研究。

表3 Plackett-Burman 设计及结果Table 3 Design and result of Plackett-Burman
2.2 最陡爬坡实验
根据表4 中A、B、D 3 个因素估计系数的正负效应,依次增大或减小,乳糖和KH2PO4是正效应,应依次增大;玉米浆是负效应,应依次减小;其他非显著性因素根据表4 中的估计系数的正负取PB 设计中的最大值或最小值,(NH4)2SO43g/L,MgSO4·7H2O 0.8g/L,无水CaCl20.6g/L,吐温-80 1mL/L。爬坡实验结果见表5。
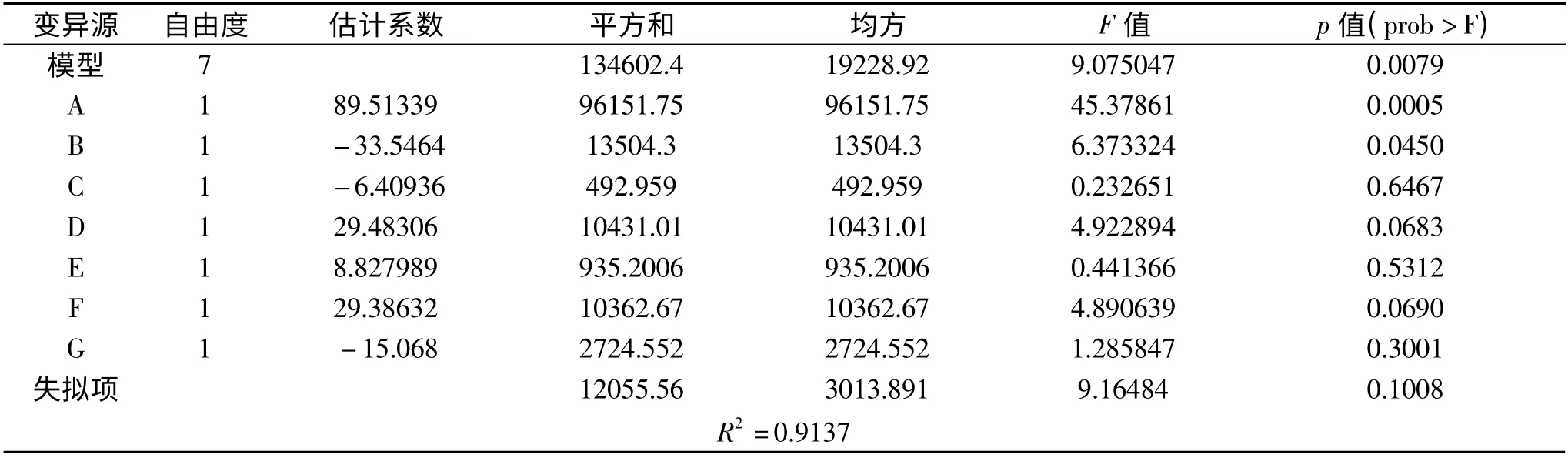
表4 Plackett-Burman 设计回归分析Table 4 Regression analysis of Plackett-Burman design
表5 最陡爬坡实验结果Table 5 Result of steepest ascent experiment
结果表明,随着乳糖和KH2PO4浓度逐渐增大,玉米浆浓度逐渐减小,酶活呈现先增大后减小的变化。当乳糖为40g/L,玉米浆为15g/L,KH2PO4为3g/L 时,酶活达到最大。因此以实验号2 各因素水平为中心值设计后续响应面实验。
2.3 Box-Behnken 设计结果与分析
Box-Behnken 设计及结果分析见表6、表7。

表6 Box-Behnken 设计及结果Table 6 Design and result of Box-Behnken
表7 Box-Behnken 设计回归分析Table 7 Regression analysis of Box-Behnken design
该二次模型多元相关性系数R2=0.9458,表明仅有5.42%的变异不能由此模型解释;模型p 值(prob>F)= 0.0111 表明模型是显著的,失拟项p 值为0.0706 表明失拟项不显著,模型没有失拟现象。A(乳糖),B(玉米浆)对酶活的影响显著,D(KH2PO4)次之;AB 的交互影响显著,AD,BD 的交互影响不显著;A2,B2,D2对酶活的影响均显著。残差概率分布图(图1)中的点在同一直线上,残差与拟合值图(图2)中的点分布无规律,认可误差服从正态。
图1 残差概率分布图Fig.1 Residual probability distribution
图2 残差与拟合值图Fig.2 Residuals and fitted values
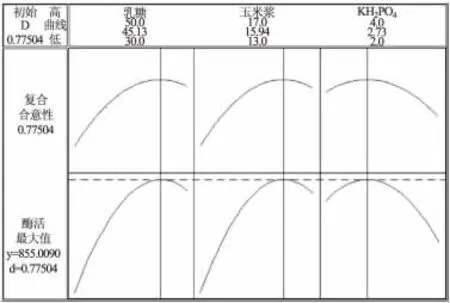
图3 minitab16 优化器优化结果Fig.3 Optimization results of minitab16 optimizer
通过二次模型回归系数的计算,得到如下方程以表征3 个因素对木聚糖酶活力的影响:

式中,R 代表木聚糖酶的酶活力(U/mL),A、B、D 分别代表乳糖、玉米浆和KH2PO4的实际质量浓度值。利用minitab16 中的响应优化器解得最优值点为A =45.13,B =15.94,D =2.73,即质量浓度分别为乳糖45.13g/L,玉米浆15.94g/L,KH2PO42.73g/L,预测最大酶活855.01U/mL(图3)。根据上述拟合回归方程作响应面分析图,图4 中当固定KH2PO42.73g/L时,乳糖从30g/L 增大至50g/L,玉米浆从13g/L 增大至17g/L 的过程中,木聚糖酶酶活力均呈现先增大后减小的趋势,曲面的顶点即为酶活最大值点,其对应的乳糖浓度为45.13g/L,玉米浆浓度为15.94g/L。同理,图5 和图6 中的曲面分别反映了乳糖和KH2PO4、玉米浆和KH2PO4的交互作用。
2.4 验证实验
用上述步骤得出的最佳培养基配方:乳糖45.13g/L,玉米浆15.94g/L,(NH4)2SO43g/L,KH2PO42.73g/L,MgSO4·7H2O 0.8g/L,无水CaCl20.6g/L,吐温-80 1mL/L,做5 组平行实验,结果如表8 所示:

表8 验证实验Table 8 Verification experiment
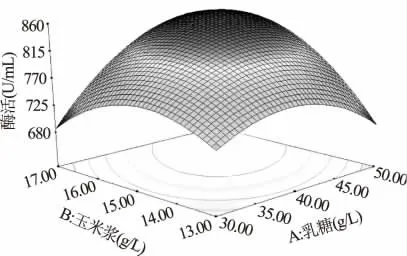
图4 乳糖和玉米浆的交互作用对木聚糖酶酶活影响的响应面图(KH2PO4 2.73g/L)Fig.4 Response surface for interaction effects of lactose and corn syrup on xylanase activity(KH2PO4 2.73g/L)

图5 乳糖和KH2PO4 的交互作用对木聚糖酶酶活影响的响应面图(玉米浆15.94g/L)Fig.5 Response surface for interaction effects of lactose and KH2PO4 on xylanase activity(corn syrup 15.94g/L)
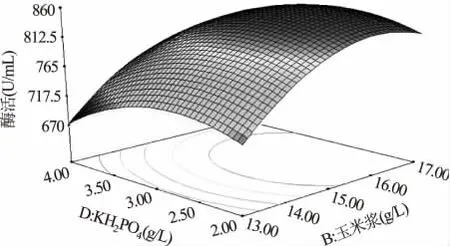
图6 玉米浆和KH2PO4 的交互作用对木聚糖酶酶活影响的响应面图(乳糖45.13g/L)Fig.6 Response surface for interaction effects of corn syrup and KH2PO4 on xylanase activity(lactose 45.13g/L)
实验值(847.112 ±5.359)U/mL 与预测值接近,表明模型具有良好的拟合性。
3 结论
本研究通过Plackett-Burman 设计,快速有效地从7 个影响产木聚糖酶的因素中筛选出3 个显著性影响因素:乳糖、玉米浆和KH2PO4,然后利用最陡爬坡法逼近最大响应值区域并用Box-Behnken 设计得出最佳培养基浓度组合:乳糖45.13g/L,玉米浆15.94g/L,(NH4)2SO43g/L,KH2PO42.73g/L,MgSO4·7H2O 0.8g/L,无水CaCl20.6g/L,吐温-80 1mL/L。在最佳培养基组合下,木聚糖酶实际酶活力达到847.112U/mL,与理论最大酶活力855.01U/mL 接近,说明运用响应面法优化里氏木霉产木聚糖酶是合理可靠的。经优化,酶活力比优化前提高了24.1%。
[1]J O K B R.Effect of hemicellulose and lignin removal on enzymatic hydrolysis of steam pretreated comstover [J].Bioresource Technology,2007(98) :2503-2510.
[2]岳晓禹,贺小营,牛天贵,等.木聚糖酶的研究进展[J].酿酒科技,2007(4) :113-115.
[3]付冠华,李端,周晨妍,等.木聚糖酶的研究进展及其应用[J].安徽农业科学,2011(35) :21566-21568.
[4]马文静,张美云,房桂干.木聚糖酶的应用研究进展[J].江苏造纸,2007(1) :48-50.
[5]Seyis I,Aksoz N.Effect of carbon and nitrogen sources on xylanase production by Trichoderma harzianum 1073 D3[J].International Biodeterioration & Biodegradation,2005,55(2) :115-119.
[6]李秀婷.微生物木聚糖酶及在食品工业中的应用[J].农业机械学报,2008(2) :175-179.
[7]武振军,石楠,吴启赐,等.响应面法优化木聚糖酶发酵培养基的研究[J].中国酿造,2010(8) :77-80.
[8]张爽,刘淑英,于莉莉,等.响应面法优化东北接骨木总黄酮的超声波提取工艺[J].北方园艺,2012(14) :11-14.
[9]刘刚,秦高,任雪.响应面法优化葵花粕中绿原酸提取工艺[J].安徽农业科学,2012(21) :11050-11052.
[10]Li Y,Liu Z,Zhao H,et al.Statistical optimization of xylanase production from new isolated Penicillium oxalicum ZH-30 in submerged fermentation[J].Biochemical Engineering Journal,2007,34(1) :82-86.
[11]张新峰,王伟平,汪蓉,等.嗜热真菌发酵产木聚糖酶培养基的优化及部分酶学性质的研究[J].食品工业科技,2011(10) :249-252.
[12]胡成旭,侯欣彤,冯永宁,等.响应面法优化云芝多糖提取条件的研究[J].食品工业科技,2007(7) :124-126.
[13]毛连山,勇强,姚春才,等.培养基成分对里氏木霉合成木聚糖酶的影响[J].现代化工,2005( S1) :151-153.
[14]魏瑛,童群义,李博.里氏木霉摇瓶发酵产木聚糖酶培养条件的优化[J].安徽农业大学学报,2008(2) :271-274.
[15]汪彬彬,车振明.Plackett-Burman 和Box-Benhnken Design 实验设计法优化华根霉产糖化酶发酵培养基的研究[J].食品科技,2011(5) :41-45.
[16]李勇昊,姜永生,周长海,等.响应面法优化里氏木霉Rut C-30 产纤维素酶液体培养基[J].中国酿造,2012(4) :29-32.
